1 . 有一包白色粉末状混合物,可能含有Na2CO3、NaCl、CaCO3、CuSO4、Na2SO4、MgCl2中的某几种,现进行如下实验。请根据实验现象回答各问题。
实验操作 | 实验结论 |
| (1)将混合物溶于水,得到无色透明溶液 | 原混合物肯定无 |
| (2)取少量上述溶液两份,其中一份加入BaCl2溶液,立即产生白色沉淀,再加入稀硝酸,沉淀不溶解 | 原混合物肯定有 无 |
| (3)在另一份溶液中加入NaOH溶液,也产生白色沉淀 | 原混合物肯定有 不能确定的物质是 |
您最近一年使用:0次
2019-04-09更新
|
159次组卷
|
2卷引用:【全国百强校】内蒙古自治区鄂尔多斯市第一中学2018-2019学年高二(文)下学期第一次月考化学试题
2 . 某化合物M(仅含三种短周期元素)是一种储氢材料。为探究M的组成和性质,设计并完成如下实验:

已知:化合物A仅含两种元素;气体B能使湿润的红色石蕊试纸变蓝。请回答:
(1)化合物M的组成元素是____ (用元素符号表示)。
(2)化合物A与水反应的化学方程式是____ 。
(3)镁带在足量气体B中燃烧可生成化合物M和一种单质气体,该反应的化学方程式是____ 。

已知:化合物A仅含两种元素;气体B能使湿润的红色石蕊试纸变蓝。请回答:
(1)化合物M的组成元素是
(2)化合物A与水反应的化学方程式是
(3)镁带在足量气体B中燃烧可生成化合物M和一种单质气体,该反应的化学方程式是
您最近一年使用:0次
名校
解题方法
3 . 碱式碳酸镁和无水氯化镁具有广泛用途。用白云石(CaCO3• MgCO3)为原料生产碱式碳酸镁和无水氯化镁的流程如下:
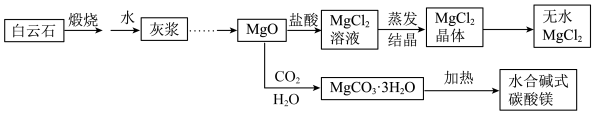
回答下列问题:
(1)“灰浆”中除水和MgO外,主要成分还有:_________________ 。
(2)为探究所制得的水合碱式碳酸镁(m MgCO3•n Mg(OH)2• xH2O )的组成。某同学组装仪器如图所示:

实验测得:硬质玻璃管中剩余的固体质量为1.60g,C处浓H2SO4增重0.72g,D处碱石灰增重1.32g,此水合碱式碳酸镁的化学式为:_______________________ 。
(3)A框中装置的作用是_____________________________________ 。
(4)在装好试剂后,加热前应进行的操作是___________________________________ 。

回答下列问题:
(1)“灰浆”中除水和MgO外,主要成分还有:
(2)为探究所制得的水合碱式碳酸镁(m MgCO3•n Mg(OH)2• xH2O )的组成。某同学组装仪器如图所示:

实验测得:硬质玻璃管中剩余的固体质量为1.60g,C处浓H2SO4增重0.72g,D处碱石灰增重1.32g,此水合碱式碳酸镁的化学式为:
(3)A框中装置的作用是
(4)在装好试剂后,加热前应进行的操作是
您最近一年使用:0次
4 . 某课外活动小组探究镁与CO2、NO2的反应。
(1)实验发现点燃的镁条能在CO2气体中继续燃烧,产生黑、白两种固体,请用化学反应解释该现象_____________ 。
(2)该小组采用类比Mg与CO2反应的思路对Mg与NO2的反应进行预测:写出Mg与NO2反应的化学方程式_____________ 。
(3)设计实验验证猜测(用于连接玻璃管的乳胶管均内衬锡纸)
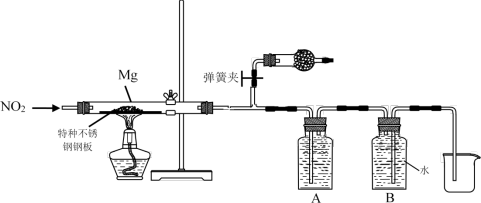
资料信息:2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
①装置A中的试剂是_____________ 。
②干燥管和装置B的作用分别是_____________ 、_____________ 。
③实验开始时正确的操作步骤是_____________ 。
a.通入NO2 b.打开弹簧夹
c.点燃酒精灯 d.当硬质玻璃管充满红综色气体后,关闭弹簧夹
(4)实验结束时,同学们观察到与预测相符合的现象,但当用水洗涤硬质玻璃管时,固体遇水产生有刺激性气味的气体,该气体能使湿润的石蕊试纸变蓝。
①同学们认为硬质玻璃管中还发生了另一个反应,该反应为_____________ ,
②请用化学方程式解释加水产生该气体的原因_____________ 。
(1)实验发现点燃的镁条能在CO2气体中继续燃烧,产生黑、白两种固体,请用化学反应解释该现象
(2)该小组采用类比Mg与CO2反应的思路对Mg与NO2的反应进行预测:写出Mg与NO2反应的化学方程式
(3)设计实验验证猜测(用于连接玻璃管的乳胶管均内衬锡纸)

资料信息:2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
①装置A中的试剂是
②干燥管和装置B的作用分别是
③实验开始时正确的操作步骤是
a.通入NO2 b.打开弹簧夹
c.点燃酒精灯 d.当硬质玻璃管充满红综色气体后,关闭弹簧夹
(4)实验结束时,同学们观察到与预测相符合的现象,但当用水洗涤硬质玻璃管时,固体遇水产生有刺激性气味的气体,该气体能使湿润的石蕊试纸变蓝。
①同学们认为硬质玻璃管中还发生了另一个反应,该反应为
②请用化学方程式解释加水产生该气体的原因
您最近一年使用:0次
2019-01-04更新
|
499次组卷
|
3卷引用:湖北省黄冈市罗田县第一中学2019届高三上学期12月月考理科综合化学试题
湖北省黄冈市罗田县第一中学2019届高三上学期12月月考理科综合化学试题鲁科版(2019)高一必修第一册第三章C 高考挑战区 过模拟 2年模拟精编精练(已下线)专题07 铝、镁及其化合物(限时精练)-2022年高三毕业班化学常考点归纳与变式演练
5 . 碱式氯化镁(MgOHCl)常用作塑料添加剂,工业上制备方法较多,其中利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁的工艺属于我国首创。某中学科研小组根据该原理设计如下装置图进行相关实验,装置C中CuO的质量为8.0 g。
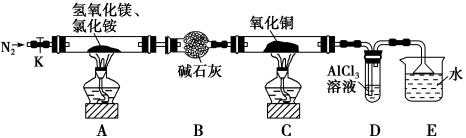
请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为:_____________________________ 。
(2)装置D中生成沉淀,发生反应的离子方程式为_________________________________ 。
(3)反应过程中持续通入N2的作用有两点:一是: 将装置A中产生的氨气完全导出,二是:_______________________________ 。
(4)若测得碱石灰的质量增加了a g,则得到碱式氯化镁的质量为_______ g。
(5)反应完毕,装置C中的氧化铜全部由黑色变为红色,称其质量为6.8 g,且生成的气体可直接排放到大气中,则红色固体是_______ ,该反应中转移电子的物质的量为_______ mol。
(6)请你设计一个实验方案证明装置C中的氧化铜反应完全后得到的红色固体中含有氧化亚铜。已知:①Cu2O+2H+===Cu2++Cu+H2O
②限选试剂:2 mol·L-1H2SO4溶液、浓硫酸、2 mol·L-1HNO3溶液、10 mol·L-1 HNO3溶液

请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为:
(2)装置D中生成沉淀,发生反应的离子方程式为
(3)反应过程中持续通入N2的作用有两点:一是: 将装置A中产生的氨气完全导出,二是:
(4)若测得碱石灰的质量增加了a g,则得到碱式氯化镁的质量为
(5)反应完毕,装置C中的氧化铜全部由黑色变为红色,称其质量为6.8 g,且生成的气体可直接排放到大气中,则红色固体是
(6)请你设计一个实验方案证明装置C中的氧化铜反应完全后得到的红色固体中含有氧化亚铜。已知:①Cu2O+2H+===Cu2++Cu+H2O
②限选试剂:2 mol·L-1H2SO4溶液、浓硫酸、2 mol·L-1HNO3溶液、10 mol·L-1 HNO3溶液
| 实验步骤 | 预期现象和结论 |
| 步骤1:取反应后装置C中的少许固体于试管中 | |
| 步骤2: |
您最近一年使用:0次
2018-12-05更新
|
382次组卷
|
4卷引用:山东省德州市夏津县第一中学2019届高三上学期12月月考化学试题
山东省德州市夏津县第一中学2019届高三上学期12月月考化学试题【全国百强校】山东省泰安市第一中学2019届高三上学期12月学情诊断化学试题【全国百强校】山东省济南市第一中学2019届高三上学期期中考试化学试题(已下线)微专题16 镁及其化合物的性质与海水提取镁的工艺流程-备战2022年高考化学考点微专题
2018高三上·全国·专题练习
名校
6 . 镁是一种银白色的碱土金属,镁元素在地壳中的含量约为2.00%,位居第八位,镁及其化合物在研究和生产中具有广泛用途。请回答下列问题:
(1)氮化镁(Mg3N2)是由氮和镁所组成的无机化合物。在室温下纯净的氮化镁为黄绿色的粉末,能与水反应,常用作触媒,实验室欲用如图1所示装置和药品制备少量氮化镁。
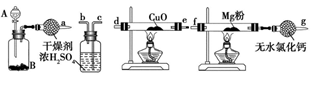
①A中盛装的是浓氨水,B中可盛装___ ,二者混合可制取氨气。
②按照气流的方向从左至右连接装置:a接___ 、___ 接___ 、___ 接___ 。
③已知氨气有还原性,能还原氧化铜,生成物之一是空气的主要成分,该反应的化学方程式为____________________ 。
④如果没有装有无水氯化钙的装置,可能发生反应的化学方程式为____________________ 。
(2)碳酸镁可用作耐火材料、锅炉和管道的保温材料,以及食品、药品、化妆品、橡胶、墨水等的添加剂。合成碳酸镁晶须的步骤如下:
步骤1:配制0.5 mol·L-1 MgSO4溶液和0.5 mol·L-1 NH4HCO3溶液。
步骤2:用量筒量取500 mL NH4HCO3溶液于1 000 mL四口烧瓶中,开启搅拌器,温度控制在50 ℃。
步骤3:将250 mL MgSO4溶液逐滴加入NH4HCO3溶液中,1 min内滴加完毕,然后用氨水调节溶液pH到9.5。
步骤4:放置1 h后,过滤,洗涤。
步骤5:在40 ℃的真空干燥箱中干燥10 h,得到碳酸镁晶须产品(MgCO3·nH2O,n=1~5)。
①配制0.5 mol·L-1 MgSO4溶液500 mL,需要的仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、_____ 。
②步骤3中加氨水后反应的离子方程式为______________ 。
测定合成的MgCO3·nH2O中的n值。
称量1.000 g碳酸镁晶须,放入图2所示的广口瓶中,加入适量水,滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5 h,后期将温度升到30 ℃,最后烧杯中的溶液用已知浓度的盐酸滴定,测得生成CO2的总量;重复上述操作2次。
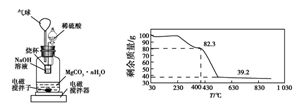
③图中气球的作用是__________________ 。
④上述反应后期要升温到30 ℃,主要目的是________________ 。
⑤若实验测得1.000 g碳酸镁晶须产生CO2的平均物质的量为a mol,则n为___ (用含a的表达式表示)。
⑥称取100 g上述晶须产品进行热重分析,得到的热重曲线如图所示,则合成的晶须中n=______ 。
(1)氮化镁(Mg3N2)是由氮和镁所组成的无机化合物。在室温下纯净的氮化镁为黄绿色的粉末,能与水反应,常用作触媒,实验室欲用如图1所示装置和药品制备少量氮化镁。

①A中盛装的是浓氨水,B中可盛装
②按照气流的方向从左至右连接装置:a接
③已知氨气有还原性,能还原氧化铜,生成物之一是空气的主要成分,该反应的化学方程式为
④如果没有装有无水氯化钙的装置,可能发生反应的化学方程式为
(2)碳酸镁可用作耐火材料、锅炉和管道的保温材料,以及食品、药品、化妆品、橡胶、墨水等的添加剂。合成碳酸镁晶须的步骤如下:
步骤1:配制0.5 mol·L-1 MgSO4溶液和0.5 mol·L-1 NH4HCO3溶液。
步骤2:用量筒量取500 mL NH4HCO3溶液于1 000 mL四口烧瓶中,开启搅拌器,温度控制在50 ℃。
步骤3:将250 mL MgSO4溶液逐滴加入NH4HCO3溶液中,1 min内滴加完毕,然后用氨水调节溶液pH到9.5。
步骤4:放置1 h后,过滤,洗涤。
步骤5:在40 ℃的真空干燥箱中干燥10 h,得到碳酸镁晶须产品(MgCO3·nH2O,n=1~5)。
①配制0.5 mol·L-1 MgSO4溶液500 mL,需要的仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、
②步骤3中加氨水后反应的离子方程式为
测定合成的MgCO3·nH2O中的n值。
称量1.000 g碳酸镁晶须,放入图2所示的广口瓶中,加入适量水,滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5 h,后期将温度升到30 ℃,最后烧杯中的溶液用已知浓度的盐酸滴定,测得生成CO2的总量;重复上述操作2次。

③图中气球的作用是
④上述反应后期要升温到30 ℃,主要目的是
⑤若实验测得1.000 g碳酸镁晶须产生CO2的平均物质的量为a mol,则n为
⑥称取100 g上述晶须产品进行热重分析,得到的热重曲线如图所示,则合成的晶须中n=
您最近一年使用:0次
2018-11-23更新
|
849次组卷
|
3卷引用:湖南省常德市芷兰实验学校2020届高三第二次月考化学试题
湖南省常德市芷兰实验学校2020届高三第二次月考化学试题(已下线)2018年11月25日 《每日一题》 人教版一轮复习-每周一测【全国百强校】湖南省长沙市长郡中学2019届高三上学期第五次调研考试化学试题
名校
7 . 某化学兴趣小组向盐酸中加入打磨后的镁条,产生大量气泡,一段时间后生成灰白色沉淀X,并测得反应后溶液酸性减弱,为探究和确认沉淀X的成分,该小组将沉淀X过滤洗涤后进行实验:向沉淀X中加入足量硝酸,固体溶解,得到无色溶液,将其分成两等份;向其中一份无色溶液中加入足量AgNO3溶液,得到白色沉淀a;向另一份无色溶液中加入足量NaOH溶液,得到白色沉淀b。回答下列问题:
(1)用化学方程式解释溶液酸性减弱的原因_____________________________
(2)沉淀a的化学式是_____________
(3)沉淀b的化学式是________________
(4)若a、b的物质的量关系为1︰3,则可推知沉淀X的化学式为_______________
(1)用化学方程式解释溶液酸性减弱的原因
(2)沉淀a的化学式是
(3)沉淀b的化学式是
(4)若a、b的物质的量关系为1︰3,则可推知沉淀X的化学式为
您最近一年使用:0次
2018高一上·全国·专题练习
8 . X、Y、Z三种物质有如图所示转化关系,其中X与稀盐酸不反应:
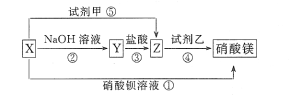
(1)根据上述转化关系,推断下列物质的化学式: X_____ ,Y_____ ,Z____ ,试剂甲____ ,试剂乙____ 。
(2)写出上述①~⑤步反应的离子方程式:
①____________________________________________ 。
②____________________________________________ 。
③____________________________________________ 。
④____________________________________________ 。
⑤____________________________________________ 。

(1)根据上述转化关系,推断下列物质的化学式: X
(2)写出上述①~⑤步反应的离子方程式:
①
②
③
④
⑤
您最近一年使用:0次
9 . 某校化学兴趣小组用如图所示过程除去AlCl3中含有的Mg2+、K+杂质离子,并尽可能减少AlCl3的损失.请回答下列问题:
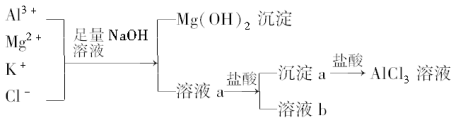
(1)写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:________ 、________ 、________ .氢氧化钠溶液能否用氨水代替,为什么?______________________ .
(2)溶液a中存在的离子有________ ;在溶液a中加入盐酸时需控制溶液的pH,为什么?________ ;为此,改进方法是____________________ .
(3)为了研究AlCl3晶体的性质,在得到AlCl3溶液后,如何得到AlCl3晶体?____________________ .

(1)写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:
(2)溶液a中存在的离子有
(3)为了研究AlCl3晶体的性质,在得到AlCl3溶液后,如何得到AlCl3晶体?
您最近一年使用:0次
解题方法
10 . 晶须是由高纯度单晶生长而成的微纳米级的短纤维,工业应用的晶须主要是在人工控制条件下合成。
碳酸镁晶须(MgCO3·nH2O,n = 1~5的整数)广泛应用于冶金、耐火材料及化工产品等领域。制取碳酸镁晶须的步骤如图:
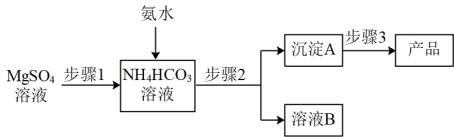
完成下列填空:
(1)步骤1必须将反应的温度控制在50℃,较好的加热方法是_______________________ ;氨水、硫酸镁、碳酸氢铵三者反应,除生成MgCO3·nH2O沉淀外,同时生成的产物还有______________________________________ 。
(2)步骤2是__________ 、洗涤,检验沉淀A已洗涤干净的方法是_____________________ 。
为测定碳酸镁晶须产品中n的值,某兴趣小组设计了如下装置,并进行了三次实验。(不考虑稀盐酸的挥发性)
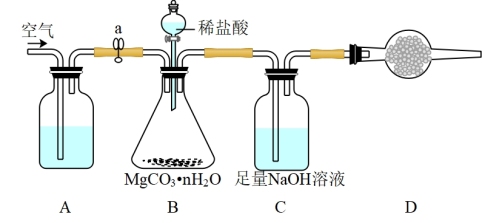
(3)装置A中盛放的溶液是_____________ 。装置D中盛放的固体是___________________ ,其作用是_________________________________ 。
(4)若三次实验测得每1.000g碳酸镁晶须产生的CO2平均值为a mol,则n值为__________________ (用含a的代数式表达)。
(5)下列选项中,会造成实验结果偏大的是____________ 。 (选填序号)
①实验开始,未先通空气,即称量装置C; ②B中反应结束后,没有继续通空气;
③缺少装置A; ④缺少装置D;
⑤装置B中稀盐酸的滴加速率过快; ⑥装置C中的NaOH溶液浓度过大。
碳酸镁晶须(MgCO3·nH2O,n = 1~5的整数)广泛应用于冶金、耐火材料及化工产品等领域。制取碳酸镁晶须的步骤如图:

完成下列填空:
(1)步骤1必须将反应的温度控制在50℃,较好的加热方法是
(2)步骤2是
为测定碳酸镁晶须产品中n的值,某兴趣小组设计了如下装置,并进行了三次实验。(不考虑稀盐酸的挥发性)

(3)装置A中盛放的溶液是
(4)若三次实验测得每1.000g碳酸镁晶须产生的CO2平均值为a mol,则n值为
(5)下列选项中,会造成实验结果偏大的是
①实验开始,未先通空气,即称量装置C; ②B中反应结束后,没有继续通空气;
③缺少装置A; ④缺少装置D;
⑤装置B中稀盐酸的滴加速率过快; ⑥装置C中的NaOH溶液浓度过大。
您最近一年使用:0次
2018-04-19更新
|
218次组卷
|
2卷引用:上海市静安区2017-2018学年高三第二学期教学质量检测化学试题



