名校
解题方法
1 . 某固体化合物X(含有三种短周期元素)是一种络合氢化物储氢材料,X中某种元素的单质可用于制造信号弹,该单质能在 气体中燃烧。某实验员对固体化合物X作如图实验:其中:X由三种短周期元素组成,且阴、阳离子个数比为2∶1;金属互化物——全部由金属元素组成的化合物。请回答:
气体中燃烧。某实验员对固体化合物X作如图实验:其中:X由三种短周期元素组成,且阴、阳离子个数比为2∶1;金属互化物——全部由金属元素组成的化合物。请回答:
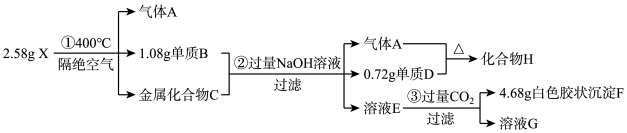
(1)化合物X的化学式为___________ 。
(2)单质B与NaOH溶液反应的离子方程式为___________ 。
(3)金属互化物C分别与足量盐酸和足量氢氧化钠溶液反应产生的气体物质的量之比为___________ 。
(4)溶液E和过量 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(5)气体A与单质D制备化合物H的过程中,通常产物中会夹杂单质D,请设计实验方案,检验产品中是否含有单质D:___________ 。
 气体中燃烧。某实验员对固体化合物X作如图实验:其中:X由三种短周期元素组成,且阴、阳离子个数比为2∶1;金属互化物——全部由金属元素组成的化合物。请回答:
气体中燃烧。某实验员对固体化合物X作如图实验:其中:X由三种短周期元素组成,且阴、阳离子个数比为2∶1;金属互化物——全部由金属元素组成的化合物。请回答:
(1)化合物X的化学式为
(2)单质B与NaOH溶液反应的离子方程式为
(3)金属互化物C分别与足量盐酸和足量氢氧化钠溶液反应产生的气体物质的量之比为
(4)溶液E和过量
 发生反应的离子方程式为
发生反应的离子方程式为(5)气体A与单质D制备化合物H的过程中,通常产物中会夹杂单质D,请设计实验方案,检验产品中是否含有单质D:
您最近一年使用:0次
2 . Ⅰ.氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为 ,另含少量杂质
,另含少量杂质 和
和 等)为原料制备高纯氧化镁的实验流程如下:
等)为原料制备高纯氧化镁的实验流程如下:
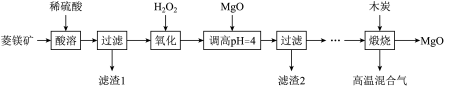
已知:① 不溶于稀硫酸和稀盐酸,
不溶于稀硫酸和稀盐酸,
②滤渣2中除了过量的MgO外,还含有 。
。
(1)酸溶时, 与稀硫酸反应的离子方程式为
与稀硫酸反应的离子方程式为___________ 。
(2)滤渣1的化学式为___________ 。
(3)“氧化”流程的目的把 氧化成
氧化成 ,再调节pH把
,再调节pH把 除去,写出“氧化”流程的离子方程式为
除去,写出“氧化”流程的离子方程式为___________ 。
Ⅱ.HNO2是一种弱酸,且不稳定,易分解生成NO和 ;它能被常见的强氧化剂氧化:在酸性溶液中它也是一种氧化剂,如能把
;它能被常见的强氧化剂氧化:在酸性溶液中它也是一种氧化剂,如能把 氧化成
氧化成 。AgNO2是一种难溶于水、易溶于酸的化合物,试回答下列问题:
。AgNO2是一种难溶于水、易溶于酸的化合物,试回答下列问题:
(4)人体正常的血红蛋白含有 ,若误食亚硝酸盐(如
,若误食亚硝酸盐(如 ),则导致血红蛋白中的
),则导致血红蛋白中的 转化为
转化为 而中毒,服用维生素C可解毒。下列叙述不正确的是___________(填字母)。
而中毒,服用维生素C可解毒。下列叙述不正确的是___________(填字母)。
(5)某同学把新制的氯水(主要成分 )加到
)加到 溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式,并用单线桥标出电子转移的方向和数目:
溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式,并用单线桥标出电子转移的方向和数目:___________ 。
 ,另含少量杂质
,另含少量杂质 和
和 等)为原料制备高纯氧化镁的实验流程如下:
等)为原料制备高纯氧化镁的实验流程如下:
已知:①
 不溶于稀硫酸和稀盐酸,
不溶于稀硫酸和稀盐酸,②滤渣2中除了过量的MgO外,还含有
 。
。(1)酸溶时,
 与稀硫酸反应的离子方程式为
与稀硫酸反应的离子方程式为(2)滤渣1的化学式为
(3)“氧化”流程的目的把
 氧化成
氧化成 ,再调节pH把
,再调节pH把 除去,写出“氧化”流程的离子方程式为
除去,写出“氧化”流程的离子方程式为Ⅱ.HNO2是一种弱酸,且不稳定,易分解生成NO和
 ;它能被常见的强氧化剂氧化:在酸性溶液中它也是一种氧化剂,如能把
;它能被常见的强氧化剂氧化:在酸性溶液中它也是一种氧化剂,如能把 氧化成
氧化成 。AgNO2是一种难溶于水、易溶于酸的化合物,试回答下列问题:
。AgNO2是一种难溶于水、易溶于酸的化合物,试回答下列问题:(4)人体正常的血红蛋白含有
 ,若误食亚硝酸盐(如
,若误食亚硝酸盐(如 ),则导致血红蛋白中的
),则导致血红蛋白中的 转化为
转化为 而中毒,服用维生素C可解毒。下列叙述不正确的是___________(填字母)。
而中毒,服用维生素C可解毒。下列叙述不正确的是___________(填字母)。| A.亚硝酸盐被还原 | B.维生素C是还原剂 |
C.维生素C将 还原为 还原为 | D.亚硝酸盐是还原剂 |
(5)某同学把新制的氯水(主要成分
 )加到
)加到 溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式,并用单线桥标出电子转移的方向和数目:
溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式,并用单线桥标出电子转移的方向和数目:
您最近一年使用:0次
3 . 氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为 MgCO3,含少量 FeCO3)为原料制备高纯氧化镁的实验流程如下:
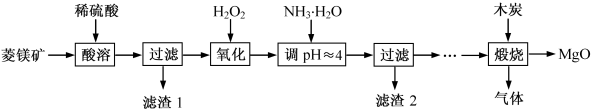
(1)滤渣 2 的成分是_______ (填化学式),过滤分离需要的玻璃仪器有___________ 。
(2)煅烧过程存在以下反应:
 ;
;


利用图装置对煅烧产生的气体进行分步吸收或收集。

D 中通过排水法收集的气体可以是_______ (填化学式)。C 中溶液用于吸收 CO2,B 中盛放的溶液可以是_______ (填字母)。
A.NaOH 溶液 B.Na2CO3 溶液 C.稀硝酸 D.KMnO4溶液
(3)A 中得到的淡黄色固体与热的 NaOH 溶液反应,产物中元素最高价态为+4,氧化产物和还原产物的质量之比是:___________ 。

(1)滤渣 2 的成分是
(2)煅烧过程存在以下反应:
 ;
;

利用图装置对煅烧产生的气体进行分步吸收或收集。

D 中通过排水法收集的气体可以是
A.NaOH 溶液 B.Na2CO3 溶液 C.稀硝酸 D.KMnO4溶液
(3)A 中得到的淡黄色固体与热的 NaOH 溶液反应,产物中元素最高价态为+4,氧化产物和还原产物的质量之比是:
您最近一年使用:0次
4 . 硼酸( )是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含
)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含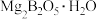 、
、 及少量
及少量 、
、 )为原料生产硼酸及轻质氧化镁的工艺流程如下:
)为原料生产硼酸及轻质氧化镁的工艺流程如下:
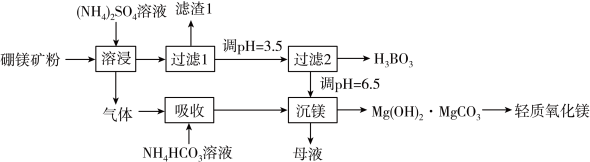
已知:
回答下列问题:
(1)在95℃“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式___________ 。
(2)“滤渣1”的主要成分有___________ (填化学式)。为检验“过滤1”后的滤液中是否含有 离子,可选用的化学试剂是
离子,可选用的化学试剂是___________ (填化学式)。
(3)已知 的电离方程式为
的电离方程式为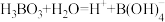 ,可知
,可知 为
为___________ 元弱酸,请写出 与足量
与足量 溶液反应的离子方程式
溶液反应的离子方程式___________ ;“过滤2”前,将溶液pH调节至3.5的目的是___________ 。
(4)“沉镁”后分离生成的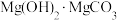 沉淀的操作为
沉淀的操作为___________ ,母液经加热后可返回___________ (填“溶浸”“吸收”或“沉镁”)工序循环使用。高温焙烧碱式碳酸镁可制备轻质氧化镁,写出化学方程式___________ 。
 )是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含
)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含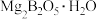 、
、 及少量
及少量 、
、 )为原料生产硼酸及轻质氧化镁的工艺流程如下:
)为原料生产硼酸及轻质氧化镁的工艺流程如下:
已知:

回答下列问题:
(1)在95℃“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式
(2)“滤渣1”的主要成分有
 离子,可选用的化学试剂是
离子,可选用的化学试剂是(3)已知
 的电离方程式为
的电离方程式为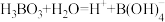 ,可知
,可知 为
为 与足量
与足量 溶液反应的离子方程式
溶液反应的离子方程式(4)“沉镁”后分离生成的
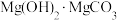 沉淀的操作为
沉淀的操作为
您最近一年使用:0次
名校
5 . 通过海水晾晒可得粗盐,粗盐中除NaCl外,还含有 、
、 、
、 以及泥沙等杂质,需要提纯后才能综合利用。某同学利用给定试剂NaOH溶液、
以及泥沙等杂质,需要提纯后才能综合利用。某同学利用给定试剂NaOH溶液、 溶液、
溶液、 溶液和盐酸,设计了如图粗盐精制的实验流程。(提示:根据实验目的,请思考试剂的用量)
溶液和盐酸,设计了如图粗盐精制的实验流程。(提示:根据实验目的,请思考试剂的用量)
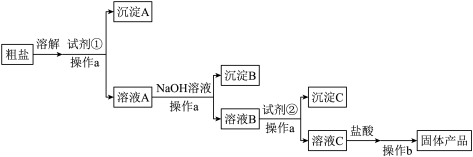
请回答:
(1)操作a名称是_______ 。
(2)试剂①是_______ 溶液(填化学式)。
(3)加入NaOH后,得到的主要沉淀B是_______ 。
(4)加入试剂②后,发生反应的离子方程式有_______ 。
(5)如果加入试剂②后直接加盐酸,产生的后果是_______ (用离子方程式表示)。
 、
、 、
、 以及泥沙等杂质,需要提纯后才能综合利用。某同学利用给定试剂NaOH溶液、
以及泥沙等杂质,需要提纯后才能综合利用。某同学利用给定试剂NaOH溶液、 溶液、
溶液、 溶液和盐酸,设计了如图粗盐精制的实验流程。(提示:根据实验目的,请思考试剂的用量)
溶液和盐酸,设计了如图粗盐精制的实验流程。(提示:根据实验目的,请思考试剂的用量)
请回答:
(1)操作a名称是
(2)试剂①是
(3)加入NaOH后,得到的主要沉淀B是
(4)加入试剂②后,发生反应的离子方程式有
(5)如果加入试剂②后直接加盐酸,产生的后果是
您最近一年使用:0次
6 . 从某固体混合物中提纯KCl固体的流程图如图,试回答下列问题:
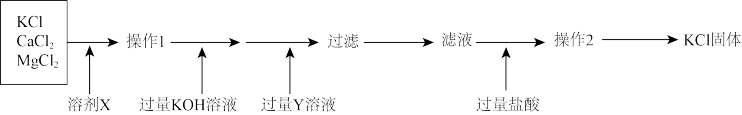
(1)溶剂X是____ ,加入过量KOH溶液发生的主要反应的离子方程式为_____ 。
(2)Y是____ ,过滤步骤得到的滤渣的主要成分为_____ (以上两空填写化学式)。
(3)过量盐酸的作用是____ ,加入盐酸后发生的反应的离子方程式为____ 。
(4)常温下,MgCO3在水中的溶解性为_____ (填“难溶”、“易溶”或“微溶”)。
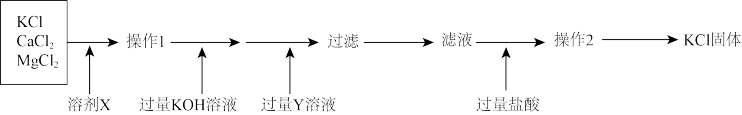
(1)溶剂X是
(2)Y是
(3)过量盐酸的作用是
(4)常温下,MgCO3在水中的溶解性为
您最近一年使用:0次
7 . 利用工业废渣(主要成分为MgCO3、MgSiO3和少量Fe2O3)制备MgCO3•3H2O。
实验步骤如下:
步骤1:将废渣加入30%H2SO4溶液中,待其充分反应后进行操作1。
步骤2:向“步骤1”所得的溶液中加入有机萃取剂HX(密度小于水)萃取Fe3+,静置分层后进行操作2。
步骤3:边搅拌边向“步骤2”所得的水溶液中滴加Na2CO3溶液,至有大量沉淀生成,过滤、用蒸馏水洗涤、干燥,得到MgCO3•3H2O。
回答下列问题:
(1)步骤1发生反应时温度控制在80℃,边加入废渣边搅拌。
①适宜的加热方式为____ ,含镁化合物发生反应的离子方程式为MgSiO3+2H+=Mg2++H2SiO3、____ 。
②判断废渣充分反应的方法为____ ,所加H2SO4不宜过多的原因是____ 。
(2)“步骤2”中HX萃取Fe3+的原理为Fe3+(aq)+3HX=FeX3(org)+3H+(aq),org表示有机相。
①“操作1”和“操作2”的名称分别为____ 、____ ,萃取过程中水溶液的pH将____ (填“升高”“降低”或“不变”)。
②萃取的具体操作为将萃取剂HX加入“步骤1”所得的溶液中____ 静置;重复多次“步骤2”,其目的是____ 。
(3)“步骤3”中检验MgCO3•3H2O洗涤干净的具体操作为____ 。
实验步骤如下:
步骤1:将废渣加入30%H2SO4溶液中,待其充分反应后进行操作1。
步骤2:向“步骤1”所得的溶液中加入有机萃取剂HX(密度小于水)萃取Fe3+,静置分层后进行操作2。
步骤3:边搅拌边向“步骤2”所得的水溶液中滴加Na2CO3溶液,至有大量沉淀生成,过滤、用蒸馏水洗涤、干燥,得到MgCO3•3H2O。
回答下列问题:
(1)步骤1发生反应时温度控制在80℃,边加入废渣边搅拌。
①适宜的加热方式为
②判断废渣充分反应的方法为
(2)“步骤2”中HX萃取Fe3+的原理为Fe3+(aq)+3HX=FeX3(org)+3H+(aq),org表示有机相。
①“操作1”和“操作2”的名称分别为
②萃取的具体操作为将萃取剂HX加入“步骤1”所得的溶液中
(3)“步骤3”中检验MgCO3•3H2O洗涤干净的具体操作为
您最近一年使用:0次
2022-10-19更新
|
129次组卷
|
2卷引用:广东省河源中学2022-2023学年高三10月教学质量检测化学试题
8 . Ⅰ.氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为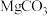 ,另含少量杂质
,另含少量杂质 和
和 等)为原料制备高纯氧化镁的实验流程如下:
等)为原料制备高纯氧化镁的实验流程如下:
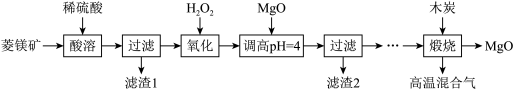
已知:① 不溶于稀硫酸和稀盐酸,②滤渣2中除了过量的MgO外,还含有
不溶于稀硫酸和稀盐酸,②滤渣2中除了过量的MgO外,还含有 。
。
(1)酸溶时,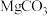 与稀硫酸反应的离子方程式为
与稀硫酸反应的离子方程式为_______ 。
(2)滤渣1的化学式为_______ 。
(3)“氧化”流程的目的把 氧化成
氧化成 ,再调节pH把
,再调节pH把 除去,写出“氧化”流程的离子方程式为
除去,写出“氧化”流程的离子方程式为_______ 。
Ⅱ.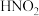 是一种弱酸,且不稳定,易分解生成NO和
是一种弱酸,且不稳定,易分解生成NO和 ;它能被常见的强氧化剂氧化:在酸性溶液中它也是一种氧化剂,如能把
;它能被常见的强氧化剂氧化:在酸性溶液中它也是一种氧化剂,如能把 氧化成
氧化成 。
。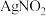 是一种难溶于水、易溶于酸的化合物,试回答下列问题:
是一种难溶于水、易溶于酸的化合物,试回答下列问题:
(4)人体正常的血红蛋白含有 ,若误食亚硝酸盐(如
,若误食亚硝酸盐(如 ),则导致血红蛋白中的
),则导致血红蛋白中的 转化为
转化为 而中毒,服用维生素C可解毒。下列叙述不正确的是_______(填字母)。
而中毒,服用维生素C可解毒。下列叙述不正确的是_______(填字母)。
(5)某同学把新制的氯水(主要成分 )加到
)加到 溶液中,观察到氯水褪色,同时生成
溶液中,观察到氯水褪色,同时生成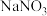 和HCl,请写出反应的离子方程式:
和HCl,请写出反应的离子方程式:_______ 。
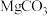 ,另含少量杂质
,另含少量杂质 和
和 等)为原料制备高纯氧化镁的实验流程如下:
等)为原料制备高纯氧化镁的实验流程如下:
已知:①
 不溶于稀硫酸和稀盐酸,②滤渣2中除了过量的MgO外,还含有
不溶于稀硫酸和稀盐酸,②滤渣2中除了过量的MgO外,还含有 。
。(1)酸溶时,
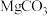 与稀硫酸反应的离子方程式为
与稀硫酸反应的离子方程式为(2)滤渣1的化学式为
(3)“氧化”流程的目的把
 氧化成
氧化成 ,再调节pH把
,再调节pH把 除去,写出“氧化”流程的离子方程式为
除去,写出“氧化”流程的离子方程式为Ⅱ.
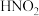 是一种弱酸,且不稳定,易分解生成NO和
是一种弱酸,且不稳定,易分解生成NO和 ;它能被常见的强氧化剂氧化:在酸性溶液中它也是一种氧化剂,如能把
;它能被常见的强氧化剂氧化:在酸性溶液中它也是一种氧化剂,如能把 氧化成
氧化成 。
。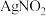 是一种难溶于水、易溶于酸的化合物,试回答下列问题:
是一种难溶于水、易溶于酸的化合物,试回答下列问题:(4)人体正常的血红蛋白含有
 ,若误食亚硝酸盐(如
,若误食亚硝酸盐(如 ),则导致血红蛋白中的
),则导致血红蛋白中的 转化为
转化为 而中毒,服用维生素C可解毒。下列叙述不正确的是_______(填字母)。
而中毒,服用维生素C可解毒。下列叙述不正确的是_______(填字母)。| A.亚硝酸盐被还原 | B.维生素C是还原剂 |
C.维生素C将 还原为 还原为 | D.亚硝酸盐是还原剂 |
 )加到
)加到 溶液中,观察到氯水褪色,同时生成
溶液中,观察到氯水褪色,同时生成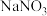 和HCl,请写出反应的离子方程式:
和HCl,请写出反应的离子方程式:
您最近一年使用:0次
2022-10-12更新
|
309次组卷
|
2卷引用:江苏省海安实验、句容三中、心湖高中2022-2023学年高一10月联考化学试题
9 . 过氧化镁( )不溶于水,与酸反应生成
)不溶于水,与酸反应生成 ,在医学上可作解酸剂。常温下
,在医学上可作解酸剂。常温下 较稳定,加热时会分解生成
较稳定,加热时会分解生成 和MgO。MgO与
和MgO。MgO与 反应可制得
反应可制得 ,同时放出大量热。一种制备
,同时放出大量热。一种制备 的流程如图所示:请回答下列问题:
的流程如图所示:请回答下列问题:
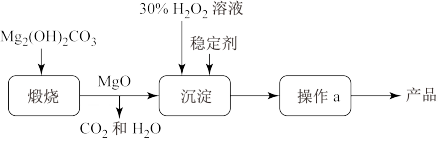
(1)过氧化镁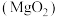 中氧元素的价态为
中氧元素的价态为_______ 。煅烧 的化学反应方程式
的化学反应方程式_______ 。
(2)上述制备过程中加入稳定剂的作用是_______ ;操作a为_______ 。
 产品中常会混有少量MgO,实验室可通过多种方案测定样品中
产品中常会混有少量MgO,实验室可通过多种方案测定样品中 的含量。某研究小组拟用下图装置测定样品(含
的含量。某研究小组拟用下图装置测定样品(含 杂质)中
杂质)中 的含量。
的含量。
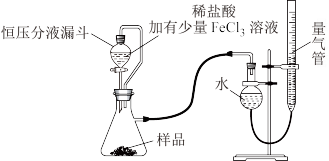
(3)研究小组的实验原理是(用化学方程式表示)
①_______ ;
②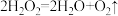 ,稀盐酸中加入
,稀盐酸中加入 溶液的作用是
溶液的作用是_______ 。
(4)实验中使用恒压分液漏斗的优点是:使分液漏斗中的溶液顺利滴下、_______ 。
(5)该小组记录的实验数据如下,样品的质量为mg;反应开始前量气管的读数为amL;反应结束后量气管的读数为bmL,则样品中过氧化镁的质量分数为_______ 。(该实验条件下 密度为
密度为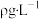 )
)
 )不溶于水,与酸反应生成
)不溶于水,与酸反应生成 ,在医学上可作解酸剂。常温下
,在医学上可作解酸剂。常温下 较稳定,加热时会分解生成
较稳定,加热时会分解生成 和MgO。MgO与
和MgO。MgO与 反应可制得
反应可制得 ,同时放出大量热。一种制备
,同时放出大量热。一种制备 的流程如图所示:请回答下列问题:
的流程如图所示:请回答下列问题:
(1)过氧化镁
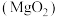 中氧元素的价态为
中氧元素的价态为 的化学反应方程式
的化学反应方程式(2)上述制备过程中加入稳定剂的作用是
 产品中常会混有少量MgO,实验室可通过多种方案测定样品中
产品中常会混有少量MgO,实验室可通过多种方案测定样品中 的含量。某研究小组拟用下图装置测定样品(含
的含量。某研究小组拟用下图装置测定样品(含 杂质)中
杂质)中 的含量。
的含量。
(3)研究小组的实验原理是(用化学方程式表示)
①
②
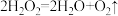 ,稀盐酸中加入
,稀盐酸中加入 溶液的作用是
溶液的作用是(4)实验中使用恒压分液漏斗的优点是:使分液漏斗中的溶液顺利滴下、
(5)该小组记录的实验数据如下,样品的质量为mg;反应开始前量气管的读数为amL;反应结束后量气管的读数为bmL,则样品中过氧化镁的质量分数为
 密度为
密度为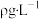 )
)
您最近一年使用:0次
名校
10 . 镁及其合金是用途很广的金属材料。大量的镁是从海水中提取的,其中的主要步骤如图:
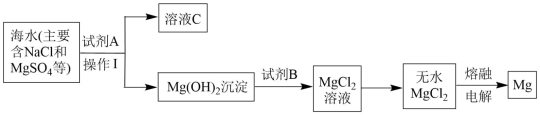
(1)为了使MgSO4转化为Mg(OH)2 ,综合经济角度考虑,试剂A可选用_______ 。
(2)操作分离得到Mg(OH)2沉淀的方法是_______ 。
(3)试剂B可以选用_______ (填化学式)。
(4)溶液C中的阴离子除了OH-外,主要还含有_______ (填离子符号)。
(5)工业上常用电解法冶炼一些非常活泼的金属,写出用无水MgCl2冶炼镁的化学方程_______ 。
(6)海水提镁时,由MgCl2溶液得到MgCl2·6H2O晶体的具体操作是_______ 、_______ 过滤,洗涤,干燥。

(1)为了使MgSO4转化为Mg(OH)2 ,综合经济角度考虑,试剂A可选用
(2)操作分离得到Mg(OH)2沉淀的方法是
(3)试剂B可以选用
(4)溶液C中的阴离子除了OH-外,主要还含有
(5)工业上常用电解法冶炼一些非常活泼的金属,写出用无水MgCl2冶炼镁的化学方程
(6)海水提镁时,由MgCl2溶液得到MgCl2·6H2O晶体的具体操作是
您最近一年使用:0次
2022-09-21更新
|
271次组卷
|
2卷引用:云南省楚雄天人中学2021-2022学年高二上学期12月月考化学试题(B卷)



