1 . 体操运动员在完成单杠、吊环项目时常用“镁粉”搓手,以起到防滑效果。某种“镁粉”中可能含有Mg、MgO、Mg(OH)2、MgCO3中的一种或两种固体,实验小组对其成分展开了探究。
已知:MgO+2HCl=MgCl2+H2O、MgCO3+2HCl=MgCl2+H2O+CO2↑。
(1)探究“镁粉”中是否含有Mg和MgCO3
①取少量样品,如图所示进行实验。观察到a试管中有气泡产生,b试管中产生的现象是澄清石灰水变浑浊,则证明“镁粉”中一定含有______ 。
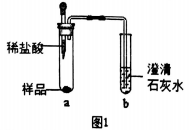
②为证明“镁粉”中是否含有Mg,小明将燃着的木条放在图中b试管口上方,木条熄灭。但同学们指出,该实验不能达成实验目的,需要将图中的澄清石灰水替换成浓NaOH溶液,目的是______________ 。小明按照修改后的实验方案重复上述实验,观察到b试管中无明显现象,证明“镁粉”中______________ 。
(2)探究“镁粉”中是否还含有MgO及Mg(OH)2
【实验过程】
Ⅰ.用MgO、Mg(OH)2和MgCO3三种固体分别做性质实验。分别取0.5g三种固体粉末,每次取样方法如图2所示:
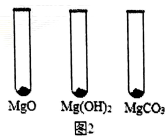
逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失。在下表中记录消耗的同浓度稀盐酸的体积(以下体积均在同一条件下测定,且保留到小数点后1位)
Mg(OH)2与盐酸发生中和反应的化学方程式为_____________ 。
Ⅱ.取“镁粉”样品0.5g,加入上述稀盐酸至粉末恰好溶解。此时消耗稀盐酸的体积约为5.3mL。
【实验分析及结论】
“镁粉”不只含有MgCO3。理由是____________________________________ 。
【实验反思】
为确定“镁粉”的具体成分,同学们认为还需要补充如下实验:分别取0.5g“镁粉”和0.5g_________ ,加入足量稀盐酸,测定生成的气体体积分别为119mL和140mL。由此可知“镁粉”中含有MgCO3的质量分数为___________ 。
已知:MgO+2HCl=MgCl2+H2O、MgCO3+2HCl=MgCl2+H2O+CO2↑。
(1)探究“镁粉”中是否含有Mg和MgCO3
①取少量样品,如图所示进行实验。观察到a试管中有气泡产生,b试管中产生的现象是澄清石灰水变浑浊,则证明“镁粉”中一定含有

②为证明“镁粉”中是否含有Mg,小明将燃着的木条放在图中b试管口上方,木条熄灭。但同学们指出,该实验不能达成实验目的,需要将图中的澄清石灰水替换成浓NaOH溶液,目的是
(2)探究“镁粉”中是否还含有MgO及Mg(OH)2
【实验过程】
Ⅰ.用MgO、Mg(OH)2和MgCO3三种固体分别做性质实验。分别取0.5g三种固体粉末,每次取样方法如图2所示:

逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失。在下表中记录消耗的同浓度稀盐酸的体积(以下体积均在同一条件下测定,且保留到小数点后1位)
| MgO | Mg(OH)2 | MgCO3 | |
| 消耗稀盐酸的体积/mL | 10.4 | 7.2 | 5.0 |
Ⅱ.取“镁粉”样品0.5g,加入上述稀盐酸至粉末恰好溶解。此时消耗稀盐酸的体积约为5.3mL。
【实验分析及结论】
“镁粉”不只含有MgCO3。理由是
【实验反思】
为确定“镁粉”的具体成分,同学们认为还需要补充如下实验:分别取0.5g“镁粉”和0.5g
您最近一年使用:0次
2016-12-09更新
|
480次组卷
|
3卷引用:浙江省台州市五校联考2019年9月高一阶段性考试化学试题
2 . 无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1,主要步骤如下:


步骤1 三颈瓶中装入10 g镁屑和150 mL无水乙醚;装置B中加入15 mL液溴。
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3 反应完毕后恢复至常温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4 室温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性。
②MgBr2+3C2H5OC2H5 MgBr2·3C2H5OC2H5
MgBr2·3C2H5OC2H5
请回答:
(1)仪器A的名称是____________ 。
实验中不能用干燥空气代替干燥N2,原因是___________ 。
(2)如将装置B改为装置C(图2),可能会导致的后果是___________ 。
(3)步骤3中,第一次过滤除去的物质是___________ 。
(4)有关步骤4的说法,正确的是___________ 。
(5)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:
Mg2++ Y4-="===Mg" Y2-
①滴定前润洗滴定管的操作方法是__________ 。
②测定时,先称取0.2500g无水MgBr2产品,溶解后,用0.0500 mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50 mL,则测得无水MgBr2产品的纯度是________________________ (以质量分数表示)。


步骤1 三颈瓶中装入10 g镁屑和150 mL无水乙醚;装置B中加入15 mL液溴。
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3 反应完毕后恢复至常温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4 室温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性。
②MgBr2+3C2H5OC2H5
 MgBr2·3C2H5OC2H5
MgBr2·3C2H5OC2H5请回答:
(1)仪器A的名称是
实验中不能用干燥空气代替干燥N2,原因是
(2)如将装置B改为装置C(图2),可能会导致的后果是
(3)步骤3中,第一次过滤除去的物质是
(4)有关步骤4的说法,正确的是
| A.可用95%的乙醇代替苯溶解粗品 | B.洗涤晶体可选用0℃的苯 |
| C.加热至160℃的主要目的是除去苯 | D.该步骤的目的是除去乙醚和可能残留的溴 |
Mg2++ Y4-="===Mg" Y2-
①滴定前润洗滴定管的操作方法是
②测定时,先称取0.2500g无水MgBr2产品,溶解后,用0.0500 mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50 mL,则测得无水MgBr2产品的纯度是
您最近一年使用:0次
2016-12-09更新
|
1506次组卷
|
6卷引用:2017届四川省成都树德中学高三10月月考化学卷
2017届四川省成都树德中学高三10月月考化学卷四川省雅安中学2018届高三上学期第一次月考化学试题【全国百强校】湖南省长沙市第一中学2019届高三下学期第七次月考理科综合化学试题2016年全国普通高等学校招生统一考试化学(浙江卷精编版)2016年全国普通高等学校招生统一考试化学(浙江卷参考版)(已下线)专题22.综合实验设计与评价-十年(2012-2021)高考化学真题分项汇编(浙江专用)
名校
3 . 氯离子插层镁铝水滑石[Mg2Al(OH)6Cl·xH2O]是一种新型离子交换材料,其在高温下完全分解为MgO、Al2O3、HCl和水蒸气,冷却玻管B能降低气体的温度,但不能液化水蒸气。现用下图装置进行实验确定其化学式(固定装置略去)。
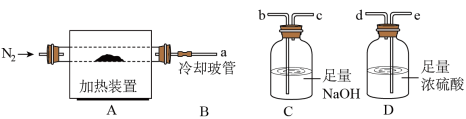
(1)Mg2Al(OH)6Cl·xH2O热分解的化学方程式为______________________ 。
(2)若只通过测定装置C、D的增重来确定x,则装置的连接顺序为_________ (按气流方向,用接口字母表示),其中C的作用是________ 。装置连接后,首先要进行的操作是_____________ 。
(3)加热前先通N2排尽装置中的空气,称取C、D的初始质量后,加热过程中持续通入N2的作用是____________________ ,停止加热后的冷却过程中仍要持续通入N2的作用是___________ 。
(4)完全分解后测得C增重3.65 g、D增重9.90 g,则x=_____ 。若取消冷却玻管B后进行实验,测定的x值将________ (填“偏高”或“偏低”)。

(1)Mg2Al(OH)6Cl·xH2O热分解的化学方程式为
(2)若只通过测定装置C、D的增重来确定x,则装置的连接顺序为
(3)加热前先通N2排尽装置中的空气,称取C、D的初始质量后,加热过程中持续通入N2的作用是
(4)完全分解后测得C增重3.65 g、D增重9.90 g,则x=
您最近一年使用:0次
2016-12-09更新
|
127次组卷
|
2卷引用:2016届甘肃省张掖市高三上第一次诊断考试理综化学试卷
4 . Mg能在NO2中燃烧,产物为Mg3N2、MgO和N2。某科学小组通过实验验证反应产物并探究产物的比例关系。资料信息:
2 NO2 +2NaOH=Na NO3+ Na NO2+H2O, Mg3N2+6 H2O=3 Mg(OH)2+2NH3↑
限用如下装置实验(夹持装置省略,部分仪器可重复使用)
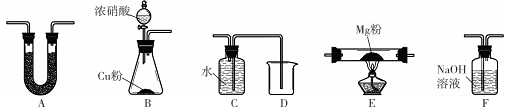
(1)装置连接的顺序为______ (填字母序号);
(2)连接好仪器,装入药品前检验装置气密性的方法是____ ;
(3)装置A中盛装的干燥剂是___ ;装置F的作用_____________ ;
(4)验证产物中存在Mg3 N2的具体实验操作为______________ .确定产物中有N。生成的实验现象为_____________ ;
(5)已知装置E中初始加入Mg粉质量为13.2 g,在足量的NO2中充分燃烧,实验结束后,硬质玻璃管冷却至室温、称量,测得硬质玻璃管中剩余固体的质量为21.0 g,产生N2的体积为1120 mL(标准状况)。写出玻璃管中发生反应的化学方程式:______ 。
2 NO2 +2NaOH=Na NO3+ Na NO2+H2O, Mg3N2+6 H2O=3 Mg(OH)2+2NH3↑
限用如下装置实验(夹持装置省略,部分仪器可重复使用)

(1)装置连接的顺序为
(2)连接好仪器,装入药品前检验装置气密性的方法是
(3)装置A中盛装的干燥剂是
(4)验证产物中存在Mg3 N2的具体实验操作为
(5)已知装置E中初始加入Mg粉质量为13.2 g,在足量的NO2中充分燃烧,实验结束后,硬质玻璃管冷却至室温、称量,测得硬质玻璃管中剩余固体的质量为21.0 g,产生N2的体积为1120 mL(标准状况)。写出玻璃管中发生反应的化学方程式:
您最近一年使用:0次
解题方法
5 . 镁合金是重要的民用和航空材料,镁作为一种强还原剂,还用于钛、镀和铀的生产,氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等。
(1)氧化镁的电子式为________ 。
(2)写出镁与TiCl4在高温条件下制取钛的化学方程式____________________ 。
(3)从海水中提取金属镁用到的主要化学药品有________________ 。
(4)某研究小组同学在实验室用卣块制备少量Mg(ClO3)2·6H2O,其流程如下:
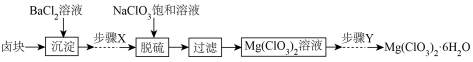
已知:I卤块主要成分为Mg Cl2·6H2O,含有MgSO4、FeCl2等杂质。Ⅱ可选用的试剂:H2O2,稀硫酸、KMnO4溶液、MgCl2溶液、MgO。
①加入BaCl2溶液的目的是____________ 。
②步骤X中需将Fe2+转化为Fe3+,所选的试剂为__________ 。
③Mg(ClO3)2加入到含有KSCN的FeSO4酸性溶液中立即出现红色,写出相关反应的离子方程式:________________________________________ 。
(1)氧化镁的电子式为
(2)写出镁与TiCl4在高温条件下制取钛的化学方程式
(3)从海水中提取金属镁用到的主要化学药品有
(4)某研究小组同学在实验室用卣块制备少量Mg(ClO3)2·6H2O,其流程如下:

已知:I卤块主要成分为Mg Cl2·6H2O,含有MgSO4、FeCl2等杂质。Ⅱ可选用的试剂:H2O2,稀硫酸、KMnO4溶液、MgCl2溶液、MgO。
①加入BaCl2溶液的目的是
②步骤X中需将Fe2+转化为Fe3+,所选的试剂为
③Mg(ClO3)2加入到含有KSCN的FeSO4酸性溶液中立即出现红色,写出相关反应的离子方程式:
您最近一年使用:0次
2016-12-09更新
|
334次组卷
|
2卷引用:2015届河南省天一高三上学期大联考化学试卷
13-14高三上·江苏扬州·阶段练习
名校
6 . 硼镁矿属于硼酸盐,可用来制备硼酸(H3BO3)和MgO,方法如下:硼镁矿粉与(NH4)2SO4溶液混合后加热,反应生成H3BO3晶体和MgSO4溶液,同时放出NH3;再向MgSO4溶液中通入NH3与CO2,得到MgCO3沉淀和滤液,沉淀经洗涤、煅烧后得MgO,滤液则循环使用。回答下列问题:
(1)与硅酸盐类似,硼酸盐结构也比较复杂,如硬硼钙石化学式为Ca2B6O11·5H2O,将其改写为氧化物的形式_____________________________ 。
(2)上述制备过程中,检验沉淀洗涤是否完全的方法是_______________________ 。
(3)写出MgSO4溶液中通入NH3与CO2反应的化学方程式_______________________ 。
(4)若准确称取1.68 g硼镁矿,完全反应后得H3BO3晶体1.24 g,MgO 0.8 g,计算该硼酸盐的组成。(写出计算过程)___________________
(1)与硅酸盐类似,硼酸盐结构也比较复杂,如硬硼钙石化学式为Ca2B6O11·5H2O,将其改写为氧化物的形式
(2)上述制备过程中,检验沉淀洗涤是否完全的方法是
(3)写出MgSO4溶液中通入NH3与CO2反应的化学方程式
(4)若准确称取1.68 g硼镁矿,完全反应后得H3BO3晶体1.24 g,MgO 0.8 g,计算该硼酸盐的组成。(写出计算过程)
您最近一年使用:0次
2016-12-09更新
|
502次组卷
|
3卷引用:2013届江苏省扬州市高三第一学期检测试题化学试卷
10-11高一下·湖北黄冈·阶段练习
7 . 由短周期元素组成的A、B、C、D、E、F六种微粒,其中只有C、D是分子,其余四种均为阳离子或阴离子,且每个微粒中都含有10个电子。已知A、E是由非金属元素组成的阳离子,六种微粒间有下列关系:
①A++B- C+D, B-+E+=2D;
C+D, B-+E+=2D;
②通常情况下,C是一种无色刺激性气味的气体,且可使湿润的红色石蕊试纸变蓝;
③向含F离子的溶液中加入C的水溶液,可生成白色沉淀W,C溶液过量沉淀也不消失。再加入含大量B离子或大量E离子的溶液时,沉淀W在其中一种情况下溶解,另一种情况下不溶解。
请回答下列问题:
(1)微粒A的名称及化学式分别为_____________ 、_________________ 。
(2)C的水溶液中存在的分子总数至少有___________ 种。
(3)写出微粒F与过量C的水溶液反应的离子方程式:__________________________ 。
(4)向含有0.1mol F离子的50mL溶液中,加入含1.5mol/L B离子的200mL强碱溶液,结果有白色沉淀产生,再向该混合物中加入含1mol/L E离子的强酸溶液,若要使沉淀恰好溶解,则最后加入的溶液的体积至少为___________ mL。
①A++B-
 C+D, B-+E+=2D;
C+D, B-+E+=2D;②通常情况下,C是一种无色刺激性气味的气体,且可使湿润的红色石蕊试纸变蓝;
③向含F离子的溶液中加入C的水溶液,可生成白色沉淀W,C溶液过量沉淀也不消失。再加入含大量B离子或大量E离子的溶液时,沉淀W在其中一种情况下溶解,另一种情况下不溶解。
请回答下列问题:
(1)微粒A的名称及化学式分别为
(2)C的水溶液中存在的分子总数至少有
(3)写出微粒F与过量C的水溶液反应的离子方程式:
(4)向含有0.1mol F离子的50mL溶液中,加入含1.5mol/L B离子的200mL强碱溶液,结果有白色沉淀产生,再向该混合物中加入含1mol/L E离子的强酸溶液,若要使沉淀恰好溶解,则最后加入的溶液的体积至少为
您最近一年使用:0次
8 . 硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:

根据题意回答下列问题:
(1)实验中需用1mol/L的硫酸80mL,若用98%的浓硫酸来配制,除量筒、玻璃棒外,还需要的玻璃仪器有_________ 。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有_________ 。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式_________ 。在调节pH=5-6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为________________ 。
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法_________ 。
(5)已知MgSO4、CaSO4的溶解度如下表:
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤_________ 、_________ 。
(6)如果提供的硼镁泥共100 g,得到的MgSO4·7H2O 196.8 g,则MgSO4·7H2O的产率为_________ 。

根据题意回答下列问题:
(1)实验中需用1mol/L的硫酸80mL,若用98%的浓硫酸来配制,除量筒、玻璃棒外,还需要的玻璃仪器有
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法
(5)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤
(6)如果提供的硼镁泥共100 g,得到的MgSO4·7H2O 196.8 g,则MgSO4·7H2O的产率为
您最近一年使用:0次



