1 . Ⅰ.氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为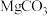 ,另含少量杂质
,另含少量杂质 和
和 等)为原料制备高纯氧化镁的实验流程如下:
等)为原料制备高纯氧化镁的实验流程如下:
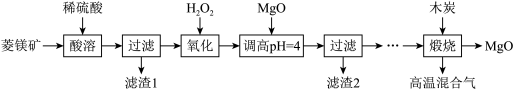
已知:① 不溶于稀硫酸和稀盐酸,②滤渣2中除了过量的MgO外,还含有
不溶于稀硫酸和稀盐酸,②滤渣2中除了过量的MgO外,还含有 。
。
(1)酸溶时,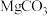 与稀硫酸反应的离子方程式为
与稀硫酸反应的离子方程式为_______ 。
(2)滤渣1的化学式为_______ 。
(3)“氧化”流程的目的把 氧化成
氧化成 ,再调节pH把
,再调节pH把 除去,写出“氧化”流程的离子方程式为
除去,写出“氧化”流程的离子方程式为_______ 。
Ⅱ.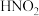 是一种弱酸,且不稳定,易分解生成NO和
是一种弱酸,且不稳定,易分解生成NO和 ;它能被常见的强氧化剂氧化:在酸性溶液中它也是一种氧化剂,如能把
;它能被常见的强氧化剂氧化:在酸性溶液中它也是一种氧化剂,如能把 氧化成
氧化成 。
。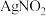 是一种难溶于水、易溶于酸的化合物,试回答下列问题:
是一种难溶于水、易溶于酸的化合物,试回答下列问题:
(4)人体正常的血红蛋白含有 ,若误食亚硝酸盐(如
,若误食亚硝酸盐(如 ),则导致血红蛋白中的
),则导致血红蛋白中的 转化为
转化为 而中毒,服用维生素C可解毒。下列叙述不正确的是_______(填字母)。
而中毒,服用维生素C可解毒。下列叙述不正确的是_______(填字母)。
(5)某同学把新制的氯水(主要成分 )加到
)加到 溶液中,观察到氯水褪色,同时生成
溶液中,观察到氯水褪色,同时生成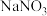 和HCl,请写出反应的离子方程式:
和HCl,请写出反应的离子方程式:_______ 。
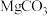 ,另含少量杂质
,另含少量杂质 和
和 等)为原料制备高纯氧化镁的实验流程如下:
等)为原料制备高纯氧化镁的实验流程如下:
已知:①
 不溶于稀硫酸和稀盐酸,②滤渣2中除了过量的MgO外,还含有
不溶于稀硫酸和稀盐酸,②滤渣2中除了过量的MgO外,还含有 。
。(1)酸溶时,
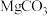 与稀硫酸反应的离子方程式为
与稀硫酸反应的离子方程式为(2)滤渣1的化学式为
(3)“氧化”流程的目的把
 氧化成
氧化成 ,再调节pH把
,再调节pH把 除去,写出“氧化”流程的离子方程式为
除去,写出“氧化”流程的离子方程式为Ⅱ.
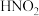 是一种弱酸,且不稳定,易分解生成NO和
是一种弱酸,且不稳定,易分解生成NO和 ;它能被常见的强氧化剂氧化:在酸性溶液中它也是一种氧化剂,如能把
;它能被常见的强氧化剂氧化:在酸性溶液中它也是一种氧化剂,如能把 氧化成
氧化成 。
。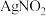 是一种难溶于水、易溶于酸的化合物,试回答下列问题:
是一种难溶于水、易溶于酸的化合物,试回答下列问题:(4)人体正常的血红蛋白含有
 ,若误食亚硝酸盐(如
,若误食亚硝酸盐(如 ),则导致血红蛋白中的
),则导致血红蛋白中的 转化为
转化为 而中毒,服用维生素C可解毒。下列叙述不正确的是_______(填字母)。
而中毒,服用维生素C可解毒。下列叙述不正确的是_______(填字母)。| A.亚硝酸盐被还原 | B.维生素C是还原剂 |
C.维生素C将 还原为 还原为 | D.亚硝酸盐是还原剂 |
 )加到
)加到 溶液中,观察到氯水褪色,同时生成
溶液中,观察到氯水褪色,同时生成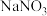 和HCl,请写出反应的离子方程式:
和HCl,请写出反应的离子方程式:
您最近一年使用:0次
2022-10-12更新
|
336次组卷
|
2卷引用:江苏省海安实验、句容三中、心湖高中2022-2023学年高一10月联考化学试题
2 . 过氧化镁( )不溶于水,与酸反应生成
)不溶于水,与酸反应生成 ,在医学上可作解酸剂。常温下
,在医学上可作解酸剂。常温下 较稳定,加热时会分解生成
较稳定,加热时会分解生成 和MgO。MgO与
和MgO。MgO与 反应可制得
反应可制得 ,同时放出大量热。一种制备
,同时放出大量热。一种制备 的流程如图所示:请回答下列问题:
的流程如图所示:请回答下列问题:
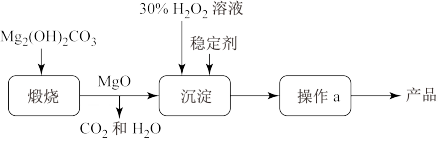
(1)过氧化镁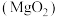 中氧元素的价态为
中氧元素的价态为_______ 。煅烧 的化学反应方程式
的化学反应方程式_______ 。
(2)上述制备过程中加入稳定剂的作用是_______ ;操作a为_______ 。
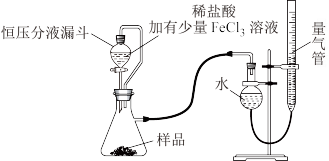
 产品中常会混有少量MgO,实验室可通过多种方案测定样品中
产品中常会混有少量MgO,实验室可通过多种方案测定样品中 的含量。某研究小组拟用下图装置测定样品(含
的含量。某研究小组拟用下图装置测定样品(含 杂质)中
杂质)中 的含量。
的含量。
(3)研究小组的实验原理是(用化学方程式表示)
①_______ ;
②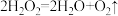 ,稀盐酸中加入
,稀盐酸中加入 溶液的作用是
溶液的作用是_______ 。
(4)实验中使用恒压分液漏斗的优点是:使分液漏斗中的溶液顺利滴下、_______ 。
(5)该小组记录的实验数据如下,样品的质量为mg;反应开始前量气管的读数为amL;反应结束后量气管的读数为bmL,则样品中过氧化镁的质量分数为_______ 。(该实验条件下 密度为
密度为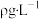 )
)
 )不溶于水,与酸反应生成
)不溶于水,与酸反应生成 ,在医学上可作解酸剂。常温下
,在医学上可作解酸剂。常温下 较稳定,加热时会分解生成
较稳定,加热时会分解生成 和MgO。MgO与
和MgO。MgO与 反应可制得
反应可制得 ,同时放出大量热。一种制备
,同时放出大量热。一种制备 的流程如图所示:请回答下列问题:
的流程如图所示:请回答下列问题:
(1)过氧化镁
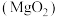 中氧元素的价态为
中氧元素的价态为 的化学反应方程式
的化学反应方程式(2)上述制备过程中加入稳定剂的作用是
 产品中常会混有少量MgO,实验室可通过多种方案测定样品中
产品中常会混有少量MgO,实验室可通过多种方案测定样品中 的含量。某研究小组拟用下图装置测定样品(含
的含量。某研究小组拟用下图装置测定样品(含 杂质)中
杂质)中 的含量。
的含量。
(3)研究小组的实验原理是(用化学方程式表示)
①
②
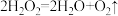 ,稀盐酸中加入
,稀盐酸中加入 溶液的作用是
溶液的作用是(4)实验中使用恒压分液漏斗的优点是:使分液漏斗中的溶液顺利滴下、
(5)该小组记录的实验数据如下,样品的质量为mg;反应开始前量气管的读数为amL;反应结束后量气管的读数为bmL,则样品中过氧化镁的质量分数为
 密度为
密度为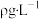 )
)
您最近一年使用:0次
名校
3 . 镁及其合金是用途很广的金属材料。大量的镁是从海水中提取的,其中的主要步骤如图:
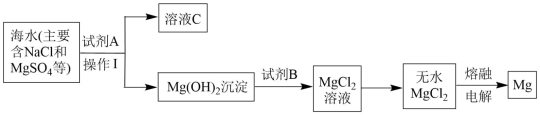
(1)为了使MgSO4转化为Mg(OH)2 ,综合经济角度考虑,试剂A可选用_______ 。
(2)操作分离得到Mg(OH)2沉淀的方法是_______ 。
(3)试剂B可以选用_______ (填化学式)。
(4)溶液C中的阴离子除了OH-外,主要还含有_______ (填离子符号)。
(5)工业上常用电解法冶炼一些非常活泼的金属,写出用无水MgCl2冶炼镁的化学方程_______ 。
(6)海水提镁时,由MgCl2溶液得到MgCl2·6H2O晶体的具体操作是_______ 、_______ 过滤,洗涤,干燥。

(1)为了使MgSO4转化为Mg(OH)2 ,综合经济角度考虑,试剂A可选用
(2)操作分离得到Mg(OH)2沉淀的方法是
(3)试剂B可以选用
(4)溶液C中的阴离子除了OH-外,主要还含有
(5)工业上常用电解法冶炼一些非常活泼的金属,写出用无水MgCl2冶炼镁的化学方程
(6)海水提镁时,由MgCl2溶液得到MgCl2·6H2O晶体的具体操作是
您最近一年使用:0次
2022-09-21更新
|
360次组卷
|
2卷引用:云南省楚雄天人中学2021-2022学年高二上学期12月月考化学试题(B卷)
名校
解题方法
4 . 菱镁矿的主要成分为MgCO3,还含少量SiO2、Fe2O3和Al2O3。工业上利用菱镁矿冶炼镁的具体工业流程如下图。
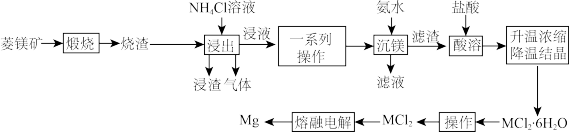
回答下列问题:
(1)“煅烧”时,需将菱镁矿粉碎,这种操作的目的为_______ 。
(2)“浸出”操作中溶解氧化镁的离子方程式为_______ 。
(3)“沉镁”操作中温度不宜过高,原因为_______ 。
(4)“一系列操作”的目的是_______(填字母)。
(5)“操作”具体是指_______ 。
(6)“沉镁”过程中当镁离子沉淀完全时(c 1×10-5mol/L),溶液中c(NH
1×10-5mol/L),溶液中c(NH ) : c(NH3·H2O)最大为
) : c(NH3·H2O)最大为_______ (填计算结果)。(已知Kb(NH3·H2O)=1.6×10-5;Ksp[Mg(OH)2]=1.0×10-11)

回答下列问题:
(1)“煅烧”时,需将菱镁矿粉碎,这种操作的目的为
(2)“浸出”操作中溶解氧化镁的离子方程式为
(3)“沉镁”操作中温度不宜过高,原因为
(4)“一系列操作”的目的是_______(填字母)。
| A.沉硅 | B.沉铁 | C.沉铝 | D.除氯 |
(6)“沉镁”过程中当镁离子沉淀完全时(c
 1×10-5mol/L),溶液中c(NH
1×10-5mol/L),溶液中c(NH ) : c(NH3·H2O)最大为
) : c(NH3·H2O)最大为
您最近一年使用:0次
5 . 氮化锶(Sr3N2)在工业上广泛用于生产荧光粉。已知:锶与镁同一主族,金属锶与氮气在加热条件下可生成氮化锶,氮化锶易水解,遇水剧烈反应。

Ⅰ.利用装置A和C制备Sr3N2
(1)装置A中仪器b的名称是__ ,a导管的作用是___ 。
(2)写出由装置A制备N2的化学方程式:__ 。
(3)操作中,应先点燃装置A的酒精灯一段时间后,再点燃装置C的酒精灯,这样操作的理由是___ 。
Ⅱ.利用装置B和C制备Sr3N2。(已知:氧气可被连苯三酚溶液定量吸收。)
(4)写出装置B的NaOH溶液中发生反应的离子方程式:__ 。
(5)装置C中广口瓶盛放的试剂是__ 。
Ⅲ.测定Sr3N2产品的纯度
(6)取10.0g该产品,向其中加入适量的水,直接将生成的气体全部通入浓硫酸中,利用浓硫酸增重质量计算得到产品的纯度,该方法测得产品的纯度偏高,其原因是__ 。经改进后测得浓硫酸增重1.02g,则产品的纯度为__ 。

Ⅰ.利用装置A和C制备Sr3N2
(1)装置A中仪器b的名称是
(2)写出由装置A制备N2的化学方程式:
(3)操作中,应先点燃装置A的酒精灯一段时间后,再点燃装置C的酒精灯,这样操作的理由是
Ⅱ.利用装置B和C制备Sr3N2。(已知:氧气可被连苯三酚溶液定量吸收。)
(4)写出装置B的NaOH溶液中发生反应的离子方程式:
(5)装置C中广口瓶盛放的试剂是
Ⅲ.测定Sr3N2产品的纯度
(6)取10.0g该产品,向其中加入适量的水,直接将生成的气体全部通入浓硫酸中,利用浓硫酸增重质量计算得到产品的纯度,该方法测得产品的纯度偏高,其原因是
您最近一年使用:0次
2021-10-24更新
|
351次组卷
|
4卷引用:深圳市宝安区2021-2022学年高三上学期第一次调研化学试题
深圳市宝安区2021-2022学年高三上学期第一次调研化学试题湖南省郴州市第一中学2023届高三下学期第七次月考化学试题湖南省株洲市第二中学2023届高三第七次月考化学试题(已下线)预测卷01-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)
名校
解题方法
6 . 以水氯镁石(主要成分是MgCl2﹒6H2O)生产碱式碳酸镁[Mga(CO3)b(OH)c﹒nH2O]的主要流程如下:
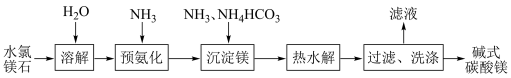
(1)溶解时将水氯镁石粉碎的目的是___________ 。
(2)预氨化过程中有Mg(OH)2沉淀生成,该过程中发生反应的离子方程式___________ 。
(3)沉淀镁时反应的温度不宜过高,原因是___________ 。
(4)将上述流程中的滤液浓缩结晶,所得的主要固体物质的化学式为___________ 。
(5)上述流程中检验“过滤”后碱式碳酸镁洗涤是否干净的操作为___________ 。
(6)高温煅烧碱式碳酸镁得到氧化镁,取碱式碳酸镁4.84g,高温煅烧至恒重,得到固体2.00g和标准状况下二氧化碳0.896L,通过计算确定碱式碳酸镁的化学式。(写出解题过程)___________

(1)溶解时将水氯镁石粉碎的目的是
(2)预氨化过程中有Mg(OH)2沉淀生成,该过程中发生反应的离子方程式
(3)沉淀镁时反应的温度不宜过高,原因是
(4)将上述流程中的滤液浓缩结晶,所得的主要固体物质的化学式为
(5)上述流程中检验“过滤”后碱式碳酸镁洗涤是否干净的操作为
(6)高温煅烧碱式碳酸镁得到氧化镁,取碱式碳酸镁4.84g,高温煅烧至恒重,得到固体2.00g和标准状况下二氧化碳0.896L,通过计算确定碱式碳酸镁的化学式。(写出解题过程)
您最近一年使用:0次
名校
解题方法
7 . 钛及其合金具有密度小,强度高,耐腐蚀等优良性能,被广泛用于航天、航空、航海、石油化工、医药等部门,因此,钛被誉为第三金属和战略金属。从钛铁矿提取金属钛(海绵钛)的主要工艺过程如下:
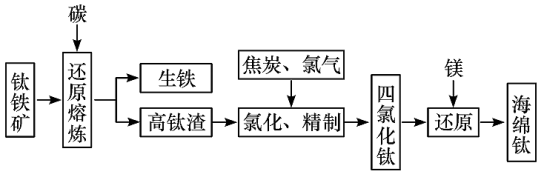
(1)钛铁矿的主要成分是FeTiO3,第一步发生的反应: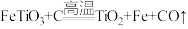 ,在FeTiO3 (钛酸亚铁)中,钛的化合价为
,在FeTiO3 (钛酸亚铁)中,钛的化合价为___________ 。
(2)第二步:二氧化钛在高温下与焦炭、氯气反应生成四氯化钛和一氧化碳,写出化学方程式:___________ ,还原产物是___________ 。
(3)用镁在高温下还原四氯化钛,该反应的环境要求是___________ ;写出化学方程式:___________ 。
(4)菱镁矿(主要成分是碳酸镁)煅烧后与焦炭混合在氯化器中高温下通入氯气生成氯化镁,电解熔融氯化镁得到镁。写出菱镁矿煅烧及氯化制取氯化镁的化学方程式:___________ ;___________ 。

(1)钛铁矿的主要成分是FeTiO3,第一步发生的反应:
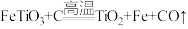 ,在FeTiO3 (钛酸亚铁)中,钛的化合价为
,在FeTiO3 (钛酸亚铁)中,钛的化合价为(2)第二步:二氧化钛在高温下与焦炭、氯气反应生成四氯化钛和一氧化碳,写出化学方程式:
(3)用镁在高温下还原四氯化钛,该反应的环境要求是
(4)菱镁矿(主要成分是碳酸镁)煅烧后与焦炭混合在氯化器中高温下通入氯气生成氯化镁,电解熔融氯化镁得到镁。写出菱镁矿煅烧及氯化制取氯化镁的化学方程式:
您最近一年使用:0次
2021-09-14更新
|
453次组卷
|
3卷引用:湖南省长沙市湖南师范大学附属中学2021-2022学年高三上学期第一次月考化学试题
湖南省长沙市湖南师范大学附属中学2021-2022学年高三上学期第一次月考化学试题湖北省麻城市实验高级中学2021-2022学年高二上学期9月月考化学(B卷)试卷(已下线)专题06 钛铬锰元素拓展之工业流程大题-【微专题·大素养】备战2022年高考化学核心突破(元素拓展综合题)
名校
8 . 镁及其化合物有着广泛用途。工业上以菱镁矿(主要成分为 ,含
,含 以及少量
以及少量 等杂质)为原料制备纳米氧化镁的实验流程如下:
等杂质)为原料制备纳米氧化镁的实验流程如下:
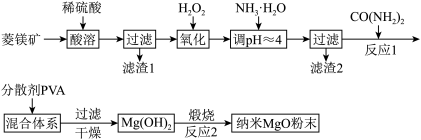
(1)滤渣1的主要成分为_______ 。
(2)加入 氧化时,发生反应的离子方程式为
氧化时,发生反应的离子方程式为_______ 。
(3)一定条件下 可与
可与 反应生成
反应生成 和一种弱碱,该反应的化学方程式为
和一种弱碱,该反应的化学方程式为____ 。
(4)工业上还可用氯化镁和碳酸铵为原料,采用直接沉淀法制备纳米 。取少量制得的该物质分散于某种液体溶剂中(两者不反应),能说明纳米
。取少量制得的该物质分散于某种液体溶剂中(两者不反应),能说明纳米 存在的简单方法是
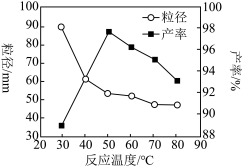
存在的简单方法是___ 。如图为反应温度对纳米 产率和粒径的影响,据图分析反应的最佳温度为
产率和粒径的影响,据图分析反应的最佳温度为___ 。
(5)所加 不宜过量太多的原因是
不宜过量太多的原因是____ 。
(6)主要副产品是____ 。
 ,含
,含 以及少量
以及少量 等杂质)为原料制备纳米氧化镁的实验流程如下:
等杂质)为原料制备纳米氧化镁的实验流程如下:
(1)滤渣1的主要成分为
(2)加入
 氧化时,发生反应的离子方程式为
氧化时,发生反应的离子方程式为(3)一定条件下
 可与
可与 反应生成
反应生成 和一种弱碱,该反应的化学方程式为
和一种弱碱,该反应的化学方程式为(4)工业上还可用氯化镁和碳酸铵为原料,采用直接沉淀法制备纳米
 。取少量制得的该物质分散于某种液体溶剂中(两者不反应),能说明纳米
。取少量制得的该物质分散于某种液体溶剂中(两者不反应),能说明纳米 存在的简单方法是
存在的简单方法是 产率和粒径的影响,据图分析反应的最佳温度为
产率和粒径的影响,据图分析反应的最佳温度为
(5)所加
 不宜过量太多的原因是
不宜过量太多的原因是(6)主要副产品是
您最近一年使用:0次
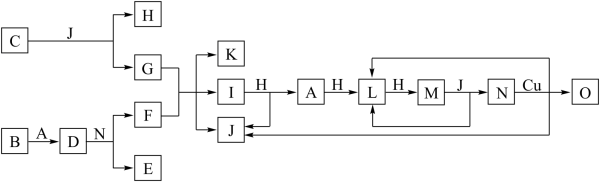
9 . 已知A~O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。A、B、H分别是由短周期元素组成的单质。B元素为第三周期第IIA族。J常温下为液体。D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。
请回答下列问题:
(1)D为_______ 。(填化学式)
(2)I的沸点比PH3的沸点高,其原因是_______ 。
(3)写出I与H在点燃条件下反应生成A和J的化学方程式:_______ 。
(4)写出N与FeO反应的离子方程式:_______ 。
(5)F中阳离子的检验步骤是_______ 。

请回答下列问题:
(1)D为
(2)I的沸点比PH3的沸点高,其原因是
(3)写出I与H在点燃条件下反应生成A和J的化学方程式:
(4)写出N与FeO反应的离子方程式:
(5)F中阳离子的检验步骤是
您最近一年使用:0次
解题方法
10 . 由4种短周期元素组成的化合物X是一种重要化工原料。某小组对X的组成与性质进行探究,记录如下:
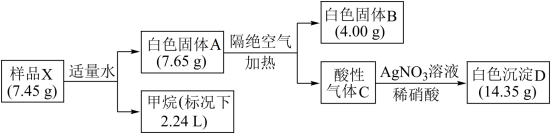
已知B是一种碱性氧化物,工业上常用于制作耐火材料。
请回答:
(1)X中所含的元素是___________ 。
(2)固体A隔绝空气加热反应的化学方程式是___________ 。
(3)X也可跟乙醇发生类似跟水的反应,反应的化学方程式是___________ 。
(4)制备X一般用相应金属单质与卤代经在合适的溶剂中反应,下列可以作为该反应的溶剂的是___________ 。
A.水 B.乙醇 C.乙醚 D.稀硫酸溶液
(5)上述实验过程中若X与水反应生成白色固体的质量小于7.65 g,分析可能的原因___________ 。

已知B是一种碱性氧化物,工业上常用于制作耐火材料。
请回答:
(1)X中所含的元素是
(2)固体A隔绝空气加热反应的化学方程式是
(3)X也可跟乙醇发生类似跟水的反应,反应的化学方程式是
(4)制备X一般用相应金属单质与卤代经在合适的溶剂中反应,下列可以作为该反应的溶剂的是
A.水 B.乙醇 C.乙醚 D.稀硫酸溶液
(5)上述实验过程中若X与水反应生成白色固体的质量小于7.65 g,分析可能的原因
您最近一年使用:0次



