名校
解题方法
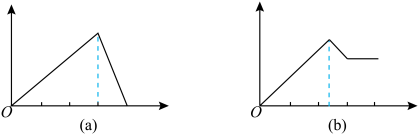
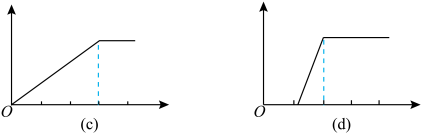
1 . 某学生做了如下4个实验:
①在铝盐溶液中逐滴加入稀氨水直至过量;
②在明矾溶液中加入氢氧化钡溶液直至过量;
③在含少量氢氧化钠的偏铝酸钠溶液中通入二氧化碳直至过量;
④在少量盐酸的氯化铝溶液中加入氢氧化钠至过量。
在4个图像,纵坐标为沉淀物质的量,横坐标为溶液中加入物质的物质的量,上述实验与图像对应关系正确的是( )
①在铝盐溶液中逐滴加入稀氨水直至过量;
②在明矾溶液中加入氢氧化钡溶液直至过量;
③在含少量氢氧化钠的偏铝酸钠溶液中通入二氧化碳直至过量;
④在少量盐酸的氯化铝溶液中加入氢氧化钠至过量。
在4个图像,纵坐标为沉淀物质的量,横坐标为溶液中加入物质的物质的量,上述实验与图像对应关系正确的是( )


| A.①-(d) | B.②-(b) | C.③-(c) | D.④-(a) |
您最近半年使用:0次
2020-01-11更新
|
312次组卷
|
4卷引用:云南省福贡县第一中学2019-2020学年高一上学期期末考试化学试题
云南省福贡县第一中学2019-2020学年高一上学期期末考试化学试题上海市金山中学2015-2016学年高二上学期期中考试化学试题(已下线)上海市控江中学2014-2015学年度高二上学期期中考试化学试题广西百色市2019-2020学年高二上学期期末考试化学试题
解题方法
2 . 钠、镁、铝及其化合物具有重要用途,如钠在700~800℃时可将Ti从其氟化物中置换出来,MgO、 熔点很高,可作耐高温材料。将
熔点很高,可作耐高温材料。将 直接加热得MgO。工业上可从铝土矿(主要成分是
直接加热得MgO。工业上可从铝土矿(主要成分是 )中提取Al,主要步骤是将铝土矿溶于NaOH溶液,过滤得
)中提取Al,主要步骤是将铝土矿溶于NaOH溶液,过滤得 溶液,通入足量的
溶液,通入足量的 得
得 沉淀,
沉淀, 热分解得
热分解得 ,电解熔融
,电解熔融 得金属Al。下列物质间的转化在指定条件下表示正确的是
得金属Al。下列物质间的转化在指定条件下表示正确的是
 熔点很高,可作耐高温材料。将
熔点很高,可作耐高温材料。将 直接加热得MgO。工业上可从铝土矿(主要成分是
直接加热得MgO。工业上可从铝土矿(主要成分是 )中提取Al,主要步骤是将铝土矿溶于NaOH溶液,过滤得
)中提取Al,主要步骤是将铝土矿溶于NaOH溶液,过滤得 溶液,通入足量的
溶液,通入足量的 得
得 沉淀,
沉淀, 热分解得
热分解得 ,电解熔融
,电解熔融 得金属Al。下列物质间的转化在指定条件下表示正确的是
得金属Al。下列物质间的转化在指定条件下表示正确的是A.用 制取金属Mg: 制取金属Mg: |
B.用 溶液制取金属Al: 溶液制取金属Al: 溶液 溶液 |
C.铝土矿溶于NaOH溶液的化学方程式: |
D. 溶液中通入足量 溶液中通入足量 的离子方程式: 的离子方程式: |
您最近半年使用:0次
名校
3 . 为探索工业废料的再利用,某化学兴趣小组用含有铝、铁和铜等合金废料制取纯碱、氧化铝和绿矾( ),其工艺流程如下图。
),其工艺流程如下图。
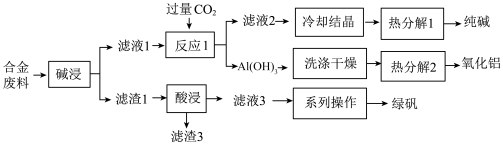
请回答下列问题:
(1)写出“碱浸”中发生反应的化学方程式 ___________ 。
(2)写出“热分解1”的化学方程式为___________ ,纯碱在生产生活中的一种用途是___________ 。
(3)根据流程中的信息,判断“反应1”中生成 的
的离子方程式 为___________ 。
(4)滤渣3的主要成分是___________ (填化学式)。
(5)该工艺流程中,可循环的物质是___________ (填化学式)。
(6)工业废水中含有重铬酸根离子( )有毒,必须处理达标后才能排放。工业上常用绿矾(
)有毒,必须处理达标后才能排放。工业上常用绿矾( )做处理剂,反应的离子方程式如下:
)做处理剂,反应的离子方程式如下: (未配平),在该反应方程式中氧化产物与还原产物的物质的量之比是
(未配平),在该反应方程式中氧化产物与还原产物的物质的量之比是___________ ,当转移a mol电子,则处理 的粒子数为
的粒子数为___________ 。
 ),其工艺流程如下图。
),其工艺流程如下图。
请回答下列问题:
(1)写出“碱浸”中发生反应的
(2)写出“热分解1”的化学方程式为
(3)根据流程中的信息,判断“反应1”中生成
 的
的(4)滤渣3的主要成分是
(5)该工艺流程中,可循环的物质是
(6)工业废水中含有重铬酸根离子(
 )有毒,必须处理达标后才能排放。工业上常用绿矾(
)有毒,必须处理达标后才能排放。工业上常用绿矾( )做处理剂,反应的离子方程式如下:
)做处理剂,反应的离子方程式如下: (未配平),在该反应方程式中氧化产物与还原产物的物质的量之比是
(未配平),在该反应方程式中氧化产物与还原产物的物质的量之比是 的粒子数为
的粒子数为
您最近半年使用:0次
解题方法
4 . 常见金属和非金属及其化合物在科学研究和工业生产中具有重要的用途。
(1)实验室制取氢氧化铝时,常用铝盐溶液和_______ (填“氨水”或“氢氧化钠溶液”)作为原料。
(2)铝制餐具不宜长时间存放酸性、碱性食物,但铝制容器可以盛装浓硝酸的原因是_______ 。
(3)实验室盛放氢氧化钠溶液的试剂瓶不能用玻璃塞,原因是_______ (用离子方程式表示)。
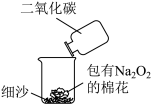
(4)如图实验可用来验证Na2O2与CO2的反应,实验过程中可观察到包有Na2O2的棉花燃烧。写出该反应的化学方程式_______ ,棉花燃烧说明该反应具有的特点是_______ 。
(5)铁红是一种红色颜料,其成分是_______ (填化学式)。将一定量的铁红溶于160 mL5 mol/L的盐酸中,再加入一定量铁粉恰好完全溶解,收集到气体2.24 L (标准状况下),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为_______ g。
(1)实验室制取氢氧化铝时,常用铝盐溶液和
(2)铝制餐具不宜长时间存放酸性、碱性食物,但铝制容器可以盛装浓硝酸的原因是
(3)实验室盛放氢氧化钠溶液的试剂瓶不能用玻璃塞,原因是
(4)如图实验可用来验证Na2O2与CO2的反应,实验过程中可观察到包有Na2O2的棉花燃烧。写出该反应的化学方程式

(5)铁红是一种红色颜料,其成分是
您最近半年使用:0次
解题方法
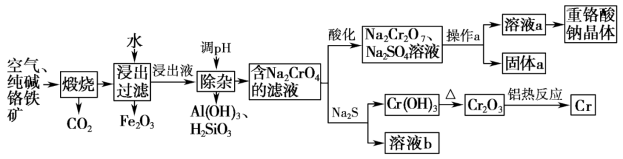
5 . 重铬酸钠是一种用途极广的氧化剂,以铬铁矿[主要成分Fe(CrO2)2,含有Al2O3、Fe2O3、SiO2等杂质]为主要原料生产重铬酸钠晶体,同时回收Cr的主要工艺流程如图:
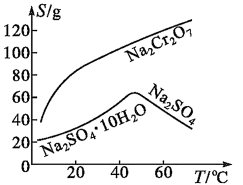
已知部分物质的溶解度曲线如图所示。
请回答下列问题:
(1)煅烧生成Na2CrO4的化学方程式为___________ 。
(2)将Fe2O3溶于稀硫酸后得到对应盐溶液,检验该溶液中金属阳离子的方法是___________ 。
(3)若通过加入稀硫酸调节溶液pH使铝元素转化为Al(OH)3,所发生反应的离子方程式为___________ 。
(4)Na2CrO4经酸化转化为Na2Cr2O7的原理为___________ (结合离子方程式用平衡移动原理解释)。
(5)操作a的实验步骤为___________ 。
(6)加入Na2S溶液反应后,硫元素全部以S2O 的形式存在,该反应中氧化剂和还原剂的物质的量之比为
的形式存在,该反应中氧化剂和还原剂的物质的量之比为___________ 。
(7)含铬废水会对环境造成污染,要经过化学处理才能排放。现将含CrO 的废水加入可溶性钡盐生成BaCrO4沉淀,加入可溶性钡盐后,废水中Ba2+的浓度应不小于
的废水加入可溶性钡盐生成BaCrO4沉淀,加入可溶性钡盐后,废水中Ba2+的浓度应不小于___________ mol•L−1,CrO 才能沉淀完全[当溶液中c(CrO
才能沉淀完全[当溶液中c(CrO )≤1×10-5 mol•L−1时,可视作该离子沉淀完全,已知Ksp(BaCrO4)=1.2×10−10]
)≤1×10-5 mol•L−1时,可视作该离子沉淀完全,已知Ksp(BaCrO4)=1.2×10−10]

已知部分物质的溶解度曲线如图所示。

请回答下列问题:
(1)煅烧生成Na2CrO4的化学方程式为
(2)将Fe2O3溶于稀硫酸后得到对应盐溶液,检验该溶液中金属阳离子的方法是
(3)若通过加入稀硫酸调节溶液pH使铝元素转化为Al(OH)3,所发生反应的离子方程式为
(4)Na2CrO4经酸化转化为Na2Cr2O7的原理为
(5)操作a的实验步骤为
(6)加入Na2S溶液反应后,硫元素全部以S2O
 的形式存在,该反应中氧化剂和还原剂的物质的量之比为
的形式存在,该反应中氧化剂和还原剂的物质的量之比为(7)含铬废水会对环境造成污染,要经过化学处理才能排放。现将含CrO
 的废水加入可溶性钡盐生成BaCrO4沉淀,加入可溶性钡盐后,废水中Ba2+的浓度应不小于
的废水加入可溶性钡盐生成BaCrO4沉淀,加入可溶性钡盐后,废水中Ba2+的浓度应不小于 才能沉淀完全[当溶液中c(CrO
才能沉淀完全[当溶液中c(CrO )≤1×10-5 mol•L−1时,可视作该离子沉淀完全,已知Ksp(BaCrO4)=1.2×10−10]
)≤1×10-5 mol•L−1时,可视作该离子沉淀完全,已知Ksp(BaCrO4)=1.2×10−10]
您最近半年使用:0次
名校
解题方法
6 . 铝是地壳中含量最多的金属元素,铝及其化合物在生产和生活中有广泛的用途,请回答下列问题:
(1)我们知道,铝是一种活泼的金属,在常温下就能与空气中的氧气反应,但在日常生活中铝制品却司空见惯,原因是_______ ,铝制器皿无论盛放酸性或碱性溶液,均会被腐蚀,请写出铝与烧碱溶液发生反应的离子方程式:_______ 。
(2)高纯氧化铝常被用作荧光粉基体材料,制备高纯氧化铝要用化学方法,其中一种方法是将 溶液中的铝沉淀出来,再将生成的沉淀经脱水制得氧化铝。为完全沉淀
溶液中的铝沉淀出来,再将生成的沉淀经脱水制得氧化铝。为完全沉淀 溶液中的铝元素,可采用的方法是
溶液中的铝元素,可采用的方法是_______ 。
(3)胃舒平的有效成分是氢氧化铝,是治疗胃酸(盐酸)过多的常用药物,胃舒平治疗胃酸过多的原理是_______ (用离子方程式表示),小苏打片也可以治疗胃酸过多,小苏打片发挥功效的离子方程式为_______ 。

(1)我们知道,铝是一种活泼的金属,在常温下就能与空气中的氧气反应,但在日常生活中铝制品却司空见惯,原因是
(2)高纯氧化铝常被用作荧光粉基体材料,制备高纯氧化铝要用化学方法,其中一种方法是将
 溶液中的铝沉淀出来,再将生成的沉淀经脱水制得氧化铝。为完全沉淀
溶液中的铝沉淀出来,再将生成的沉淀经脱水制得氧化铝。为完全沉淀 溶液中的铝元素,可采用的方法是
溶液中的铝元素,可采用的方法是(3)胃舒平的有效成分是氢氧化铝,是治疗胃酸(盐酸)过多的常用药物,胃舒平治疗胃酸过多的原理是

您最近半年使用:0次
2021-01-28更新
|
235次组卷
|
3卷引用:山西省2020-2021学年高一上学期期末考试化学试题
山西省2020-2021学年高一上学期期末考试化学试题山西省长治市第一中学2020-2021学年高一上学期期末测试试题(已下线)3.2.1 铁合金 铝和铝合金 新型合金-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)
名校
7 . 某课外小组研究铝土矿中Al2O3的含量。查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
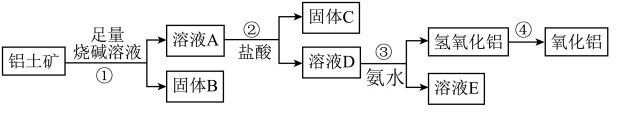
(1)固体B的主要用途为(只写一种即可)______________ ;
(2)第①步,向铝土矿中加入足量烧碱溶液,充分反应,发生反应的离子方程式是:___________ 、_______________ ;
(3)第③步中,生成氢氧化铝的离子方程式是___________________ 。若往A溶液中通入足量CO2,产生的沉淀为____________________ (填化学式);
(4)工业上制取AlCl3常用Al2O3与C、Cl2在高温条件下反应,已知每消耗0.5mol碳单质,转移1mol电子,则该反应的氧化产物为_____________ (填化学式)。

(1)固体B的主要用途为(只写一种即可)
(2)第①步,向铝土矿中加入足量烧碱溶液,充分反应,发生反应的离子方程式是:
(3)第③步中,生成氢氧化铝的离子方程式是
(4)工业上制取AlCl3常用Al2O3与C、Cl2在高温条件下反应,已知每消耗0.5mol碳单质,转移1mol电子,则该反应的氧化产物为
您最近半年使用:0次
8 . 已知A为淡黄色固体,T、R 为两种常见的用途广泛的金属单质,D具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体。
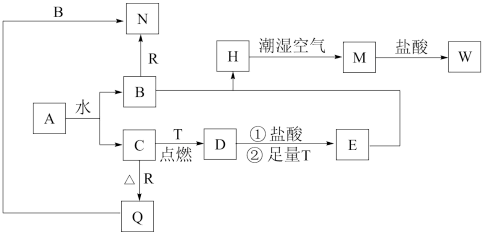
(1)写出下列物质的化学式:D:_______ R: _______
(2)按要求写出下列反应方程式
A与水反应的化学方程式_______
B与R反应的离子方程式_______
H转化为M的化学方程式_______
(3)向R的盐溶液中滴加弱碱,可制得一种具有吸附性的白色胶装物质,该反应的离子方程为_______

(1)写出下列物质的化学式:D:
(2)按要求写出下列反应方程式
A与水反应的化学方程式
B与R反应的离子方程式
H转化为M的化学方程式
(3)向R的盐溶液中滴加弱碱,可制得一种具有吸附性的白色胶装物质,该反应的离子方程为
您最近半年使用:0次
9 . I. A、 B、 C、 D、 E 均为中学化学常见的纯净物, B 为最常见液体,它们之间有如下的反应关系:
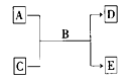
(1)若 A 为短周期的金属单质, D 为气态单质, 0.1 mol· L-1 C 溶液的 pH=13,则该反应的离子方程式为_______________________________________ 。
(2)若 A 的溶液能使淀粉溶液变蓝, C 为非金属氧化物, 且能使品红溶液褪色, 则该反应的化学方程式为_______________________________________ 。
(3)若 A、 C、 D、 E 均为化合物, E 为白色胶状沉淀,且 A、 C、 E 均含有同一种元素, 则该反应的离子方程式为_____________________________________ 。
(4)若单质 A 是良好的半导体材料,请写出工业上制取单质 A 粗品的化学方程式为________________________ 。
II.(5)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由 KClO3 在 H2SO4存在下与Na2SO3 反应制得。请写出该反应的离子方程式___________________________________________________________________ 。
(6)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为 2Na2CO3·3H2O2,它具有 Na2CO3和 H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了还原反应的是______ (填字母)。
A.MnO2 B.KMnO4溶液 C.稀盐酸 D. Na2SO3溶液

(1)若 A 为短周期的金属单质, D 为气态单质, 0.1 mol· L-1 C 溶液的 pH=13,则该反应的离子方程式为
(2)若 A 的溶液能使淀粉溶液变蓝, C 为非金属氧化物, 且能使品红溶液褪色, 则该反应的化学方程式为
(3)若 A、 C、 D、 E 均为化合物, E 为白色胶状沉淀,且 A、 C、 E 均含有同一种元素, 则该反应的离子方程式为
(4)若单质 A 是良好的半导体材料,请写出工业上制取单质 A 粗品的化学方程式为
II.(5)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由 KClO3 在 H2SO4存在下与Na2SO3 反应制得。请写出该反应的离子方程式
(6)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为 2Na2CO3·3H2O2,它具有 Na2CO3和 H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了还原反应的是
A.MnO2 B.KMnO4溶液 C.稀盐酸 D. Na2SO3溶液
您最近半年使用:0次
10 . 已知B、C为用途广泛的金属,H具有磁性氧化物,I是一种白色胶状沉淀,它们有如图所示的转化关系(部分产物未列出):

回答下列问题:
(1).E和G的化学式分别为_______ 。
(2).写出反应的化学方程式:①_______ 、③_______ 。
(3)写出反应的离子方程式②_______ 、④_______ 。

回答下列问题:
(1).E和G的化学式分别为
(2).写出反应的化学方程式:①
(3)写出反应的离子方程式②
您最近半年使用:0次



