名校
1 . 生活中处处有化学。下列生活中 及其化合物相关反应的离子方程式书写不正确的是
及其化合物相关反应的离子方程式书写不正确的是
 及其化合物相关反应的离子方程式书写不正确的是
及其化合物相关反应的离子方程式书写不正确的是A.胃舒平[主要成分为 ]治疗胃酸过多: ]治疗胃酸过多: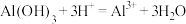 |
B.泡沫灭火器灭火原理: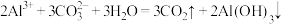 |
C.某主要成分为苛性钠、铝粉的管道疏通剂: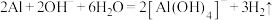 |
D.明矾净水原理: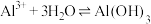 (胶体) (胶体)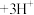 |
您最近一年使用:0次
2024-05-30更新
|
200次组卷
|
3卷引用:2024届浙江省高三下学期5月份大联考化学试题
名校
解题方法
2 . Li2CO3可用于制备锂电池的正极材料LiCoO2,以某锂云母矿石(主要成分为Li2O,还有Al2O3、Fe2O3、MnO、MgF2等杂质)制备Li2CO3。
已知:①有关沉淀数据如下表(“完全沉淀”时金属离子浓度≤1.0×10-5mol·L-1)。
②部分物质的溶解度曲线见下图。
(1)酸浸,向锂云母矿石中加入50%硫酸,加热至90℃,装置如图所示。烧杯中试剂的作用是___________ 。___________ 。分两次调节pH的主要原因是___________ 。
(3)沉锂,将已经除杂的溶液蒸发浓缩,向浓缩后的滤液中加入稍过量饱和Na2CO3溶液,加热煮沸,趁热过滤,将滤渣洗涤烘干,得Li2CO3固体。浓缩液中离子浓度过大将在产品中引入___________ 杂质(填化学式)。
(4)Li2CO3和Co3O4混合后,在空气中高温加热可以制备锂电池的正极材料LiCoO2,写出反应方程式:___________ 。
(5)CoC2O4·2H2O热分解可制备Co3O4。请补充完整由含c(Co2+)=0.1mol·L-1的浸出液(含有杂质Al3+、Fe3+、Fe2+)制备纯净的CoC2O4·2H2O实验方案:___________ ,干燥,得到CoC2O4·2H2O晶体。(须使用的试剂:NaClO3,NaOH,AgNO3溶液,(NH4)2C2O4,蒸馏水)
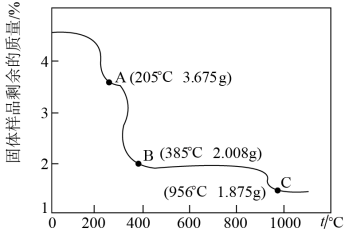
(6)为确定由CoC2O4·2H2O获得Co3O4的最佳煅烧温度,准确称取4.575g的CoC2O4·2H2O样品,在空气中加热,固体样品的剩余质量随温度的变化如图所示(已知385℃以上残留固体均为金属氧化物)经测定,205~385℃的煅烧过程中,产生的气体为CO2,计算AB段消耗O2在标准状况下的体积___________ 。(写出计算过程,结果保留2位有效数字)
已知:①有关沉淀数据如下表(“完全沉淀”时金属离子浓度≤1.0×10-5mol·L-1)。
| 沉淀 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Co(OH)2 | Mn(OH)2 | Mg(OH)2 |
| 恰好完全沉淀时pH | 5.2 | 8.8 | 3.2 | 9.4 | 9.8 | 11.1 |

(1)酸浸,向锂云母矿石中加入50%硫酸,加热至90℃,装置如图所示。烧杯中试剂的作用是

(3)沉锂,将已经除杂的溶液蒸发浓缩,向浓缩后的滤液中加入稍过量饱和Na2CO3溶液,加热煮沸,趁热过滤,将滤渣洗涤烘干,得Li2CO3固体。浓缩液中离子浓度过大将在产品中引入
(4)Li2CO3和Co3O4混合后,在空气中高温加热可以制备锂电池的正极材料LiCoO2,写出反应方程式:
(5)CoC2O4·2H2O热分解可制备Co3O4。请补充完整由含c(Co2+)=0.1mol·L-1的浸出液(含有杂质Al3+、Fe3+、Fe2+)制备纯净的CoC2O4·2H2O实验方案:
(6)为确定由CoC2O4·2H2O获得Co3O4的最佳煅烧温度,准确称取4.575g的CoC2O4·2H2O样品,在空气中加热,固体样品的剩余质量随温度的变化如图所示(已知385℃以上残留固体均为金属氧化物)经测定,205~385℃的煅烧过程中,产生的气体为CO2,计算AB段消耗O2在标准状况下的体积
您最近一年使用:0次
3 . “价类”二维图体现了元素的分类观、转化观,下图是 及其部分化合物的“价类”二维图。下列说法错误的是
及其部分化合物的“价类”二维图。下列说法错误的是
 及其部分化合物的“价类”二维图。下列说法错误的是
及其部分化合物的“价类”二维图。下列说法错误的是
| A.反应③④⑤⑥⑦均属于复分解反应 | B.反应①⑥所加试剂可能相同 |
C.物质的类别处“ ”代表偏铝酸盐 ”代表偏铝酸盐 | D.反应④⑤均可以通过加入盐酸实现转化 |
您最近一年使用:0次
解题方法
4 . 下列陈述Ⅰ和陈述Ⅱ均正确,且具有因果关系的是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | 用 | 氧化性: |
B |
|
|
C | 液氨可用作制冷剂 | 氨气极易溶于水 |
D | Na着火不能用水扑灭 | Na可与水反应产生 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
5 . 化学与生活密切相关。下列生活场景中有关化学知识的说法错误的是
选项 | 生活中的应用 | 化学知识 |
A |
|
|
B |
|
|
C |
|
|
D | 小苏打用制作食用碱 |
|
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
6 . 一定条件下,下列各项中的物质按如图所示的箭头不能实现一步转化的是
甲 丙
丙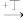 乙
乙
甲
 丙
丙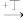 乙
乙| 选项 | 甲 | 乙 | 丙 | 丁 |
| A | NaOH溶液 | CO2 | Na2CO3溶液 | NaHSO4溶液 |
| B | SiO2 | C | CO2 | Fe |
| C | H2S | SO2 | S | O2 |
| D | 氨水 | AlCl3 | Al(OH)3 | 盐酸 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
7 . 聚合硫酸铝铁(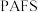 )是一种高效净水剂,广泛应用于饮用水处理、工业废水处理和污水处理。它能有效去除悬浊物、胶体颗粒、重金属、氨氨、有机物和色度等污染物,提高水质,保护环境。它的生产可以利用硫铁矿烧渣(主要成分为
)是一种高效净水剂,广泛应用于饮用水处理、工业废水处理和污水处理。它能有效去除悬浊物、胶体颗粒、重金属、氨氨、有机物和色度等污染物,提高水质,保护环境。它的生产可以利用硫铁矿烧渣(主要成分为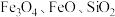 等)和粉煤灰(主要成分为
等)和粉煤灰(主要成分为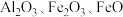 等),经过一系列的反应制得,具体流程如下:
等),经过一系列的反应制得,具体流程如下:___________ (填序号)。
A.降低温度 B.烧渣粉碎 C.适当提高硫酸浓度 D.加水稀释
“酸溶”后得到的溶液中,主要存在的金属阳离子有___________ (填化学符号)。
(2)检验“氧化”后溶液中金属阳离子的方法是___________ 。
(3)实验测得“氧化”过程中温度过高氧化效率会下降,原因可能是___________ 。
(4)“酸溶”过程中发生反应的离子方程式为___________ 。
(5)滤渣Ⅱ中可以循环利用的物质是___________ (填化学式)。
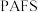 )是一种高效净水剂,广泛应用于饮用水处理、工业废水处理和污水处理。它能有效去除悬浊物、胶体颗粒、重金属、氨氨、有机物和色度等污染物,提高水质,保护环境。它的生产可以利用硫铁矿烧渣(主要成分为
)是一种高效净水剂,广泛应用于饮用水处理、工业废水处理和污水处理。它能有效去除悬浊物、胶体颗粒、重金属、氨氨、有机物和色度等污染物,提高水质,保护环境。它的生产可以利用硫铁矿烧渣(主要成分为 等)和粉煤灰(主要成分为
等)和粉煤灰(主要成分为 等),经过一系列的反应制得,具体流程如下:
等),经过一系列的反应制得,具体流程如下: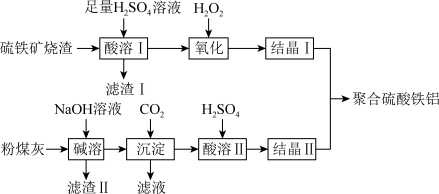
A.降低温度 B.烧渣粉碎 C.适当提高硫酸浓度 D.加水稀释
“酸溶”后得到的溶液中,主要存在的金属阳离子有
(2)检验“氧化”后溶液中金属阳离子的方法是
(3)实验测得“氧化”过程中温度过高氧化效率会下降,原因可能是
(4)“酸溶”过程中发生反应的离子方程式为
(5)滤渣Ⅱ中可以循环利用的物质是
您最近一年使用:0次
2024-04-24更新
|
195次组卷
|
2卷引用:2024届浙江省舟山中学高三下学期模拟预测化学试题
8 . 某兴趣小组以铝土矿(主要成分为 ,还含有少量
,还含有少量 和
和 )为主要原料制备絮凝剂聚合氯化铝
)为主要原料制备絮凝剂聚合氯化铝 和金属铝的流程如图所示。
和金属铝的流程如图所示。
 ,还含有少量
,还含有少量 和
和 )为主要原料制备絮凝剂聚合氯化铝
)为主要原料制备絮凝剂聚合氯化铝 和金属铝的流程如图所示。
和金属铝的流程如图所示。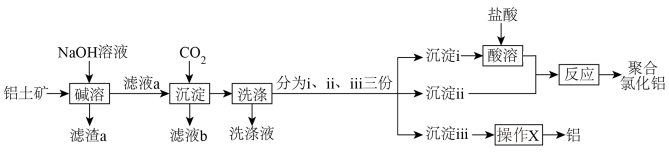
| A.“碱溶”时,所用NaOH溶液可更换为氨水 |
B.若滤液a浓度较大,“沉淀”时通入过量 有利于减少生成沉淀中的杂质 有利于减少生成沉淀中的杂质 |
| C.通过控制沉淀ⅰ、ⅱi的比例可改变聚合氯化铝的组成 |
| D.“操作X”可以是盐酸溶解、结晶、脱水、电解 |
您最近一年使用:0次
2023-12-16更新
|
492次组卷
|
3卷引用:2024届辽宁省大连市第二十四中学高三下学期第五次模拟化学试卷
名校
9 . 劳动开创未来。下列劳动项目与所述的化学知识没有关联的是
| 选项 | 劳动项目 | 化学知识 |
| A | 司机用铁质槽罐运输浓硫酸 | 铁遇冷的浓硫酸形成致密氧化膜 |
| B | 医生用氢氧化铝给病人治疗胃酸过多 | 氢氧化铝能与盐酸反应 |
| C | 居民用热的纯碱溶液清洗厨房里的油污 | 油脂在碱性条件下水解程度大 |
| D | 工人用水玻璃浸泡木材或纺织品防火 |  溶液显碱性 溶液显碱性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-07-15更新
|
391次组卷
|
3卷引用:陕西省渭南市富平县2022届高三下学期一模化学试题
解题方法
10 . 重铬酸钾( ),室温下为橘红色结晶性粉末,溶于水,不溶于乙醇。实验室以铬铁矿(主要成分为
),室温下为橘红色结晶性粉末,溶于水,不溶于乙醇。实验室以铬铁矿(主要成分为 ,还含有硅、铝等杂质)为原料,利用固体碱熔氧化法制备
,还含有硅、铝等杂质)为原料,利用固体碱熔氧化法制备 的步骤如下:
的步骤如下:
步骤I.熔融氧化
将6g铬铁矿与4g氯酸钾在研钵中混合均匀,取碳酸钠和氢氧化钠各4.5g于仪器A中混匀后,小火熔融,再将矿粉分批加入坩埚中并不断搅拌。用煤气灯强热,灼烧30~35min,稍冷几分钟,加水,过滤,得滤液i,滤渣中含红棕色固体。
步骤Ⅱ.中和除杂
将滤液i用稀硫酸调pH为7~8,加热煮沸3min后,趁热过滤,用少量蒸馏水洗涤残渣,得滤液ii。
步骤Ⅲ.结晶
将滤液ii转移至蒸发皿中,用6 硫酸调pH后加入1g氯化钾,在水浴上浓缩至表面有晶膜为止,冷却结晶,过滤得重铬酸钾晶体,烘干,称量。
硫酸调pH后加入1g氯化钾,在水浴上浓缩至表面有晶膜为止,冷却结晶,过滤得重铬酸钾晶体,烘干,称量。
步骤Ⅳ.纯度测定
利用库仑滴定法测定 固体样品的纯度:取mg样品,配成250mL溶液,取2mL溶液进行库仑法滴定,重复三次实验,测定平均电量(Q)为1.158C,已知计算
固体样品的纯度:取mg样品,配成250mL溶液,取2mL溶液进行库仑法滴定,重复三次实验,测定平均电量(Q)为1.158C,已知计算 的浓度公式为
的浓度公式为 (F为96500
(F为96500 ,N为1个
,N为1个 转化为
转化为 时转移的电子数,V为滴定样品溶液的体积)。已知:常见微粒在不同pH条件下的存在形式如下图所示。当离子浓度
时转移的电子数,V为滴定样品溶液的体积)。已知:常见微粒在不同pH条件下的存在形式如下图所示。当离子浓度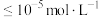 ,则认为该微粒已除尽。
,则认为该微粒已除尽。

回答下列问题:
(1)仪器A为_______(填标号)。
(2)若用 代替
代替 ,则理论上转化1mol
,则理论上转化1mol  所需
所需 的体积(标准状况,单位为L)是所消耗
的体积(标准状况,单位为L)是所消耗 物质的量的
物质的量的_______ 倍。
(3)步骤I中“分批加入”的目的是_______ 。
(4)若步骤Ⅱ中“调pH至3~4”的不良后果是_______ 。
(5)进一步提纯步骤Ⅲ所得晶体的方法是_______ 。
(6)探究pH对 溶液的氧化性强弱的影响。
溶液的氧化性强弱的影响。
(7) 与浓盐酸反应可制得
与浓盐酸反应可制得 ,已知部分卤素单质的键能如下表:
,已知部分卤素单质的键能如下表:
试解释键能 的原因
的原因_______ 。
(8) 固体样品的纯度为
固体样品的纯度为_______ (用含m的式子表示)。
 ),室温下为橘红色结晶性粉末,溶于水,不溶于乙醇。实验室以铬铁矿(主要成分为
),室温下为橘红色结晶性粉末,溶于水,不溶于乙醇。实验室以铬铁矿(主要成分为 ,还含有硅、铝等杂质)为原料,利用固体碱熔氧化法制备
,还含有硅、铝等杂质)为原料,利用固体碱熔氧化法制备 的步骤如下:
的步骤如下:步骤I.熔融氧化
将6g铬铁矿与4g氯酸钾在研钵中混合均匀,取碳酸钠和氢氧化钠各4.5g于仪器A中混匀后,小火熔融,再将矿粉分批加入坩埚中并不断搅拌。用煤气灯强热,灼烧30~35min,稍冷几分钟,加水,过滤,得滤液i,滤渣中含红棕色固体。
步骤Ⅱ.中和除杂
将滤液i用稀硫酸调pH为7~8,加热煮沸3min后,趁热过滤,用少量蒸馏水洗涤残渣,得滤液ii。
步骤Ⅲ.结晶
将滤液ii转移至蒸发皿中,用6
 硫酸调pH后加入1g氯化钾,在水浴上浓缩至表面有晶膜为止,冷却结晶,过滤得重铬酸钾晶体,烘干,称量。
硫酸调pH后加入1g氯化钾,在水浴上浓缩至表面有晶膜为止,冷却结晶,过滤得重铬酸钾晶体,烘干,称量。步骤Ⅳ.纯度测定
利用库仑滴定法测定
 固体样品的纯度:取mg样品,配成250mL溶液,取2mL溶液进行库仑法滴定,重复三次实验,测定平均电量(Q)为1.158C,已知计算
固体样品的纯度:取mg样品,配成250mL溶液,取2mL溶液进行库仑法滴定,重复三次实验,测定平均电量(Q)为1.158C,已知计算 的浓度公式为
的浓度公式为 (F为96500
(F为96500 ,N为1个
,N为1个 转化为
转化为 时转移的电子数,V为滴定样品溶液的体积)。已知:常见微粒在不同pH条件下的存在形式如下图所示。当离子浓度
时转移的电子数,V为滴定样品溶液的体积)。已知:常见微粒在不同pH条件下的存在形式如下图所示。当离子浓度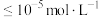 ,则认为该微粒已除尽。
,则认为该微粒已除尽。
回答下列问题:
(1)仪器A为_______(填标号)。
| A.普通坩埚 | B. 坩埚 坩埚 | C.氮化硅坩埚 | D.石英坩埚 |
 代替
代替 ,则理论上转化1mol
,则理论上转化1mol  所需
所需 的体积(标准状况,单位为L)是所消耗
的体积(标准状况,单位为L)是所消耗 物质的量的
物质的量的(3)步骤I中“分批加入”的目的是
(4)若步骤Ⅱ中“调pH至3~4”的不良后果是
(5)进一步提纯步骤Ⅲ所得晶体的方法是
(6)探究pH对
 溶液的氧化性强弱的影响。
溶液的氧化性强弱的影响。| 实验操作 | 实验现象 | 实验结论 |
向酸化的 溶液中加入一定量甲醇 溶液中加入一定量甲醇 | 溶液形成蓝紫色溶液,并产生无色无味的气体 | |
向碱化的 溶液中加入相同量甲醇 溶液中加入相同量甲醇 | 酸性条件下 溶液的氧化性更强 溶液的氧化性更强 |
 与浓盐酸反应可制得
与浓盐酸反应可制得 ,已知部分卤素单质的键能如下表:
,已知部分卤素单质的键能如下表:| 化学键 | F-F | C1-Cl | Br-Br |
键能/( ) ) | 157 | 242.7 | 193.7 |
 的原因
的原因(8)
 固体样品的纯度为
固体样品的纯度为
您最近一年使用:0次

 溶液刻蚀铜质电路板
溶液刻蚀铜质电路板
 可用于治疗胃酸过多
可用于治疗胃酸过多 用于自来水的杀菌
用于自来水的杀菌 用于制抗酸药
用于制抗酸药 可作食品添加剂
可作食品添加剂 水溶液显碱性
水溶液显碱性

