1 . 将一定量的Fe、 、CuO的混合物放入100mL
、CuO的混合物放入100mL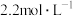 的
的 溶液中,充分反应后生成896ml。气体(标准状况下),得到不溶固体1.28g,过滤后,滤液中的金属离子只有
溶液中,充分反应后生成896ml。气体(标准状况下),得到不溶固体1.28g,过滤后,滤液中的金属离子只有 (假设滤液体积仍为100mL)。向滤液中滴加
(假设滤液体积仍为100mL)。向滤液中滴加 NaOH溶液,直至40mL时开始出现沉淀。下列说法错误的是
NaOH溶液,直至40mL时开始出现沉淀。下列说法错误的是
 、CuO的混合物放入100mL
、CuO的混合物放入100mL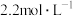 的
的 溶液中,充分反应后生成896ml。气体(标准状况下),得到不溶固体1.28g,过滤后,滤液中的金属离子只有
溶液中,充分反应后生成896ml。气体(标准状况下),得到不溶固体1.28g,过滤后,滤液中的金属离子只有 (假设滤液体积仍为100mL)。向滤液中滴加
(假设滤液体积仍为100mL)。向滤液中滴加 NaOH溶液,直至40mL时开始出现沉淀。下列说法错误的是
NaOH溶液,直至40mL时开始出现沉淀。下列说法错误的是| A.CuO的质量为1.6g |
B.未滴加NaOH溶液前滤液中 的物质的量浓度为 的物质的量浓度为 |
C.溶液中 和 和 消耗铁的物质的量之比为2:1 消耗铁的物质的量之比为2:1 |
| D.Fe在溶液中共参与了三个反应 |
您最近一年使用:0次
11-12高三上·山西·单元测试
名校
解题方法
2 . 向含有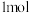
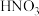 和
和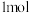
 的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有
的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有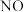 )。下列有关判断不正确的是
)。下列有关判断不正确的是
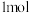
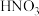 和
和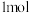
 的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有
的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有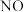 )。下列有关判断不正确的是
)。下列有关判断不正确的是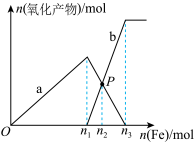
A.a表示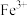 的关系曲线 的关系曲线 |
B. =0.75 =0.75 |
C.P点时,n(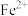 )=0.5625mol )=0.5625mol |
| D.向P点溶液中加入铜粉,最多可溶解14.4g |
您最近一年使用:0次
2024-01-10更新
|
789次组卷
|
16卷引用:2011-2012学年山西省高三上学期第二次阶段性测试化学试卷
(已下线)2011-2012学年山西省高三上学期第二次阶段性测试化学试卷2016届浙江省杭州高级中学高三上学期月考(三)化学试卷【全国百强校】安徽省合肥市第六中学2018-2019学年高一下学期开学考试化学试题(已下线)2019年8月11日《每日一题》2020年高考一轮复习—— 每周一测(已下线)专题3.3 铁及其重要化合物(练)——2020年高考化学一轮复习讲练测人教版2019必修第二册 第五章 本章复习提升湖南省长沙市第一中学2019-2020学年高一上学期第二次阶段性检测(月考)化学试题辽宁省沈阳市第四十中学2021-2022年高一下学期4月份线上教学效果检测化学试题河南省商丘市第一高级中学2021-2022学年高一下学期期中考试化学试题陕西省西安中学 2023 届高三上学期第二次质量检测化学试题西安市第八十三中学2022-2023学年高一下学期第一次月考化学试题辽宁省重点高中沈阳市郊联体2023-2024学年高一上学期期末考试化学试题新疆乌鲁木齐市新疆生产建设兵团第二中学2023-2024学年高一上学期期末考试化学试卷 (已下线)热点02 氮及其化合物浙江省杭州市源清中学2023-2024学年高一上学期期末考试化学试题黑龙江省双鸭山市第一中学2023-2024学年高一下学期4月月考化学试题
名校
3 . 向含有1mol  和1mol
和1mol  的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断正确的是
的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断正确的是
 和1mol
和1mol  的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断正确的是
的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断正确的是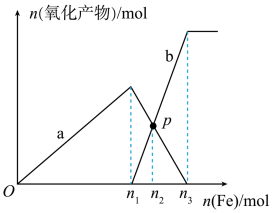
A.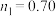 | B.a表示 的关系曲线 的关系曲线 |
C.P点时,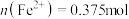 | D.向P点溶液中加入铜粉,最多可溶解14.4g |
您最近一年使用:0次
2023-03-28更新
|
1428次组卷
|
8卷引用:山西省晋城一中2022-2023学年高一下学期第三次调研考试化学试题
山西省晋城一中2022-2023学年高一下学期第三次调研考试化学试题河南省平顶山第一中学2022-2023学年高一下学期校内质量检测(一)化学试题(已下线)专题01 金属及其化合物(知识串讲+专题过关)-2022-2023学年高一化学下学期期中期末考点大串讲(沪科版2020必修第二册)山东省淄博市部分学校联考2022-2023学年高一下学期4月期中考试化学试题辽宁省大连市第二十四中学2022-2023学年高一下学期期中考试化学试题四川省德阳中学2022-2023学年高一下学期6月月考化学试题(已下线)期中测试卷二【测试范围:第五、六章】-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)辽宁省辽宁师范大学附属中学2023-2024学年高一下学期4月月考化学试题
4 . W、X、Y、Z、M五种物质的相互转化关系如图所示(反应条件略去,箭头表示一步转化)。下列说法错误的是
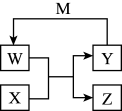

| A.若W为Na2O2,则M可能为Na |
| B.若X为H2O,则Y可能为H2 |
| C.若X为CuO,则M可能为Na |
| D.若X为Fe,则Z可能为Fe2O3 |
您最近一年使用:0次
名校
解题方法
5 . 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中的Fe2+的浓度和加入铁粉的物质的量之间的关系如图所示。则原溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为
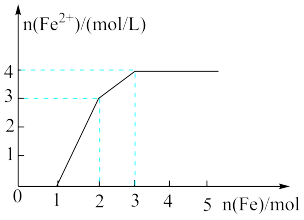

| A.1∶1∶4 | B.1∶4∶1 | C.4∶1∶1 | D.1∶1∶1 |
您最近一年使用:0次
2021-03-27更新
|
1582次组卷
|
47卷引用:山西省大同市第一中学2017-2018学年高一上学期期末考试化学试题
山西省大同市第一中学2017-2018学年高一上学期期末考试化学试题山西省朔州市应县第一中学2019届高三9月月考化学试题山西省朔州市怀仁第一中学2018-2019学年高一上学期期末考试化学试题(已下线)2011届四川省资阳市资阳中学高三第一次高考模拟(理综)化学部分(已下线)2011届四川省南充市高三第二次诊断性考试(理综)化学部分(已下线)2010—2011学年浙江省余姚中学高一下学期第一次质量检测化学试卷(已下线)2011届河北省邯郸一中高三高考压轴试题(理综)化学部分(已下线)2012届河北省三河一中高三上学期第二次月考化学试卷(已下线)2012届浙江省绍兴市第一中学高三回头考试化学试卷(已下线)2011-2012学年浙江省杭州地区七校高一下学期期中联考化学试卷(已下线)2013届新疆乌鲁木齐八中高三第一次月考化学试卷(已下线)2013届浙江省温州市龙湾中学高三第一次月考化学试卷(已下线)2013届辽宁省东北育才学校高三第一次模拟考试化学试卷(已下线)2013届广东省汕头市东山中学高三上学期第三次调研考试化学试卷(已下线)2014届河南省许昌平顶山新乡三市高三第一次调研理综化学试卷(已下线)2013-2014河北省石家庄一中上学期开学考试高二化学试卷(已下线)2013届辽宁省东北育才学校高三第一次模拟考试化学试卷 (已下线)2015届宁夏银川市唐徕回民中学高三上学期期中考试化学试卷2015届辽宁省实验中学分校高三上学期期中化学试卷2016届河北省枣强中学高三上学期期中测试化学试卷2016届陕西省西藏民族学院附属中学高三上期末化学试卷2015-2016学年江西省宜春市高安二中高一上学期期末化学试卷2016-2017学年吉林长春十一高中等两校高一上期末化学卷汕头市金山中学2016~2017学年度第二学期期中考试高一化学试题内蒙古集宁一中2017-2018学年高一下学期第二次月考理科综合化学试题(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第5讲 数形结合思想的应用【押题专练】【全国百强校】黑龙江省哈尔滨市第六中学2019届高三上学期10月月考化学试题黑龙江省宾县一中2020届高三上学期第一次月考化学试题湖北省鹤峰县第一高级中学2019届高三9月检测题化学试题云南省曲靖市第一中学2019—2020学年高一上学期学科竞赛化学试题2020届高三化学无机化学二轮专题复习——铁及其化合物的相关计算2【精编24题】安徽省淮南市寿县一中2020 届高三素质测试化学试题(已下线)专题3.3 铁及其重要化合物(练)——2020年高考化学一轮复习讲练测安徽省安庆市太湖县太湖中学2019-2020学年高一上学期期末考试化学试题(已下线)第11讲 铁及其重要化合物(精练)——2021年高考化学一轮复习讲练测安徽省阜阳市阜南县实验中学2019-2020学年高一下学期6月月考化学试题河南省信阳市商城县上石桥高中2021届高三上学期第一次月考化学试题吉林省洮南市第一中学2021届高三上学期期中考试化学试题新疆和田地区第二中学2020届高三上学期12月月考化学试题(重点普通班)(已下线)【浙江新东方】高中化学20210304-014湖北省宜昌市夷陵中学2020-2021学年高一下学期3月份质量检测化学试题黑龙江省哈尔滨市第六中学2020-2021学年高一4月月考化学试题重庆铁路中学2020-2021学年高一下学期4月月考化学试题(已下线)专题三 能力提升检测卷 (测) — 2022年高考化学一轮复习讲练测(新教材新高考)黑龙江省哈尔滨市宾县第一中学2021-2022学年高三上学期9月月考化学试题辽宁省沈阳市三十一中学2021-2022学年高一下学期4月月考化学试题广东省揭阳市普宁市勤建学校2022-2023学年高一下学期学科竞赛化学试题
名校
6 . 向含有xmolHNO3和ymolH2SO4的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断不正确的是
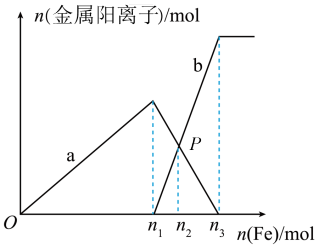
A.当x=y时,反应后溶液中一定有 |
| B.加入n3mol铁粉后b线保持不变说明n1mol铁粉后溶液中一定无H+ |
| C.由图可知,y≤1.5x |
| D.当x=1,y=1时最多溶解铁粉质量为56.0g |
您最近一年使用:0次
2021-03-14更新
|
688次组卷
|
6卷引用:山西省实验中学2020-2021学年高一下学期第一次月考化学试题
7 . 部分氧化的 Fe-Cu 合金样品(氧化物为 Fe2O3、CuO)共5.76 g,经如下处理:

下列说法正确的是

下列说法正确的是
| A.滤液A中的阳离子为Fe2+、Fe3+、H+ | B.溶解样品消耗的硫酸共为 0.04 mol |
| C.样品中氧元素的质量为 0.48 g | D.V=336 mL |
您最近一年使用:0次
2018-10-30更新
|
946次组卷
|
8卷引用:山西省太原市第五中学2021-2022学年上学期高三第四次模块诊断化学试题
山西省太原市第五中学2021-2022学年上学期高三第四次模块诊断化学试题天津市武清区杨村第三中学2019届高三上学期第一次月考化学试题(已下线)【浙江新东方】双师107黑龙江省大庆铁人中学2021-2022学年高三上学期第二次月考化学试题(已下线)一轮巩固卷5-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)湖南省邵阳市新邵县2022-2023学年高一上学期期末质量检测化学试题福建省泉州晋江二中、鹏峰中学、广海中学、泉港五中2022-2023学年高一下学期期中考试化学试题(已下线)考点08 物质的量在化学方程式计算中的应用(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
8 . 下列实验操作对应的实验现象及解释或结论不正确的是
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 将相同大小的金属钠分别投入乙醇和水中 | 乙醇与钠反应缓慢,水与钠反应剧烈 | 乙醇羟基中的氢原子不如水分子中的氢原子活泼 |
| B | 向 2 mL 1 mol/L NaOH 溶液中先加入3滴 1 mol/L MgCl2,再加入3滴 1 mol/L FeCl3 溶液 | 先生成白色沉淀,后生成红褐色沉淀 | 证明 Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| C | 将水蒸气通过灼热的铁粉 | 生成的气体可以点燃 | 铁与水蒸气在高温下发生反应 |
| D | 将刚摘下的红色花朵放入盛满干燥氯气的集气瓶中,盖上玻璃片 | 花朵褪色 | 因为次氯酸具有漂白作用 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-03-26更新
|
878次组卷
|
5卷引用:山西省太原市2018届高三上学期期末考试化学试题
名校
9 . 一份质量为4g的合金,与足量的盐酸完全反应生成0.2gH2,则该合金可能是
| A.Fe-Zn合金 | B.Fe-Cu合金 | C.Fe-Mg 合金 | D.Mg-Al合金 |
您最近一年使用:0次
2017-12-25更新
|
397次组卷
|
2卷引用:山西省祁县中学2017-2018学年高一12月月考化学试题
名校
解题方法
10 . 某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈;二氧化硅等。水垢会形成安全隐患,需及时清洗除去。清洗流程如下:
I.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤溶液,清水冲洗锅炉,加入稀盐酸,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
已知:20℃时溶解度/g
(1)用NaOH溶解二氧化硅的化学方程式是_________
(2)在步骤Ⅱ中:①加入盐酸可除去CaCO3、Fe2O3和Mg(OH)2.写出盐酸与Mg(OH)2反应的离子方程式:___________ 。
②清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因_________
(3)步骤Ⅲ中,加入Na2SO3的目的是将步骤Ⅱ中生成的Fe3+还原成Fe2+,防止Fe3+腐蚀锅炉。写出Na2SO3和Fe3+反应的高子方程式___________ 。
(4)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe3O4保护膜。
①如果转移的电子有2.4mol,则有________ g铁被钝化。
②钝化效果的检测一般可用滤纸浸渍配好的检测液后贴附于待测样品表面或直接将溶液涂、滴于待测表面。下面检测钝化效果的方法合理的是__________ 。
a.在炉面上滴加浓H2SO4,观察溶液出现棕黄色的时间
b.在炉面上滴加酸性CuSO4溶液,观察蓝色消失的时间
c.在炉面上滴加浓HNO3观察出现红棕色气体的时间
d.在炉面上滴加酸性K3[Fe(CN)6]溶液,观察出现蓝色沉淀的时间
I.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤溶液,清水冲洗锅炉,加入稀盐酸,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
已知:20℃时溶解度/g
| CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
| l.4×10-3 | 2.55×10-2 | 9×10-4 | 1.1×10-2 |
(2)在步骤Ⅱ中:①加入盐酸可除去CaCO3、Fe2O3和Mg(OH)2.写出盐酸与Mg(OH)2反应的离子方程式:
②清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因
(3)步骤Ⅲ中,加入Na2SO3的目的是将步骤Ⅱ中生成的Fe3+还原成Fe2+,防止Fe3+腐蚀锅炉。写出Na2SO3和Fe3+反应的高子方程式
(4)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe3O4保护膜。
①如果转移的电子有2.4mol,则有
②钝化效果的检测一般可用滤纸浸渍配好的检测液后贴附于待测样品表面或直接将溶液涂、滴于待测表面。下面检测钝化效果的方法合理的是
a.在炉面上滴加浓H2SO4,观察溶液出现棕黄色的时间
b.在炉面上滴加酸性CuSO4溶液,观察蓝色消失的时间
c.在炉面上滴加浓HNO3观察出现红棕色气体的时间
d.在炉面上滴加酸性K3[Fe(CN)6]溶液,观察出现蓝色沉淀的时间
您最近一年使用:0次



