1 . 铁是人体必需的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物,“速力菲”(主要成分为的琥珀酸亚铁,即丁二酸亚铁)是市场上一种常用的补铁药物,它难溶于水,但在人体胃酸的作用下可以释放出Fe2+,从而被人体吸收。
(1)某同学为了检验其中的Fe2+,将药物研磨、水溶后过滤。
①如图是某学生的过滤操作示意图,其操作不规范的是___ (填标号)
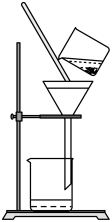
a.玻璃棒用作引流
b.漏斗末端颈尖未紧靠烧杯壁
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中搅动以加快过滤速度
②取少量所得滤液,分别加入 K3Fe(CN)6溶液(一种检验Fe2+的试剂)和KSCN溶液(一种检验Fe3+的试剂),均未出现明显现象。其主要原因是___ 。
(2)取酸性环境下“速力菲”溶解过滤后的滤液敞口放置在空气中一段时间,然后滴入KSCN溶液,溶液立即呈现血红色说明有Fe3+生成,说明Fe2+___ 。
(3)医生通常会建议:与维生素C同时服用,能增强“速力菲”的补铁效果。此举是利用了维生素C的___ 。(填“氧化性”、“还原性”或“碱性”)
(1)某同学为了检验其中的Fe2+,将药物研磨、水溶后过滤。
①如图是某学生的过滤操作示意图,其操作不规范的是

a.玻璃棒用作引流
b.漏斗末端颈尖未紧靠烧杯壁
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中搅动以加快过滤速度
②取少量所得滤液,分别加入 K3Fe(CN)6溶液(一种检验Fe2+的试剂)和KSCN溶液(一种检验Fe3+的试剂),均未出现明显现象。其主要原因是
(2)取酸性环境下“速力菲”溶解过滤后的滤液敞口放置在空气中一段时间,然后滴入KSCN溶液,溶液立即呈现血红色说明有Fe3+生成,说明Fe2+
(3)医生通常会建议:与维生素C同时服用,能增强“速力菲”的补铁效果。此举是利用了维生素C的
您最近一年使用:0次
2 . 某兴趣小组利用下列试剂:铁粉、锌粉、0.1 mol·L-1 FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题。
(1)用所给试剂写出体现Fe2+具有还原性的反应的离子反应方程式:___________ 。
(2)设计实验方案,完成下列表格。
(3)该兴趣小组未说明“Fe2+具有氧化性”,提出了向FeCl2溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为___________ 。
(4)某反应中反应物与生成物有Fe2+ 、Fe3+、 、H2O、H+和一种未知离子X。
、H2O、H+和一种未知离子X。
①已知氧化性: >Fe3+ ,则X离子是
>Fe3+ ,则X离子是___________ 。
②该反应的离子方程式是___________ 。
(1)用所给试剂写出体现Fe2+具有还原性的反应的离子反应方程式:
(2)设计实验方案,完成下列表格。
| 探究内容 | 实验方案 | 实验现象 |
| 探究Fe3+的化学性质 | 取少量0.1 mol ·L-1 FeCl3溶液,往溶液中加入 足量铁粉,再加入少量KSCN溶液 | 加入铁粉后 ,溶液颜色为 加入KSCN溶液后,溶液颜色 |
| 结论:Fe3+具有 | ||
(4)某反应中反应物与生成物有Fe2+ 、Fe3+、
 、H2O、H+和一种未知离子X。
、H2O、H+和一种未知离子X。①已知氧化性:
 >Fe3+ ,则X离子是
>Fe3+ ,则X离子是②该反应的离子方程式是
您最近一年使用:0次
解题方法
3 . 下列各实验操作、现象和结论描述有错误的是
| 选项 | 实验操作和现象 | 结论 |
| A | 常温下,测定同浓度NaA和NaB溶液的pH:NaA小于NaB | 相同条件下,在水中HA电离程度大于HB |
| B | 将稀硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 氧化性:H2O2比Fe3+强 |
| C | 将SO2通入酸性高锰酸钾溶液中,紫色褪去 | 验证SO2具有还原性 |
| D | 向X溶液中滴入浓NaOH溶液加热,将湿润的红色石蕊试纸置于试管口,试纸变蓝 | X溶液中一定有NH |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
4 . 某小组同学探究久置 固体变质的情况,并测定其中铁元素的质量分数。将
固体变质的情况,并测定其中铁元素的质量分数。将 固体用蒸馏水溶解,配成
固体用蒸馏水溶解,配成 待测液,进行实验。
待测液,进行实验。
资料: 中S元素的化合价为-2价:酸性条件下,
中S元素的化合价为-2价:酸性条件下, 的还原产物为
的还原产物为 。
。
(1)实验一:
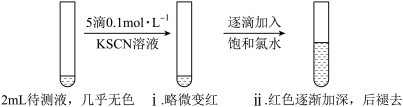
①i中溶液略微变红,说明待测液中存在___________ 。
②ii中溶液颜色逐渐加深的原因是___________ 。
③由实验一推测 固体变质的情况是
固体变质的情况是___________ (填字母序号)。
a.未变质 b.部分变质 c.完全变质
(2)实验二:探究ii中“红色褪去”的原因。
针对“红色褪去”的现象,小组同学猜想可能的原因是___________ ,并通过如下实验证实了猜想。将褪色后的溶液分两份分别进行实验,请补全①中的操作和②中的现象。
(3)实验三:将 固体用蒸馏水溶解,配成
固体用蒸馏水溶解,配成 待测液,进行实验,测定久置
待测液,进行实验,测定久置 固体中铁元素的含量。设计实验方案如图:
固体中铁元素的含量。设计实验方案如图:
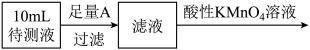
①可选作A的物质是___________ (填字母序号)。
a. b.
b. c.
c. d.
d.
②若消耗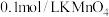 溶液
溶液 ,则久置
,则久置 固体中铁元素的质量分数是
固体中铁元素的质量分数是___________ 。
 固体变质的情况,并测定其中铁元素的质量分数。将
固体变质的情况,并测定其中铁元素的质量分数。将 固体用蒸馏水溶解,配成
固体用蒸馏水溶解,配成 待测液,进行实验。
待测液,进行实验。资料:
 中S元素的化合价为-2价:酸性条件下,
中S元素的化合价为-2价:酸性条件下, 的还原产物为
的还原产物为 。
。(1)实验一:

①i中溶液略微变红,说明待测液中存在
②ii中溶液颜色逐渐加深的原因是
③由实验一推测
 固体变质的情况是
固体变质的情况是a.未变质 b.部分变质 c.完全变质
(2)实验二:探究ii中“红色褪去”的原因。
针对“红色褪去”的现象,小组同学猜想可能的原因是
| 序号 | 操作 | 现象 |
| ① | 产生红褐色沉淀 | |
| ② | 滴加 溶液 溶液 |
(3)实验三:将
 固体用蒸馏水溶解,配成
固体用蒸馏水溶解,配成 待测液,进行实验,测定久置
待测液,进行实验,测定久置 固体中铁元素的含量。设计实验方案如图:
固体中铁元素的含量。设计实验方案如图:
①可选作A的物质是
a.
 b.
b. c.
c. d.
d.
②若消耗
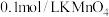 溶液
溶液 ,则久置
,则久置 固体中铁元素的质量分数是
固体中铁元素的质量分数是
您最近一年使用:0次
5 . 下列说法错误的是
A. 既有氧化性也有还原性 既有氧化性也有还原性 |
| B.化合反应一定是氧化还原反应 |
C.保存 溶液时加入Fe粉防止 溶液时加入Fe粉防止 被氧化 被氧化 |
D.除去 溶液中的 溶液中的 ,可加入氯水 ,可加入氯水 |
您最近一年使用:0次
解题方法
6 . 现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如图反应(图中某些反应的产物及条件没有全部标出)。

(1)反应①的化学方程式为___________ ,该反应中的氧化剂为___________ (填化学式),氧化产物和还原产物的物质的量之比为___________ 。
(2)写出反应④的离子方程式___________ ,该反应证明E中的阳离子有___________ (填“氧化性”或“还原性”)。
(3)F溶液常用于腐蚀覆铜印刷电路板,请写出相关的离子方程式___________ 。腐蚀结束后,通过以下两步可分离出铜,并实现F溶液再生:
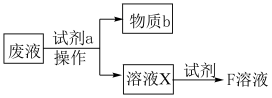
“试剂a”和“操作”分别为___________ 、___________ 。

(1)反应①的化学方程式为
(2)写出反应④的离子方程式
(3)F溶液常用于腐蚀覆铜印刷电路板,请写出相关的离子方程式

“试剂a”和“操作”分别为
您最近一年使用:0次
名校
7 . 有关金属及其化合物,下列有关说法错误的是
| A.当火灾现场存放有大量金属钠时不能用水来灭火 |
| B.FeO不稳定,加热条件下易被氧化为Fe2O3 |
| C.铝制餐具不能长时间存放或蒸煮酸性或碱性食物 |
| D.某溶液中滴加KSCN不变红,通入少量氯气后变红,则证明原溶液一定有Fe2+ |
您最近一年使用:0次
2023-04-18更新
|
412次组卷
|
3卷引用:广西柳州地区民族高级中学2022-2023学年高一下学期期中考试化学试题
8 . 草酸亚铁晶体(FeC2O4·xH2O)为淡黄色粉末,不溶于水,可作照相显影剂和用于制药工业。某化学兴趣小组对其性质进行如下探究,回答下列问题:
I.定性探究
选用下列试剂设计实验方案,完成下表内容。
试剂:酸性KMnO4溶液、K3[Fe(CN)6]溶液
Ⅱ.定量探究:滴定实验测x的值
(5)滴定前,下列操作的正确顺序是___________ (填字母序号)。
a.用0.1000mol/L的酸性KMnO4溶液润洗
b.查漏、清洗
c.排尽滴定管尖嘴的气泡并调整液面
d.盛装0.1000mol/L的酸性KMnO4溶液
e.初始读数、记录为0.50mL
(6)称取ng样品,加入适量稀硫酸溶解,用步骤(5)准备的标准KMnO4溶液直接滴定,如何判断滴定终点?_______________ 。
(7)终点读数为20.50mL。结合上述实验数据求得x=___________ (用含n的代数式表示,FeC2O4的相对分子质量为144)。
I.定性探究
选用下列试剂设计实验方案,完成下表内容。
试剂:酸性KMnO4溶液、K3[Fe(CN)6]溶液
| 操作 | 现象 | 结论与解释 |
| (1)取少量草酸亚铁晶体于试管中,加入2mL水,振荡后静置 | 有淡黄色沉淀,上层清液无色 | 草酸亚铁不溶于水 |
| (2)继续加入2mL稀硫酸,振荡 | 草酸亚铁溶于硫酸,硫酸酸性强于草酸 | |
| (3)向步骤(2)所得溶液中滴加几滴K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | |
| (4)① | ② | H2C2O4或C2O42-具有还原性 |
(5)滴定前,下列操作的正确顺序是
a.用0.1000mol/L的酸性KMnO4溶液润洗
b.查漏、清洗
c.排尽滴定管尖嘴的气泡并调整液面
d.盛装0.1000mol/L的酸性KMnO4溶液
e.初始读数、记录为0.50mL
(6)称取ng样品,加入适量稀硫酸溶解,用步骤(5)准备的标准KMnO4溶液直接滴定,如何判断滴定终点?
(7)终点读数为20.50mL。结合上述实验数据求得x=
您最近一年使用:0次
名校
解题方法
9 . 下列实验目的、方案设计和现象、结论都正确的是
| 实验目的 | 方案设计和现象 | 结论 | |
| A | 比较KMnO4、Cl2和Fe3+的氧化性 | 向酸性KMnO4溶液中滴入FeCl2溶液,紫红色溶液变浅并伴有黄绿色气体产生 | 氧化性:KMnO4>Cl2>Fe3+ |
| B | 检验某溶液中是否含有Fe2+ | 取少量待检液于试管中,先滴加KSCN溶液,无明显变化,再滴加新制氯水,变为红色溶液 | 该溶液一定含有Fe2+ |
| C | 比较Ksp(AgCl)、Ksp(AgI)的大小 | 向NaCl、NaI混合溶液中滴入少量AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl)大于Ksp(AgI) |
| D | 检验某有机物(如图)中含有醛基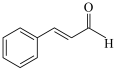 | 取少量待检液于试管中,滴加酸性KMnO4溶液,紫红色褪去 | 该有机物中含有醛基 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-09-17更新
|
1142次组卷
|
3卷引用:广西壮族自治区南宁三中、柳州高中2023-2024学年高三上学期第一次适应性考试化学试题
广西壮族自治区南宁三中、柳州高中2023-2024学年高三上学期第一次适应性考试化学试题江西省上饶市2024届高三下学期第一次高考模拟考试化学试题(已下线)专题03 化学实验基础-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
名校
10 . 下列实验目的、操作、现象及结论合理的是
| 实验目的 | 实验操作 | 现象及结论 | |
| A | 检验CO还原Fe2O3的生成物中是否含有Fe3O4 | 取反应后的固体溶于稀盐酸,滴加KSCN溶液 | 若溶液变红色,则还原产物中含有Fe3O4 |
| B | 比较Fe3+和I2氧化性强弱 | 向FeCl3溶液中滴加淀粉碘化钾溶液 | 若溶液变蓝色,则氧化性:Fe3+>I2 |
| C | 检验FeCl3溶液中是否含有Fe2+ | 向溶液中滴加酸性KMnO4溶液 | 若紫红色退去,则溶液中含有Fe2+ |
| D | 检验溶液中是否含有CO | 取少量溶液于试管中,滴加稀盐酸 | 若产生的气体能使澄清石灰水变浑浊,则溶液中含有CO |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-03-02更新
|
792次组卷
|
4卷引用:广西防城港市实验高级中学2022-2023学年高一下学期期中考试化学试题



