1 . 在医药生产工业上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO 。为检验所得产品中是否含有Fe2+,应使用的试剂为
。为检验所得产品中是否含有Fe2+,应使用的试剂为
 。为检验所得产品中是否含有Fe2+,应使用的试剂为
。为检验所得产品中是否含有Fe2+,应使用的试剂为| A.氯水 | B.KSCN溶液 | C.NaOH溶液 | D.酸性KMnO4溶液 |
您最近一年使用:0次
2021-07-18更新
|
137次组卷
|
4卷引用:第29届(2015年)中国化学奥林匹克竞赛浙江省预赛试题
名校
解题方法
2 . 电子工业中,常用FeCl3溶液腐蚀覆在绝缘板上的铜箔制造印刷电路板。化学实验小组从腐蚀废液(含FeCl3、FeCl2、CuCl2)中回收铜并重新获得FeCl3晶体的流程如图:
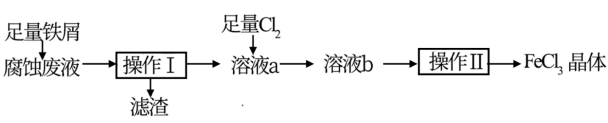
回答下列问题:
(1)检验腐蚀废液中含有Fe3+常用试剂是___ 。
(2)滤渣的成分是___ (填化学式)。从滤渣中获得铜单质,可选用的试剂是___ (填标号)。
A.稀盐酸 B.浓硫酸 C.稀硝酸 D.氯化铜溶液
(3)向溶液a中通入Cl2发生反应的离子方程式为___ 。有同学建议,使用H2O2代替Cl2以减少污染,则反应中氧化剂与还原剂的物质的量之比为___ 。
(4)甲同学用酸性KMnO4溶液检测溶液b中是否含有Fe2+。乙同学认为甲的方案不正确,理由是__ (用离子方程式表示)。

回答下列问题:
(1)检验腐蚀废液中含有Fe3+常用试剂是
(2)滤渣的成分是
A.稀盐酸 B.浓硫酸 C.稀硝酸 D.氯化铜溶液
(3)向溶液a中通入Cl2发生反应的离子方程式为
(4)甲同学用酸性KMnO4溶液检测溶液b中是否含有Fe2+。乙同学认为甲的方案不正确,理由是
您最近一年使用:0次
2021-01-28更新
|
405次组卷
|
2卷引用:山东省高密市第一中学2023-2024学年高一上学期1月冬学竞赛化学试题
名校
解题方法
3 . 离子检验时排除干扰很重要,下列排除干扰的方法正确的是
A.检验 用稀硫酸排除 用稀硫酸排除 的干扰 的干扰 |
B.检验 用稀盐酸排除 用稀盐酸排除 的干扰 的干扰 |
C.检验 用蓝色钴玻璃排除 用蓝色钴玻璃排除 的干扰 的干扰 |
D.检验 用氯水排除 用氯水排除 的干扰 的干扰 |
您最近一年使用:0次
2020-08-17更新
|
364次组卷
|
4卷引用:2018年上海市高中学生化学竞赛(“华理一化工杯”)初赛试题
名校
解题方法
4 . 某兴趣小组将过量Cu与FeCl3溶液充分反应,静置后取上层清液于试管中,将KSCN溶液滴加到清液中,观察到瞬间产生白色沉淀,局部出现红色;振荡试管,红色又迅速褪去。已知:
①CuCl2+Cu=2CuCl↓(白色)——该反应速率很慢
②2CuCl2+4KSCN=2CuSCN↓(白色)+(SCN)2+4KCl——该反应速率很快
③(SCN)2是拟卤素,化学性质和氯气相似
下列说法正确的是( )
①CuCl2+Cu=2CuCl↓(白色)——该反应速率很慢
②2CuCl2+4KSCN=2CuSCN↓(白色)+(SCN)2+4KCl——该反应速率很快
③(SCN)2是拟卤素,化学性质和氯气相似
下列说法正确的是( )
| A.用KSCN溶液检验Fe3+时,Cu2+的存在不会对检验产生干扰 |
| B.局部出现红色主要是因为溶液中的Fe2+被空气中的O2氧化成Fe3+,Fe3+与KSCN反应生成Fe(SCN)3 |
| C.白色沉淀是CuCl,是溶液中CuCl2与Cu反应生成的 |
| D.红色迅速褪去的原因是振荡试管时Cu2+与SCN-发生反应,从而使Fe3++3SCN-⇌Fe(SCN)3平衡逆移 |
您最近一年使用:0次
2020-05-10更新
|
919次组卷
|
16卷引用:湖南省湘西州吉首市2024届高三上学期第二届中小学生教师解题大赛化学试题
湖南省湘西州吉首市2024届高三上学期第二届中小学生教师解题大赛化学试题浙江省衢州、湖州、丽水三地市高三4月教学质量检测化学试题(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)课时18 铜及其化合物 合金-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点16 铜及其金属材料-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点16 铜及其金属材料-备战2022年高考化学一轮复习考点帮(浙江专用)江苏省扬州中学2021-2022学年高三上学期10月考化学试题(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)考点16 铜及其金属材料-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题03 铁 金属材料-2023年高考化学一轮复习小题多维练(全国通用)(已下线)考点16 铜及其金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)湖南省衡阳市第八中学2023-2024学年高三上学期10月月考化学试题陕西省渭南市2023-2024学年高三上学期教学质量检测化学试卷 陕西省渭南市2023-2024学年高三教学质量检测(Ⅰ)化学试题江西省宜春市丰城市第九中学日新班2023-2024学年高二上学期期末考试化学试题
解题方法
5 . 下列各组物质中,X是主要物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的一组是( )
| A | B | C | D | |
| X | FeCl2溶液 | FeCl3溶液 | Fe | Na2SO4溶液 |
| Y | FeCl3 | CuCl2 | Al | Na2CO3 |
| Z | Cl2 | Fe | NaOH溶液 | HCl溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
6 . 为了检验某氯化亚铁溶液是否变质,可向溶液中加入
| A.氢氧化钠溶液 | B.铁片 |
| C.硫氰酸钾溶液 | D.酸性KMnO4溶液 |
您最近一年使用:0次
2017-11-27更新
|
1490次组卷
|
4卷引用:甘肃省古浪县第二中学2019-2020学年高一12月基础知识竞赛化学试题
7 . 下列化学反应先后顺序判断正确的是( )
| A.含有等物质的量的H+、Al3+的溶液中,逐滴加入NaOH溶液:H+、Al3+、Al(OH)3 |
| B.含有等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气: I-、Br-、Fe2+ |
| C.含有等物质的量的NaCl、Na2S的溶液中加入AgNO3溶液:NaCl、Na2S |
| D.含有等物质的量的Fe3+、Cu2+的溶液中加入铁粉:Cu2+、Fe3+ |
您最近一年使用:0次
2016-12-09更新
|
931次组卷
|
6卷引用:2016届河南省三门峡市陕州中学高三上学期第二次精英对抗赛化学试卷
2016届河南省三门峡市陕州中学高三上学期第二次精英对抗赛化学试卷2015届湖北省七市(州)教科研协作体4月高三联合考试理综化学试卷(已下线)二轮复习 专题3 氧化还原反应 押题专练(已下线)2019高考备考二轮复习精品资料-专题3 氧化还原反应(押题专练)(已下线)专题04 离子反应(缺项配平、离子检验、离子推断、共存)-2021年高考化学必做热点专题(已下线)专题34 分类例析元素化合物综合应用试题中存在的陷阱-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)
名校
解题方法
8 . 下列叙述不正确的是( )
| A.向AlCl3溶液中滴加氨水,产生白色沉淀;再加入NaHSO4溶液,沉淀溶解 |
| B.在Cu(NO3)2溶液中加入铜粉,铜粉不溶解;再加入稀硫酸溶液,铜粉溶解 |
C.用如图所示的装置可以测定黄铜(Cu,Zn合金)中Zn的含量 |
| D.在FeCl3溶液中加入KSCN溶液,溶液变红,加入足量铁粉充分振荡,溶液红色褪去 |
您最近一年使用:0次
9 . 铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:

⑴试剂1是__________ 。
⑵加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是______________________________________ 。
⑶在实验中发现放置一段时间,溶液的颜色会逐渐褪去。为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想:
基于乙同学的猜想,请设计实验方案,验证乙同学的猜想是否正确。写出有关的实验操作、预期现象和结论。(不一定填满,也可以补充)_______________
⑷另一同学为了检测“速力菲”药片中铁的含量,设计并进行了如下实验:
①取样、碾碎,并称取2.0g,加入过量盐酸,搅拌使其完全溶解;
②向所得溶液中先加入足量H2O2溶液,再加入足量氨水,充分反应后过滤并洗涤沉淀;
③将所得固体灼烧至恒重,得0.8g红棕色固体。
④计算:“速力菲”药片中铁的质量分数为_______ 。

⑴试剂1是
⑵加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是
⑶在实验中发现放置一段时间,溶液的颜色会逐渐褪去。为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想:
| 编号 | 猜 想 |
| 甲 | 溶液中的+3价Fe又被还原为+2价Fe |
| 乙 | 溶液中的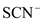 被过量的氯水氧化 被过量的氯水氧化 |
| 丙 | 新制的氯水具有漂白性,将该溶液漂白 |
| 编号 | 实验操作 | 预期现象和结论 |
①取样、碾碎,并称取2.0g,加入过量盐酸,搅拌使其完全溶解;
②向所得溶液中先加入足量H2O2溶液,再加入足量氨水,充分反应后过滤并洗涤沉淀;
③将所得固体灼烧至恒重,得0.8g红棕色固体。
④计算:“速力菲”药片中铁的质量分数为
您最近一年使用:0次
2011高二·安徽·竞赛
10 . 从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:

请回答下列问题:
(1)向滤液Y中通入少量CO2时生成的沉淀只有F,发生反应的离子方程式为___________ ;判断OH-、SiO32-、AlO2-结合H+能力由强到弱的顺序为___________ ;
(2)欲检验滤液D中是否含有Fe3+,请写出检验该离子的实验操作___________ ;
(3)流程乙加入烧碱后生成SiO32-的离子方程式为___________ ;
(4)滤液E、K中相同的溶质为_______ (填化学式),将该物质的溶液加入到偏铝酸钠溶液中生成白色沉淀,写出该反应的离子方程式___________ 。

请回答下列问题:
(1)向滤液Y中通入少量CO2时生成的沉淀只有F,发生反应的离子方程式为
(2)欲检验滤液D中是否含有Fe3+,请写出检验该离子的实验操作
(3)流程乙加入烧碱后生成SiO32-的离子方程式为
(4)滤液E、K中相同的溶质为
您最近一年使用:0次



