1 . 实验是探究物质性质的重要方法,下列操作中,实验现象与得出的结论相一致的是
| 选项 | 实验目的 | 操作及现象 | 结论 |
| A | 比较HClO和CH3COOH的酸性强弱 | 用pH计测定NaClO和CH3COONa的pH值,测得pH(NaClO)>pH(CH3COONa) | 酸性:HClO>CH3COOH |
| B | 验证反应2Fe3++2I- 2Fe2++I2是可逆反应 2Fe2++I2是可逆反应 | 向2mL 0.1mol/L FeCl3溶液加入几滴0.1mol/L KI溶液,充分反应。取反应后试样,滴加淀粉溶液,溶液变为蓝色;另取反应后试样,加入KSCN溶液,溶液变成血红色 | 反应2Fe3++2I- 2Fe2++I2是可逆反应 2Fe2++I2是可逆反应 |
| C | 判断 (AgCl)与 (AgCl)与 (AgI)的大小 (AgI)的大小 | 向等浓度的NaCl、NaI的混合溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl)>Ksp(AgI) |
| D | 判断某 溶液样品中是否含有 溶液样品中是否含有 | 向某 溶液样品中加入硫酸酸化的 溶液样品中加入硫酸酸化的 溶液,紫色褪去 溶液,紫色褪去 | 该样品中一定含有 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 针对表中10种元素及由这些元素形成的单质和化合物,完成以下问题。
(1)最活泼的金属元素是___________ (填元素符号),最高价氧化物对应水化物酸性最强的是___________ (填氧化物对应水化物的化学式)。
(2)用电子式表示⑤和⑨两种元素组成的化合物的形成过程___________ 。
(3)①②⑦的原子半径由大到小的顺序为___________ (填元素符号)。
(4)①和⑧非金属性比较①___________ ⑧(填>、<或=),请设计实验证明___________ (用一个化学方程式表示)。
(5)写出元素⑥的单质与元素④最高价氧化物对应水化物反应的化学方程式___________ 。
(6)为证明某溶液中不含Fe3+而可能含有Fe2+,选用下列试剂进行实验,可行的操作顺序___________。
①加入少量的氯水 ②加入少量酸性KMnO4溶液 ③加入KSCN溶液
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 2 | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ |
(2)用电子式表示⑤和⑨两种元素组成的化合物的形成过程
(3)①②⑦的原子半径由大到小的顺序为
(4)①和⑧非金属性比较①
(5)写出元素⑥的单质与元素④最高价氧化物对应水化物反应的化学方程式
(6)为证明某溶液中不含Fe3+而可能含有Fe2+,选用下列试剂进行实验,可行的操作顺序___________。
①加入少量的氯水 ②加入少量酸性KMnO4溶液 ③加入KSCN溶液
| A.①③ | B.③② | C.③① | D.①② |
您最近一年使用:0次
解题方法
3 . 除去下列物质中的杂质,所用试剂和方法正确的是
| 选项 | 物质 | 杂质 | 除杂质所用试剂(过量) | 操作方法 |
| ① | 铝粉 | 铁粉 | NaOH 溶液 | 过滤 |
| ② | KNO3溶液 | K2SO4 | Ba(NO3)2 溶液 | 过滤 |
| ③ | Cl2 | HCl | 饱和 NaCl 溶液、浓硫酸 | 洗气 |
| ④ | FeCl3 | CuCl2 | 铁屑 | 过滤 |
| A.① | B.② | C.③ | D.④ |
您最近一年使用:0次
解题方法
4 . 下列各组离子能在溶液中大量共存的是
A.K+、H+、 、OH- 、OH- | B.Fe3+、SCN-、Cl-、Na+ |
C.Na+、H+、Cl-、 | D.Na+、Cu2+、Cl-、 |
您最近一年使用:0次
名校
5 . 下列实验目的、方案设计和现象、结论都正确的是
| 选项 | 实验目的 | 方案设计和现象 | 结论 |
| A | 验证浓硫酸的性质 | 将浓硫酸滴入蔗糖中并搅拌,得到黑色蓬松的固体,并产生刺激性气味的气体 | 浓硫酸具有强氧化性和脱水性 |
| B | 探究钠在空气中久置后所得固体成分 | 取少量固体,加入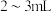 蒸馏水,有气体产生 蒸馏水,有气体产生 | 固体中一定含 |
| C | 检验某溶液中是否含有 | 取少量待检液于试管中,滴加新制氯水后滴加 溶液,溶液变为红色 溶液,溶液变为红色 | 该溶液含有 |
| D | 检验 和浓盐酸反应后是否有酸剩余 和浓盐酸反应后是否有酸剩余 | 取少量反应后的溶液于试管中,依次加入稀硝酸、 溶液 溶液 | 产生大量白色沉淀,则盐酸有剩余 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-04-03更新
|
249次组卷
|
2卷引用:四川省绵阳南山中学2023-2024学年高一下学期入学考试化学试题
名校
解题方法
6 . 明矾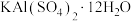 在日常生活中用途非常广泛。用废铝灰(含Al、
在日常生活中用途非常广泛。用废铝灰(含Al、 、Fe、
、Fe、 、FeO等)为原料制取明矾的工艺流程如下图。回答下列问题:
、FeO等)为原料制取明矾的工艺流程如下图。回答下列问题:
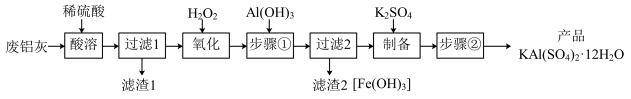
已知: 开始沉淀到沉淀完全时溶液的pH为1.9~3.7;
开始沉淀到沉淀完全时溶液的pH为1.9~3.7; 开始沉淀到完全沉淀时溶液的pH为5.5~8.5。
开始沉淀到完全沉淀时溶液的pH为5.5~8.5。
(1)“酸溶”时, 溶解的离子方程式为
溶解的离子方程式为_____ 。
(2)“氧化”时,发生反应的离子方程式为_____ 。
(3)“步骤①”调节pH约为3.7的目的是_____ ;检验“过滤2”滤液中是否含 可用试剂
可用试剂_____ 。
(4)“步骤②”包含的操作有_____ 、_____ 、过滤、洗涤及干燥。
(5)已知废铝灰中铝元素的含量为a%,则mkg废铝灰理论上可制得明矾_____ kg。
 在日常生活中用途非常广泛。用废铝灰(含Al、
在日常生活中用途非常广泛。用废铝灰(含Al、 、Fe、
、Fe、 、FeO等)为原料制取明矾的工艺流程如下图。回答下列问题:
、FeO等)为原料制取明矾的工艺流程如下图。回答下列问题:
已知:
 开始沉淀到沉淀完全时溶液的pH为1.9~3.7;
开始沉淀到沉淀完全时溶液的pH为1.9~3.7; 开始沉淀到完全沉淀时溶液的pH为5.5~8.5。
开始沉淀到完全沉淀时溶液的pH为5.5~8.5。(1)“酸溶”时,
 溶解的离子方程式为
溶解的离子方程式为(2)“氧化”时,发生反应的离子方程式为
(3)“步骤①”调节pH约为3.7的目的是
 可用试剂
可用试剂(4)“步骤②”包含的操作有
(5)已知废铝灰中铝元素的含量为a%,则mkg废铝灰理论上可制得明矾
您最近一年使用:0次
名校
7 . 硫脲 是一种杀菌剂。某小组设计实验制备硫脲并探究其性质。
是一种杀菌剂。某小组设计实验制备硫脲并探究其性质。
实验(一):制备硫脲。装置如图所示(加热装置已省略)。

已知:① ;
;
②25℃时硫脲溶解度为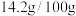 水;
水;
③实验室常用FeS与稀 在常温下制
在常温下制 。
。
(1)盛放石灰乳的仪器的名称是_______ ,B的加热方式宜选择_______ (填标号)。
a.直接用酒精灯加热 b.油浴加热(100~250℃) c.热水浴加热
(2)当C装置中出现_______ (填实验现象)时表明B中生成了 。
。
(3)实验发现,硫脲产率与投料比 的关系如图所示。
的关系如图所示。
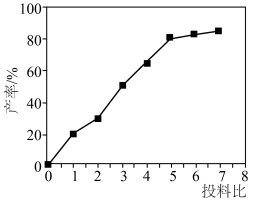
最佳投料比为_______ 。
实验(二):探究硫脲的性质。
资料显示:①150℃时 转化成
转化成 。
。
②酸性 溶液和硫脲反应,还原产物为
溶液和硫脲反应,还原产物为 ,氧化产物为
,氧化产物为 和
和 。
。
(4)取少量 溶于水,加热至150℃,一段时间后再冷却至室温时,滴加
溶于水,加热至150℃,一段时间后再冷却至室温时,滴加_______ ,可检验是否有 生成。
生成。
(5)取少量 溶于NaOH溶液,加入
溶于NaOH溶液,加入 溶液,过滤、洗涤,得到黑色固体,由此推知,
溶液,过滤、洗涤,得到黑色固体,由此推知, 在碱性条件下会生成
在碱性条件下会生成_______ (填离子符号)。
(6)甲同学取少量 溶于水,滴加几滴酸性
溶于水,滴加几滴酸性 溶液,振荡,溶液褪色;再滴加
溶液,振荡,溶液褪色;再滴加 和盐酸溶液,产生白色沉淀。
和盐酸溶液,产生白色沉淀。
①乙同学认为甲同学的实验不能证明生成了 ,理由是
,理由是_______ 。
②乙同学设计如图装置验证氧化产物中含有 。
。
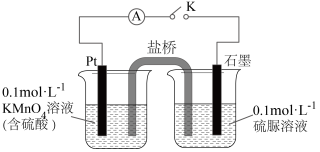
关闭K,发现电流计指针偏转。一段时间后,左烧杯中酸性高锰酸钾溶液褪色。铂电极上的反应式为_______ ,经检验石墨电极附近还有 和
和 生成,总反应的离子方程式为
生成,总反应的离子方程式为_______ 。
 是一种杀菌剂。某小组设计实验制备硫脲并探究其性质。
是一种杀菌剂。某小组设计实验制备硫脲并探究其性质。实验(一):制备硫脲。装置如图所示(加热装置已省略)。

已知:①
 ;
;②25℃时硫脲溶解度为
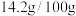 水;
水;③实验室常用FeS与稀
 在常温下制
在常温下制 。
。(1)盛放石灰乳的仪器的名称是
a.直接用酒精灯加热 b.油浴加热(100~250℃) c.热水浴加热
(2)当C装置中出现
 。
。(3)实验发现,硫脲产率与投料比
 的关系如图所示。
的关系如图所示。
最佳投料比为
实验(二):探究硫脲的性质。
资料显示:①150℃时
 转化成
转化成 。
。②酸性
 溶液和硫脲反应,还原产物为
溶液和硫脲反应,还原产物为 ,氧化产物为
,氧化产物为 和
和 。
。(4)取少量
 溶于水,加热至150℃,一段时间后再冷却至室温时,滴加
溶于水,加热至150℃,一段时间后再冷却至室温时,滴加 生成。
生成。(5)取少量
 溶于NaOH溶液,加入
溶于NaOH溶液,加入 溶液,过滤、洗涤,得到黑色固体,由此推知,
溶液,过滤、洗涤,得到黑色固体,由此推知, 在碱性条件下会生成
在碱性条件下会生成(6)甲同学取少量
 溶于水,滴加几滴酸性
溶于水,滴加几滴酸性 溶液,振荡,溶液褪色;再滴加
溶液,振荡,溶液褪色;再滴加 和盐酸溶液,产生白色沉淀。
和盐酸溶液,产生白色沉淀。①乙同学认为甲同学的实验不能证明生成了
 ,理由是
,理由是②乙同学设计如图装置验证氧化产物中含有
 。
。
关闭K,发现电流计指针偏转。一段时间后,左烧杯中酸性高锰酸钾溶液褪色。铂电极上的反应式为
 和
和 生成,总反应的离子方程式为
生成,总反应的离子方程式为
您最近一年使用:0次
2024-04-01更新
|
232次组卷
|
2卷引用:四川省雅安市雅安中学等校联考2023-2024学年高三下学期开学考试理综试题-高中化学
解题方法
8 . 某酸性废液中含有 四种金属离子。有同学设计下列方案对废液进行处理(所加试剂均稍过量),减少对环境的污染,流程如图所示:
四种金属离子。有同学设计下列方案对废液进行处理(所加试剂均稍过量),减少对环境的污染,流程如图所示:

回答下列问题:
(1)该酸性废液中可能大量含有的阴离子是 (填标号)。
A. | B. | C. | D. |
(2)沉淀
 的化学式是
的化学式是 的化学式是
的化学式是(3)已知氧化性强弱:
 ,加入铁屑发生的离子反应有:
,加入铁屑发生的离子反应有:①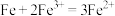 ;
;
②
③
(4)判断铁屑过量的实验现象是
(5)检验溶液
 中不含
中不含 的操作及现象是
的操作及现象是(6)向溶液
 中逐滴加入稀盐酸,理论上先后参与反应的离子依次是
中逐滴加入稀盐酸,理论上先后参与反应的离子依次是 。
。
您最近一年使用:0次
名校
9 . 综合利用废弃物,对资源利用和环境保护具有现实意义。以废铁屑(含少量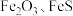 等杂质)为原料,制备硫酸亚铁晶体(
等杂质)为原料,制备硫酸亚铁晶体( ),流程示意图如下。
),流程示意图如下。
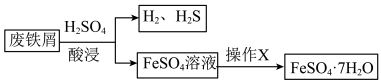
(1)酸浸过程中, 的作用是
的作用是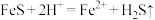 、
、 、
、___________ (用离子方程式表示)。
(2)酸浸时间对所得溶液的成分影响如下表所示。
①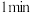 时检验,溶液变红,写出离子方程式
时检验,溶液变红,写出离子方程式___________
② 时检验,用离子方程式表示溶液未变红的原因
时检验,用离子方程式表示溶液未变红的原因___________ 。
③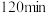 时检验,溶液复又变红,用文字说明原因
时检验,溶液复又变红,用文字说明原因___________ 。
(3)已知: 受热易失水。操作X为:
受热易失水。操作X为: ___________ 。
(4)测定所得硫酸亚铁晶体中 的含量,步骤如下:
的含量,步骤如下:
Ⅰ.称取 硫酸亚铁晶体样品,配制成
硫酸亚铁晶体样品,配制成 溶液。
溶液。
Ⅱ.取出 溶液,加入适量稀硫酸,滴入
溶液,加入适量稀硫酸,滴入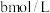 的
的 溶液,至反应完全共消耗
溶液,至反应完全共消耗 溶液
溶液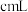 。
。
①依题意完善Ⅱ中 氧化
氧化 的离子方程式
的离子方程式________

 ___________
___________
 ___________
___________
②计算硫酸亚铁晶体样品中 的质量分数
的质量分数___________ 。
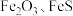 等杂质)为原料,制备硫酸亚铁晶体(
等杂质)为原料,制备硫酸亚铁晶体( ),流程示意图如下。
),流程示意图如下。
(1)酸浸过程中,
 的作用是
的作用是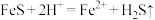 、
、 、
、(2)酸浸时间对所得溶液的成分影响如下表所示。
| 酸浸时间 |  |  |  |
用 溶液检验 溶液检验 | 变红 | 未变红 | 变红 |
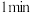 时检验,溶液变红,写出离子方程式
时检验,溶液变红,写出离子方程式②
 时检验,用离子方程式表示溶液未变红的原因
时检验,用离子方程式表示溶液未变红的原因③
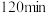 时检验,溶液复又变红,用文字说明原因
时检验,溶液复又变红,用文字说明原因(3)已知:
 受热易失水。操作X为:
受热易失水。操作X为: (4)测定所得硫酸亚铁晶体中
 的含量,步骤如下:
的含量,步骤如下:Ⅰ.称取
 硫酸亚铁晶体样品,配制成
硫酸亚铁晶体样品,配制成 溶液。
溶液。Ⅱ.取出
 溶液,加入适量稀硫酸,滴入
溶液,加入适量稀硫酸,滴入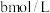 的
的 溶液,至反应完全共消耗
溶液,至反应完全共消耗 溶液
溶液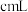 。
。①依题意完善Ⅱ中
 氧化
氧化 的离子方程式
的离子方程式
 ___________
___________
 ___________
___________②计算硫酸亚铁晶体样品中
 的质量分数
的质量分数
您最近一年使用:0次
2024-03-27更新
|
218次组卷
|
4卷引用:四川省眉山市仁寿第一中学校南校区2023-2024学年高一下学期开学化学试题
10 . 固体粉末可能由Na2CO3、CuSO4、FeCl3、FeCl2、KCl中的几种等物质的量混合而成,进行如下实验:
①取2.87g固体溶于足量水中,得到澄清透明溶液,将溶液分为二等份。
②在第一份溶液中滴加足量稀盐酸无明显现象,再滴加足量 溶液,过滤、洗涤、干燥,得到
溶液,过滤、洗涤、干燥,得到 固体。
固体。
③在第二份溶液中滴加 溶液无明显现象,继续滴加双氧水,溶液显红色。
溶液无明显现象,继续滴加双氧水,溶液显红色。
下列说法正确的是
①取2.87g固体溶于足量水中,得到澄清透明溶液,将溶液分为二等份。
②在第一份溶液中滴加足量稀盐酸无明显现象,再滴加足量
 溶液,过滤、洗涤、干燥,得到
溶液,过滤、洗涤、干燥,得到 固体。
固体。③在第二份溶液中滴加
 溶液无明显现象,继续滴加双氧水,溶液显红色。
溶液无明显现象,继续滴加双氧水,溶液显红色。下列说法正确的是
| A.固体粉末中肯定有Na2CO3 |
| B.根据③中的颜色能判断固体粉末中一定含有FeCl3 |
| C.固体粉末中肯定含有CuSO4、FeCl2 |
| D.上述实验可以确定固体粉末肯定含有KCl |
您最近一年使用:0次



