名校
解题方法
1 . 某溶液中只可能含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的若干种离子,离子浓度均为
中的若干种离子,离子浓度均为 。某同学进行了如下实验:(已知
。某同学进行了如下实验:(已知 、
、 与
与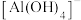 在水溶液中都能生成氢氧化铝沉淀)
在水溶液中都能生成氢氧化铝沉淀)
(1)原溶液中一定存在的离子是___________ 。
(2)沉淀C的成分是___________ 。
(3)写出加入过量 时产生气体的离子方程式
时产生气体的离子方程式___________ ,检验产物中的阳离子所用试剂为___________ ,现象___________ 。
(4)是否需要通过焰色试验来确定 的存在?
的存在?___________ (填“是”或“否”)。
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的若干种离子,离子浓度均为
中的若干种离子,离子浓度均为 。某同学进行了如下实验:(已知
。某同学进行了如下实验:(已知 、
、 与
与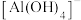 在水溶液中都能生成氢氧化铝沉淀)
在水溶液中都能生成氢氧化铝沉淀)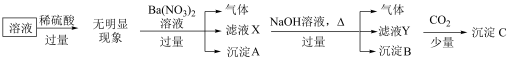
(1)原溶液中一定存在的离子是
(2)沉淀C的成分是
(3)写出加入过量
 时产生气体的离子方程式
时产生气体的离子方程式(4)是否需要通过焰色试验来确定
 的存在?
的存在?
您最近一年使用:0次
名校
2 .  .绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
.绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
为探究硫酸亚铁的分解产物,将绿矾加热失去结晶水至恒重,将所得固体置于装置A接入下图所示的装置中,打开 和
和 ,缓缓通入
,缓缓通入 ,加热。实验后反应管中残留固体为红色粉末。
,加热。实验后反应管中残留固体为红色粉末。___________ 、玻璃棒、酒精灯。
(2)①C、D中的溶液依次为___________ (填标号)。C、D中有气泡冒出,并可观察到的现象分别为___________ 。
a.品红 b. c.
c. d.
d. e.浓
e.浓
②写出硫酸亚铁高温分解反应的化学方程式___________ 。
 .工业上利用氧化亚铁硫杆菌(T·f)对硫铁矿进行催化脱硫的过程如下图所示:
.工业上利用氧化亚铁硫杆菌(T·f)对硫铁矿进行催化脱硫的过程如下图所示: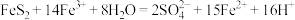
(3)① 的电子式为
的电子式为___________ 。
②过程 反应的离子方程式为
反应的离子方程式为___________ 。
③脱硫过程中产生的 在酸性溶液中会形成黄色沉淀和一种能使品红溶液褪色的气体,其原因可能是
在酸性溶液中会形成黄色沉淀和一种能使品红溶液褪色的气体,其原因可能是___________ (用离子方程式表示)。
(4)接触法制硫酸生产中的关键工序是 的催化氧化:
的催化氧化: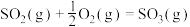
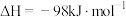 。钒催化剂参与反应的能量变化如图所示,
。钒催化剂参与反应的能量变化如图所示,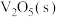 与
与 反应生成
反应生成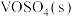 和
和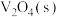 的热化学方程为:
的热化学方程为:___________ 。
 .绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
.绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:为探究硫酸亚铁的分解产物,将绿矾加热失去结晶水至恒重,将所得固体置于装置A接入下图所示的装置中,打开
 和
和 ,缓缓通入
,缓缓通入 ,加热。实验后反应管中残留固体为红色粉末。
,加热。实验后反应管中残留固体为红色粉末。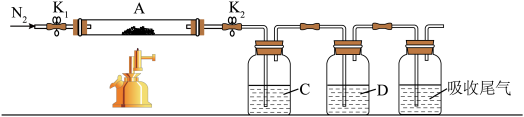
(2)①C、D中的溶液依次为
a.品红 b.
 c.
c. d.
d. e.浓
e.浓
②写出硫酸亚铁高温分解反应的化学方程式
 .工业上利用氧化亚铁硫杆菌(T·f)对硫铁矿进行催化脱硫的过程如下图所示:
.工业上利用氧化亚铁硫杆菌(T·f)对硫铁矿进行催化脱硫的过程如下图所示: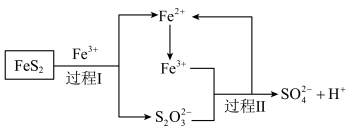
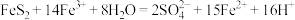
(3)①
 的电子式为
的电子式为②过程
 反应的离子方程式为
反应的离子方程式为③脱硫过程中产生的
 在酸性溶液中会形成黄色沉淀和一种能使品红溶液褪色的气体,其原因可能是
在酸性溶液中会形成黄色沉淀和一种能使品红溶液褪色的气体,其原因可能是(4)接触法制硫酸生产中的关键工序是
 的催化氧化:
的催化氧化: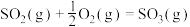
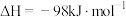 。钒催化剂参与反应的能量变化如图所示,
。钒催化剂参与反应的能量变化如图所示,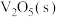 与
与 反应生成
反应生成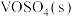 和
和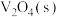 的热化学方程为:
的热化学方程为: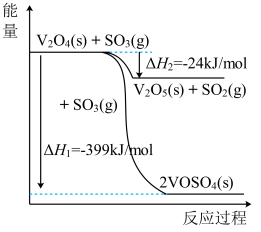
您最近一年使用:0次
3 . 某实验小组对KSCN的性质进行探究,设计如下实验:
(1) 存在两种结构式,分别为
存在两种结构式,分别为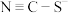 和
和 ,
, 是二者的互变异构的混合物,请写出
是二者的互变异构的混合物,请写出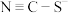 的电子式
的电子式___________ 。
(2)①用离子方程式表示实验 溶液变红的原因
溶液变红的原因___________ 、___________ 。
②针对实验 中红色褪去的原因,小组同学认为是
中红色褪去的原因,小组同学认为是 被酸性
被酸性 氧化为
氧化为 ,并设计如如图实验装置证实了猜想是成立的。
,并设计如如图实验装置证实了猜想是成立的。 溶液是
溶液是___________ , 溶液是
溶液是___________ ,检验产物 的操作及现象是
的操作及现象是___________ 。
(3)工业上测定钛铁合金中钛含量的其中一步反应原理是:以 为指示剂,用
为指示剂,用 标准溶液滴定
标准溶液滴定 (
( ),反应的化学方程式为:
),反应的化学方程式为: ,每
,每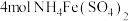 参加反应时转移电子的物质的量为
参加反应时转移电子的物质的量为___________ 。
(4)针对实验 “红色明显变浅”的现象,实验小组进行探究。
“红色明显变浅”的现象,实验小组进行探究。
甲同学查资料得知: 和
和 反应的溶液体系中也存在
反应的溶液体系中也存在 平衡体系。当弱电解质溶液加入强电解质后,增大了离子间相互作用,离子之间牵制作用增强,即“盐效应”。“盐效应”使
平衡体系。当弱电解质溶液加入强电解质后,增大了离子间相互作用,离子之间牵制作用增强,即“盐效应”。“盐效应”使 平衡体系中的
平衡体系中的 跟
跟 结合成
结合成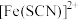 的机会减少,溶液红色变浅。乙同学认为
的机会减少,溶液红色变浅。乙同学认为 可以与
可以与 反应生成无色络合离子,进一步使
反应生成无色络合离子,进一步使 平衡左移,红色明显变浅,而
平衡左移,红色明显变浅,而 与
与 难络合,于是乙设计了如下实验:
难络合,于是乙设计了如下实验:___________ 。
| 试管中试剂 | 实验 | 滴加试剂 | 现象 |
|  | i.先加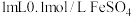 溶液 溶液ii.再加硫酸酸化的  溶液 溶液 | i.无明显现象 ii.先变红,后褪色 |
 | iii.先加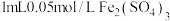 溶液 溶液iv.再滴加  溶液 溶液 | i.溶液变红 iv.红色明显变浅 |
(1)
 存在两种结构式,分别为
存在两种结构式,分别为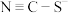 和
和 ,
, 是二者的互变异构的混合物,请写出
是二者的互变异构的混合物,请写出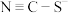 的电子式
的电子式(2)①用离子方程式表示实验
 溶液变红的原因
溶液变红的原因②针对实验
 中红色褪去的原因,小组同学认为是
中红色褪去的原因,小组同学认为是 被酸性
被酸性 氧化为
氧化为 ,并设计如如图实验装置证实了猜想是成立的。
,并设计如如图实验装置证实了猜想是成立的。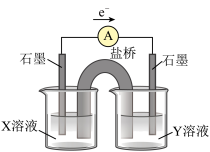
 溶液是
溶液是 溶液是
溶液是 的操作及现象是
的操作及现象是(3)工业上测定钛铁合金中钛含量的其中一步反应原理是:以
 为指示剂,用
为指示剂,用 标准溶液滴定
标准溶液滴定 (
( ),反应的化学方程式为:
),反应的化学方程式为: ,每
,每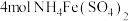 参加反应时转移电子的物质的量为
参加反应时转移电子的物质的量为(4)针对实验
 “红色明显变浅”的现象,实验小组进行探究。
“红色明显变浅”的现象,实验小组进行探究。甲同学查资料得知:
 和
和 反应的溶液体系中也存在
反应的溶液体系中也存在 平衡体系。当弱电解质溶液加入强电解质后,增大了离子间相互作用,离子之间牵制作用增强,即“盐效应”。“盐效应”使
平衡体系。当弱电解质溶液加入强电解质后,增大了离子间相互作用,离子之间牵制作用增强,即“盐效应”。“盐效应”使 平衡体系中的
平衡体系中的 跟
跟 结合成
结合成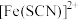 的机会减少,溶液红色变浅。乙同学认为
的机会减少,溶液红色变浅。乙同学认为 可以与
可以与 反应生成无色络合离子,进一步使
反应生成无色络合离子,进一步使 平衡左移,红色明显变浅,而
平衡左移,红色明显变浅,而 与
与 难络合,于是乙设计了如下实验:
难络合,于是乙设计了如下实验: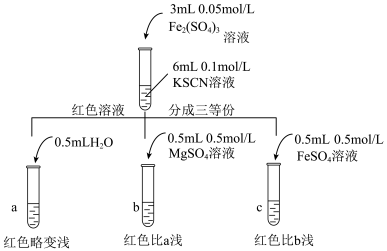
您最近一年使用:0次
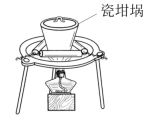
4 . 明矾是生活中常见的净水剂,用铝土矿 含30%SiO2、40.8%Al2O3和和少量
含30%SiO2、40.8%Al2O3和和少量 等
等 制取明矾的工艺如下:
制取明矾的工艺如下: (少部分发生类似反应),气体
(少部分发生类似反应),气体 的化学式为
的化学式为_____ 。
(2)操作①的名称是_____ ,操作①后,需洗涤固体 表面吸附的离子,判断固体
表面吸附的离子,判断固体 是否洗涤干净的实验方法是:取最后一次洗涤后的浸出液于试管中,滴加
是否洗涤干净的实验方法是:取最后一次洗涤后的浸出液于试管中,滴加 溶液,观察到
溶液,观察到_____ ,说明已洗涤干净。
(3)固体 加稀硫酸反应的离子方程式为
加稀硫酸反应的离子方程式为_____ 。
(4)固体 与
与 固体焙烧可制备防火材料,下列装置适合的是
固体焙烧可制备防火材料,下列装置适合的是_____  填字母编号
填字母编号 。
。 铝土矿,理论上可制得明矾
铝土矿,理论上可制得明矾_____  明矾的相对分子质量为474)。
明矾的相对分子质量为474)。
 含30%SiO2、40.8%Al2O3和和少量
含30%SiO2、40.8%Al2O3和和少量 等
等 制取明矾的工艺如下:
制取明矾的工艺如下: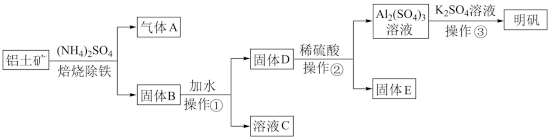
 (少部分发生类似反应),气体
(少部分发生类似反应),气体 的化学式为
的化学式为(2)操作①的名称是
 表面吸附的离子,判断固体
表面吸附的离子,判断固体 是否洗涤干净的实验方法是:取最后一次洗涤后的浸出液于试管中,滴加
是否洗涤干净的实验方法是:取最后一次洗涤后的浸出液于试管中,滴加 溶液,观察到
溶液,观察到(3)固体
 加稀硫酸反应的离子方程式为
加稀硫酸反应的离子方程式为(4)固体
 与
与 固体焙烧可制备防火材料,下列装置适合的是
固体焙烧可制备防火材料,下列装置适合的是 填字母编号
填字母编号 。
。



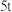 铝土矿,理论上可制得明矾
铝土矿,理论上可制得明矾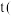 明矾的相对分子质量为474)。
明矾的相对分子质量为474)。
您最近一年使用:0次
5 . 健康人体内含铁元素大约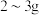 ,人体内铁元素以亚铁离子和三价铁离子的形式存在,
,人体内铁元素以亚铁离子和三价铁离子的形式存在, 易被吸收,所以给贫血者补充铁元素时,应补充含
易被吸收,所以给贫血者补充铁元素时,应补充含 的亚铁盐。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中
的亚铁盐。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中 的存在,设计并进行了如图实验:
的存在,设计并进行了如图实验:_____ ;试剂2的化学式为_____ 。
(2)加入新制氯水,溶液中发生反应的离子方程式是_____ 。
(3)加入试剂2时溶液为淡红色说明“速力非”中的 已被部分氧化,一般在服用“速力菲”时,同时服用维生素C,说明维生素C具有
已被部分氧化,一般在服用“速力菲”时,同时服用维生素C,说明维生素C具有_____ 性。
(4)不仅溶液中 易被氧化成
易被氧化成 ,溶液中白色沉淀
,溶液中白色沉淀 更易被
更易被 氧化,请写出反应的化学方程式:
氧化,请写出反应的化学方程式:______ 。
(5) 溶液存放时应在试剂瓶中加入
溶液存放时应在试剂瓶中加入______ ,防止 被氧化。
被氧化。
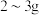 ,人体内铁元素以亚铁离子和三价铁离子的形式存在,
,人体内铁元素以亚铁离子和三价铁离子的形式存在, 易被吸收,所以给贫血者补充铁元素时,应补充含
易被吸收,所以给贫血者补充铁元素时,应补充含 的亚铁盐。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中
的亚铁盐。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中 的存在,设计并进行了如图实验:
的存在,设计并进行了如图实验:
(2)加入新制氯水,溶液中发生反应的离子方程式是
(3)加入试剂2时溶液为淡红色说明“速力非”中的
 已被部分氧化,一般在服用“速力菲”时,同时服用维生素C,说明维生素C具有
已被部分氧化,一般在服用“速力菲”时,同时服用维生素C,说明维生素C具有(4)不仅溶液中
 易被氧化成
易被氧化成 ,溶液中白色沉淀
,溶液中白色沉淀 更易被
更易被 氧化,请写出反应的化学方程式:
氧化,请写出反应的化学方程式:(5)
 溶液存放时应在试剂瓶中加入
溶液存放时应在试剂瓶中加入 被氧化。
被氧化。
您最近一年使用:0次
解题方法
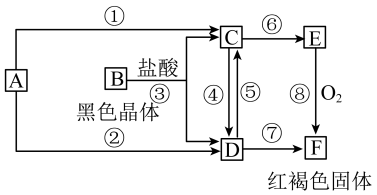
6 . 已知A为常见的金属单质,根据下图所示的关系:___________ ,B为___________ ,C为___________ ,D为___________ ,E为___________ ,F为___________ 。
(2)写出④⑤的离子方程式,⑧的化学方程式。
④___________ ,
⑤___________ ,
⑧___________ 。
(2)写出④⑤的离子方程式,⑧的化学方程式。
④
⑤
⑧
您最近一年使用:0次
名校
解题方法
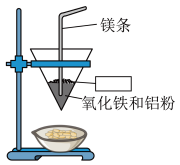
7 . 将铝与氧化铁混合制备单质铁的反应称为铝热反应,反应装置如图所示:_____ 。
(2)该铝热反应的化学方程式为_____ ,引发铝热反应的实验操作是_____ 。
(3)取少量反应所得的固体混合物,将其溶于足量稀 ,滴加KSCN溶液无明显现象,能否说明固体混合物中已无
,滴加KSCN溶液无明显现象,能否说明固体混合物中已无 ,请判断并说明理由
,请判断并说明理由_____ 。
(4)写出一种铝热反应的实际应用_____ 。
(2)该铝热反应的化学方程式为
(3)取少量反应所得的固体混合物,将其溶于足量稀
 ,滴加KSCN溶液无明显现象,能否说明固体混合物中已无
,滴加KSCN溶液无明显现象,能否说明固体混合物中已无 ,请判断并说明理由
,请判断并说明理由(4)写出一种铝热反应的实际应用
您最近一年使用:0次
名校
解题方法
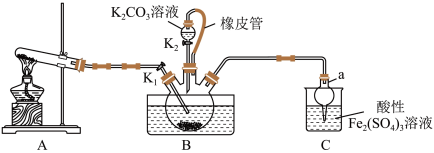
8 . 硫氰化钾(KSCN)是一种用途广泛的化工原料,常用于染料、药物的生产。实验小组设计如图实验装置模拟工业制备 KSCN 并进行相关探究实验。___________ 。
(2)装置A用于实验室制备氨气,反应的化学方程式为___________ 。
(3)装置B中,三颈烧瓶内盛放有 CS₂、水和固体催化剂,通入氨气的导管口需要浸没在 CS₂液体中,其目的是___________ (写两点)。
(4)KSCN 溶液的制备:实验开始时打开K₁,加热装置A、D,待三颈烧瓶内液体不分层后,熄灭装置A处的酒精灯,关闭K₁,移开水浴。将装置B继续加热至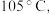 待 NH₄HS 完全分解后(
待 NH₄HS 完全分解后(  打开 K₂,缓缓滴入适量的)
打开 K₂,缓缓滴入适量的)  溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是
溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是___________ 。
(5)尾气处理:装置C 中仪器a的名称是___________ ,酸性Fe₂(SO₄)₃溶液用于除去尾气中两种污染性气体,其中一种气体M能使酚酞溶液变红,另一种气体N能使溶液产生淡黄色沉淀,写出除去气体N的离子方程式___________ 。
(6)过滤装置C中吸收尾气后的悬浊液,得到滤液x。取少量滤液x进行如图实验[已知 (白色)]:
(白色)]:___________ [可供选择的试剂: 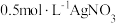 溶液、
溶液、 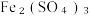 溶液、
溶液、 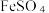 溶液、
溶液、  溶液]。
溶液]。

(2)装置A用于实验室制备氨气,反应的化学方程式为
(3)装置B中,三颈烧瓶内盛放有 CS₂、水和固体催化剂,通入氨气的导管口需要浸没在 CS₂液体中,其目的是
(4)KSCN 溶液的制备:实验开始时打开K₁,加热装置A、D,待三颈烧瓶内液体不分层后,熄灭装置A处的酒精灯,关闭K₁,移开水浴。将装置B继续加热至
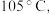 待 NH₄HS 完全分解后(
待 NH₄HS 完全分解后(  打开 K₂,缓缓滴入适量的)
打开 K₂,缓缓滴入适量的)  溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是
溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是(5)尾气处理:装置C 中仪器a的名称是
(6)过滤装置C中吸收尾气后的悬浊液,得到滤液x。取少量滤液x进行如图实验[已知
 (白色)]:
(白色)]: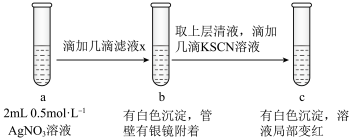
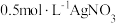 溶液、
溶液、 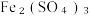 溶液、
溶液、 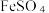 溶液、
溶液、  溶液]。
溶液]。
您最近一年使用:0次
2024-04-16更新
|
262次组卷
|
2卷引用:山东省青岛39中(海大附中)2023-2024学年高一下学期6月阶段性检测化学试题
名校
解题方法
9 .  溶液在工业上用于蚀刻铜箔电路板。从蚀刻后的废液中可回收铜并使蚀刻液再生,流程如图所示:
溶液在工业上用于蚀刻铜箔电路板。从蚀刻后的废液中可回收铜并使蚀刻液再生,流程如图所示: 溶液蚀刻铜箔的反应的离子方程式
溶液蚀刻铜箔的反应的离子方程式_____ 。
(2)从固体中分离出铜,试剂X是_____ 。
(3)若要使滤液再生为蚀刻液,可加入_____ 。
 溶液在工业上用于蚀刻铜箔电路板。从蚀刻后的废液中可回收铜并使蚀刻液再生,流程如图所示:
溶液在工业上用于蚀刻铜箔电路板。从蚀刻后的废液中可回收铜并使蚀刻液再生,流程如图所示: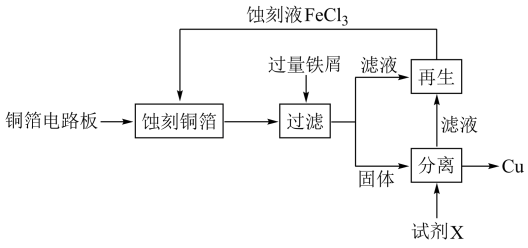
 溶液蚀刻铜箔的反应的离子方程式
溶液蚀刻铜箔的反应的离子方程式(2)从固体中分离出铜,试剂X是
(3)若要使滤液再生为蚀刻液,可加入
您最近一年使用:0次
解题方法
10 . 利用硫酸烧渣(主要含Fe2O3、FeO,还含有SiO2和CuO等)来制取FeSO4溶液。
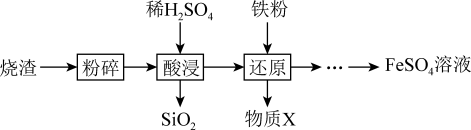
(1)“酸浸”时,Fe2O3发生反应的离子方程式是_______ 。
(2)“还原”时,铁粉将Fe3+、Cu2+还原为Fe2+和Cu。检验Fe3+是否已全部被还原,所选用试剂的化学式是______ 。
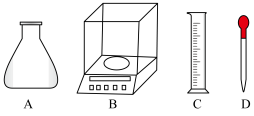
(3)实验室测定FeSO4溶液的浓度,常用K2Cr2O7标准溶液进行滴定。现称量2.940gK2Cr2O7(M=294g•mol-1)固体,配制成0.0100mol•L-1K2Cr2O7标准溶液。
①称量时,需用到的仪器有_______ 。
②根据计算,选用的容量瓶规格应为______ 。
A.100mL B.250mL C.500mL D.1000mL
(4)将(2)得到的FeSO4溶液进行下列操作,测定其物质的量浓度:
步骤一:取10.00mLFeSO4溶液,将其稀释成100.00mL溶液。
步骤二:取25.00mL稀释后的溶液,向其中加入0.100mol•L-1酸性KMnO4溶液。恰好反应时,记下消耗KMnO4溶液的体积。
步骤三:重复上述实验3次,平均消耗KMnO4溶液20.00mL。
已知:MnO +5Fe2++8H+=Mn2++5Fe3++4H2O
+5Fe2++8H+=Mn2++5Fe3++4H2O
①“步骤一”中稀释时所用的水需先进行加热煮沸,其目的是_______ 。
②试通过计算,求原FeSO4溶液的物质的量浓度是多少_______ ?(写出计算过程)

(1)“酸浸”时,Fe2O3发生反应的离子方程式是
(2)“还原”时,铁粉将Fe3+、Cu2+还原为Fe2+和Cu。检验Fe3+是否已全部被还原,所选用试剂的化学式是
(3)实验室测定FeSO4溶液的浓度,常用K2Cr2O7标准溶液进行滴定。现称量2.940gK2Cr2O7(M=294g•mol-1)固体,配制成0.0100mol•L-1K2Cr2O7标准溶液。
①称量时,需用到的仪器有

②根据计算,选用的容量瓶规格应为
A.100mL B.250mL C.500mL D.1000mL
(4)将(2)得到的FeSO4溶液进行下列操作,测定其物质的量浓度:
步骤一:取10.00mLFeSO4溶液,将其稀释成100.00mL溶液。
步骤二:取25.00mL稀释后的溶液,向其中加入0.100mol•L-1酸性KMnO4溶液。恰好反应时,记下消耗KMnO4溶液的体积。
步骤三:重复上述实验3次,平均消耗KMnO4溶液20.00mL。
已知:MnO
 +5Fe2++8H+=Mn2++5Fe3++4H2O
+5Fe2++8H+=Mn2++5Fe3++4H2O①“步骤一”中稀释时所用的水需先进行加热煮沸,其目的是
②试通过计算,求原FeSO4溶液的物质的量浓度是多少
您最近一年使用:0次




