1 . 制备摩尔盐【 】的实验中,需对过滤出产品的母液【
】的实验中,需对过滤出产品的母液【 、
、 、
、 的混合溶液,
的混合溶液,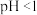 】进行处理。常温下,分别取母液并向其中加入指定物质,反应后溶液中主要存在的一组离子正确的是
】进行处理。常温下,分别取母液并向其中加入指定物质,反应后溶液中主要存在的一组离子正确的是
 】的实验中,需对过滤出产品的母液【
】的实验中,需对过滤出产品的母液【 、
、 、
、 的混合溶液,
的混合溶液,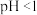 】进行处理。常温下,分别取母液并向其中加入指定物质,反应后溶液中主要存在的一组离子正确的是
】进行处理。常温下,分别取母液并向其中加入指定物质,反应后溶液中主要存在的一组离子正确的是A.通入过量 : : 、 、 、 、 、 、 、 、 |
B.加入少量NaClO溶液: 、 、 、 、 、 、 、 、 |
C.加入过量NaOH溶液: 、 、 、 、 、 、 、 、 |
D.加入过量NaClO和NaOH的混合溶液: 、 、 、 、 、 、 、 、 |
您最近一年使用:0次
2022-12-08更新
|
510次组卷
|
75卷引用:2018版化学(苏教版)高考总复习对接高考精练--电解质 离子反应
2018版化学(苏教版)高考总复习对接高考精练--电解质 离子反应2017-2018学年第一学期期末复习备考之精准复习模拟题高三化学(单科)(C卷)(已下线)《考前20天终极攻略》-5月20日 离子共存和离子方程式(已下线)解密04 离子反应——备战2018年高考化学之高频考点解密 张燕(已下线)学科网2019年高考化学一轮复习讲练测 2.2 离子反应 离子共存及检验 练(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化 第2讲 离子反应和离子方程式【教学案】(已下线)2019届高考热点题型和提分秘籍 第二章 化学物质及其变化 第2讲 离子反应 (教学案)(已下线)2019高考备考二轮复习精品资料-专题4 离子反应(教学案)2019年秋高三化学复习强化练习—— 离子反应方程式及离子共存2020届高三化学大二轮增分强化练——离子共存(已下线)【新东方】2020-772020届浙江省杭州学军中学高三教学质量监测卷化学试题(已下线)解密04 离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密04 离子反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)2016年全国普通高等学校招生统一考试化学(江苏卷精编版)2017届河北沧州市第一中学高三上学期第一次月考化学试题2017届河南省灵宝市第一高级中学高三上学期9月月考化学试卷2017届湖北省荆州中学高三上学期8月摸底化学试卷2017届湖北省沙市中学高三上学期第二次考试化学试卷2017届四川省龙泉中学、温江中学等五校高三上第一次联考化学卷2017届内蒙古临河区巴彦淖尔一中高三上9月月考化学卷2017届湖北省襄阳市四校高三上学期期中化学试卷山西省运城市2017届高三4月模拟调研测试理科综合化学试题山西省怀仁县第一中学2016-2017学年高一下学期期中考试化学试题广西南宁市第三中学2016-2017学年高一下学期期中考试(理)化学试题安徽省师范大学附属中学2016-2017学年高一下学期期末考试化学试题河南省安阳市第二中学2016-2017学年高二下学期期末考试化学试题内蒙古集宁一中(东校区)2016-2017学年高二下学期期末考试化学试题新疆生产建设兵团第二中学2016-2017学年高二下学期第四次月考化学试题河北省定州中学2018届高三(承智班)上学期第一次调研化学试题贵州省遵义航天高级中学2018届高三第二次模拟(10月)理科综合化学试题安徽省六安市第一中学2018届高三上学期第三次月考化学试题四川省南充高级中学2018届高三上学期第四次检测理综化学试题广西桂林市第十八中学2017-2018学年高一下学期开学考试化学试题【全国百强校】河北省辛集中学2017-2018学年高二6月月考化学试题广东省蓝精灵中学2018-2019学年高二上学期联考化学试题四川省成都市七中实验学校2019届高三上学期10月月考化学试题安徽省白泽湖中学2017届高三上学期期中考试化学试题【全国百强校】江西省上高县第二中学2019届高三上学期第三次月考化学试题山东省商河市第一中学2019届高三上学期11月月考理科综合化学试题【全国百强校】河南省实验中学2019届高三上学期质量预测模拟(三)化学试题2016年全国普通高等学校招生统一考试化学(江苏卷参考版)【全国百强校】江苏省海安高级中学2018-2019学年高一6月月考化学试题江苏省海安高级中学2019-2020学年高二上学期入学考试化学试题四川省棠湖中学2019-2020学年高二上学期开学考试化学试题内蒙古包头稀土高新区二中2020届高三10月月考理综化学试题贵州省罗甸县第一中学2019-2020学年高三上学期期末考试理综化学试题云南省玉溪市新平县一中2019-2020学年高三上学期1月月考理综化学试题河北省邯郸市第一中学2019-2020学年高一下学期第一次网上月考化学试题河北省承德市第一中学2019-2020学年高二下学期3月疫情期间直播课堂检测化学试题安徽省马鞍山市2020届高考第二次模拟理综化学试题四川省宜宾市第四中学2021届高三上学期开学考试理综化学试题鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第4节 离子反应 课时1 离子反应发生的条件广西桂林市第十八中学2021届高三上学期第二次月考理科综合化学试题(已下线)湖南省湘潭县一中、双峰一中、邵东一中、永州四中2018-2019学年高一下学期优生联考化学试题(已下线)解密04 离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密04 离子反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)考点04 离子反应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题01 物质及其变化-2023年高考化学一轮复习小题多维练(全国通用)(已下线)易错点03 离子反应-备战2023年高考化学考试易错题(已下线)考点04 离子反应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)山西省太原市第五中学校2021-2022学年高三上学期9月月考化学试题江西省宁冈中学2021-2022学年高一上学期开学考试化学试题湖南省隆回县第二中学2021-2022学年高三上学期第四次月考化学试题湖南省常德市桃源县第一中学2022-2023学年高三上学期9月月考化学试题河南省南阳市2022-2023学年高三上学期期中质量评估化学试题上海财经大学附属中学2022-2023学年高二上学期期中考试化学试题重庆市长寿中学校2022-2023学年高三上学期期中考试化学试题江苏省南京师范大学附属中学2022-2023学年高一上学期12月月考化学试题河南省许昌市高级中学2022-2023学年高三上半年第一次模拟考试化学试题河南省南阳市2022-2023学年高三上学期11月期中考试化学试题上海市金山中学2022-2023学年高二下学期期末考试(等级)化学试题山西大学附属中学校2023-2024学年高一上学期12月模块诊断化学试卷四川省射洪中学校2023-2024学年高一(强基班)上学期第三次月考化学试题江苏省南京师范大学附属中学2023-2024学年高一上学期1月期末化学试题
11-12高三上·浙江绍兴·期中
名校
2 . 下列过程中,最终的白色沉淀物不一定是BaSO4的是
A.Fe(NO3)2溶液 白色沉淀 白色沉淀 |
B.Ba(NO3)2溶液 白色沉淀 白色沉淀 |
C.无色溶液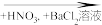 白色沉淀 白色沉淀 |
D.无色溶液 无色溶液 无色溶液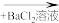 白色沉淀 白色沉淀 |
您最近一年使用:0次
2022-02-18更新
|
1102次组卷
|
30卷引用:2012届浙江省绍兴一中高三上学期期中考试化学试卷
(已下线)2012届浙江省绍兴一中高三上学期期中考试化学试卷(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第3讲 硫及其化合物【教学案】(已下线)2019年8月25日 《每日一题》2020年高考一轮复习—— 每周一测(已下线)考点07 元素化合物综合——《备战2020年高考精选考点专项突破题集》2020届高三化学一轮复习 化学基础实验(选择题和大题训练)(已下线)第15讲 硫及其化合物(精讲)——2021年高考化学一轮复习讲练测(已下线)考点11 硫及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)2012届江西省吉安一中高三上学期期中考试化学试卷甘肃省武威第一中学2018-2019学年高一下学期第一次阶段测试化学试题2019年广东省清远市高三上学期期末调研考试化学试题上海市南洋模范中学2020—2021学年高二上学期开学考试化学(等级考)试题陕西省西北工业大学附属中学2018-2019学年高一上学期期末考试化学试题(已下线)第13讲 硫及其化合物(精讲)-2022年一轮复习讲练测(已下线)考点11 硫及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)第11讲 硫及其化合物(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第13讲 硫及其化合物(讲)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第11讲 硫及其化合物(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第11讲 硫及其化合物(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第2讲 离子反应和离子方程式(已下线)第4讲 浓硫酸 不同价态含硫物质的转化云南省玉溪市一中2020-2021学年高一下学期第一次月考化学试题山东省临沂市临沂第二十四中学2020-2021学年高一下学期期中考试化学试题广东省肇庆市高要区第二中学2020-2021学年高一下学期段考(二)化学试题四川省遂宁市射洪中学2021-2022学年高一上学期第三次(12月)月考(强基班)化学试题(已下线)上海市华东师范大学第二附属中学2021-2022学年高一下学期3月阶段反馈化学试题新疆哈密市第八中学2021-2022学年高一下学期期末考试化学试题贵州省松桃民族中学2022-2023学年高一下学期3月月考化学试题(已下线)专题03 硫酸和硝酸专讲(专题过关)-2022-2023学年高一化学下学期期中期末考点大串讲(人教版2019必修第二册)云南省开远市第一中学校2022-2023学年高一下学期3月月考化学试题黑龙江省齐齐哈尔市恒昌中学校2022-2023学年高一下学期4月月考化学试题
20-21高二上·上海黄浦·期中
名校
解题方法
3 . 下列事实不能证明Fe3+有氧化性的是
| A.电子工业上用FeCl3溶液腐蚀电路板上的铜 |
| B.将KSCN溶液加入FeCl3溶液中,溶液变为血红色 |
| C.FeCl3溶液滴在淀粉-KI试纸上,试纸变为蓝色 |
| D.将H2S气体通入FeCl3溶液中,产生淡黄色沉淀 |
您最近一年使用:0次
2021-10-21更新
|
684次组卷
|
8卷引用:考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)
(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)上海市黄浦区大同中学2020-2021学年高二上学期期中考试化学试题(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点10 铁及其重要化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)9.2 探究铁及其化合物的转化 练习-2020-2021学年下学期高一化学同步精品课堂(苏教版2019必修第二册)辽宁省朝阳育英高考补习学校2022届高三10月月考化学试题河南省平顶山市龙河实验高级中学2021-2022学年高一上学期12月月考化学试题云南省大理市黄冈实验中学2021-2022学年高一上学期12月月考化学试题
4 . 某同学为检验溶液中是否含有常见的四种离子,进行了如图操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。下列结论正确的是
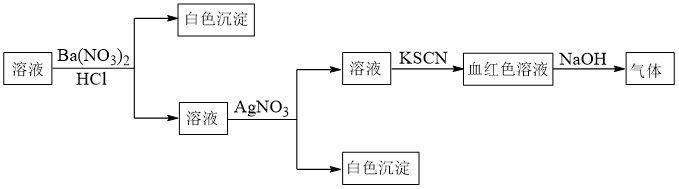

A.原溶液中一定含有 | B.原溶液中一定含有 |
C.原溶液中一定含有 | D.原溶液中一定含有 |
您最近一年使用:0次
2021-10-14更新
|
3276次组卷
|
76卷引用:考点04 离子反应——备战2019年浙江新高考化学考点
(已下线)考点04 离子反应——备战2019年浙江新高考化学考点(已下线)学军中学2009学年高三第二次月考化学试题(已下线)绍兴一中2009—2010学年第一学期高三期末调测化学试题(已下线)2014高考名师推荐化学物质的检验(已下线)2014届浙江省衢州第二中学高三上学期期中考试化学试卷2019届高三化学一轮练习卷:离子的检验与推断【校级联考】浙江省金丽衢十二校2019届高三上学期第二次联考化学试题(已下线)【新东方】高中化学1292019年秋高三化学复习强化练习—— 离子反应方程式及离子共存2020届高三化学大二轮增分强化练——离子共存的推断(真题强化练)2020届高三化学二轮微专题突破训练:物质的检验、分离与提纯(已下线)2010—2011学年黑龙江大庆铁人中学高一下学期期中考试化学试卷(已下线)2012届内蒙古巴市一中高三上学期10月月考化学试卷(已下线)2011-2012学年贵州省遵义四中高一上学期期末检测化学试卷(已下线)2011-2012学年上海理工大学附属中学高二上学期选修摸底考试化学试卷(已下线)2012-2013学年山东省济宁市泗水一中高一上学期期末模拟化学试卷(已下线)2013届河北省冀州中学高三一轮检测化学试卷(已下线)2013-2014黑龙江省大庆铁人中学高一4月月考化学试卷2016届陕西省西安中学高三上学期第四次质检化学试卷12016届上海市理工大附中高三上学期11月月考化学试卷2017届江西省上高二中高三上第一次月考(开学考试)化学2016-2017学年河北省邯郸市大名县第一中学高一3月月考化学试卷湖北省宜昌市示范高中协作体2016-2017学年高一下学期期中联考化学试题福建省福州市八县(市)协作校2018届高三上学期期中联考化学试题黑龙江省齐齐哈尔市实验中学2018届高三上学期期中考试化学试题山东省菏泽第一中学2017-2018学年高一12月月考化学试题【全国百强校】山东省师范大学附属中学2017-2018学年高一上学期第二次学分认定(期末)考试化学试题【全国百强校】辽宁省大连市辽宁师范大学附属中学2019届高三上学期第一次考试化学试题【全国百强校】山东省泰安市新泰市第一中学2018-2019学年高一上学期第二次质量检测化学试题福建省晋江市季延中学2018-2019学年高一下学期期中考试化学试题陕西省山阳中学2018-2019学年高一下学期期中考试化学试题云南省绥江县一中2018-2019学年高一下学期期末考试化学试题云南省文山州马关县实验高中2019-2020学年高二上学期开学考试化学试题云南省昭通市巧家县二中2019-2020学年高一10月月考化学试题陕西省西安中学2020届高三上学期期中考试化学试题宁夏石嘴山市第三中学2020届高三上学期期中考试化学试题人教版高一化学必修1第一章《从实验学化学》测试卷人教版(2019)必修第二册第五章 综合拓展(已下线)上海市虹口区2012届高三4月(二模)质量监控测试化学试题鲁科版(2019)高一必修第一册第3章 物质的性质与转化 总结检测高一必修第二册(人教2019版)第五章 素养检测山东省胶州市实验中学2020-2021学年高一上学期12月月考化学试题福建省莆田第四中学2019-2020学年高一上学期期末考试化学试题(已下线)第28讲 物质的分离、提纯、检验与鉴别(练) — 2022年高考化学一轮复习讲练测(新教材新高考)鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第4节 离子反应(已下线)二轮专题强化练 专题18 物质检验、鉴别简单实验方案的设计及评价山东省济宁市邹城二中2020-2021学年高一下学期3月月考化学试题山东省郯城第二中学2020-2021学年下学期高一4月月考化学试题吉林省长白实验中学2020-2021学年高一下学期第一次月考化学试题山西省临汾市2020-2021学年高一下学期4月联考质量检测化学试题云南省玉溪市一中2020-2021学年高一下学期期中考试化学(理)试题黑龙江省鹤岗市第一中学2020-2021学年高一下学期期中考试化学试题吉林省松原市乾安七中2020-2021学年高二下学期第七次质量检测化学试题黑龙江省鹤岗市第一中学2020-2021学年高一下学期期末考试化学试题湖南省长沙市长郡中学2021-2022学年高二上学期入学考试化学试题广东省顶级名校2021-2022学年高二上学期入学考试化学试题福建省三明市第一中学2022届高三10月月考化学试题山东省泰安市2021-2022学年高一上学期期末考试化学试题(已下线)一轮巩固卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(辽宁专用)重庆市南华中学校2021-2022学年高一下学期3月月考化学试题山东省临沂第一中学2021-2022学年高一下学期第一次教学检测(线上)化学试题重庆南开中学2021-2022学年高一下学期4月第一次月考化学试题重庆市江津中学校2021-2022学年高一下学期第一阶段考试化学试题广东省汕头市金山中学2021-2022学年高一下学期期中考试化学试题福建省三明市第二中学2021-2022学年高一下学期第二阶段期中考试化学试题福建省泉州晋江市子江中学2022-2023学年高三8月月考化学试题黑龙江省双鸭山市第一中学2021-2022学年高一下学期期中考试化学试题黑龙江省牡丹江市第三高级中学2022-2023学年高三上学期第二次月考化学试题福建省连城县第一中学2022-2023学年高三上学期第一次月考化学试题江苏省苏州市常熟中学2022-2023学年高一上学期末测试卷一化学试题辽宁省辽河油田第二高级中学2022-2023学年高三上学期期末考试化学试题安徽省淮北市第一中学2022-2023学年高一下学期第二次月考化学试题贵州省松桃民族中学2022-2023学年高一下学期3月月考化学试题上海市虹口区2022~2023学年高三下学期二模测试化学试题广东省台山市华侨中学2022-2023学年高一下学期期中考试化学试题湖南省岳阳市湘阴县2022-2023学年高一下学期7月期末考试化学试题
17-18高一上·山西朔州·阶段练习
名校
解题方法
5 . 将1.12g铁粉加入到25mL2mol·L-1的氯化铁溶液中,充分反应后,其结果是
| A.铁粉剩余,溶液呈浅绿色,Cl-基本不变 |
| B.向溶液中滴入无色KSCN溶液,不显血红色 |
| C.氧化产物与还原产物的物质的量之比为2:5 |
| D.溶液中Fe2+与Fe3+物质的量之比为6:1 |
您最近一年使用:0次
2021-06-20更新
|
700次组卷
|
17卷引用:考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)
(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)山西省应县第一中学校2017-2018学年高一上学期月考(四)化学试题云南省盈江县第一高级中学2019-2020学年高一上学期期末考试化学试题云南省丽江市永胜县第二中学2019—2020学年高一上学期期末考试化学试题云南省昭通市彝良县第二中学2019—2020学年高一上学期期末考试化学试题云南省马关县第一中学校2020-2021学年高一上学期12月月考化学试题(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)专题六 铁及其化合物(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)江苏省镇江中学2020-2021学年高一下学期期中检测化学试题(已下线)3.1.2 铁盐和亚铁盐-2021-2022学年高一化学课后培优练(人教版2019必修第一册)云南省景东彝族自治县第一中学2021-2022学年高一下学期3月份考试化学试题云南省丘北县第一中学2021-2022学年高一下学期2月月考化学试题江苏省宿迁市泗阳县实验高级中学2021-2022学年高一下学期第二次质量调研化学试题上海市格致中学2021-2022学年高一下学期阶段性测试化学试题山西省太原市英才学校2021-2022学年高一上学期第二次月考化学试题云南省富宁县第一中学2021-2022学年高一下学期开学考试化学试题宁夏银川市贺兰县景博中学2022-2023学年高一上学期第二次月考化学试题
名校
解题方法
6 . 易拉罐的主要成分为铝合金,其中以铝铁合金和铝镁合金最为常见。为确定铝合金中金属的成分,现取几小块易拉罐碎片进行下列实验,其中实验方案、现象与结论均正确的是
| 选项 | 实验方案 | 现象与结论 |
| A | 加入盐酸 | 产生无色气体,含铝、铁、镁三种金属 |
| B | 加入NaOH溶液 | 有无色气体产生,含有镁、铝两种金属 |
| C | 加入盐酸后,向所得溶液中再加入少量NaOH溶液 | 产生白色沉淀,一定只含有镁 |
| D | 用盐酸溶解并放置一会儿后,加入KSCN溶液 | 溶液呈血红色,含有铁 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-06-06更新
|
1608次组卷
|
20卷引用:2018版化学(苏教版)高考总复习课时跟踪训练:从铝土矿到铝合金
2018版化学(苏教版)高考总复习课时跟踪训练:从铝土矿到铝合金(已下线)专题3.2 铝及其重要化合物(练)——2020年高考化学一轮复习讲练测(已下线)考点14 铝及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)2011届上海市闵行区高三上学期质量调研考试化学试卷甘肃省武威市第六中学2018届高三上学期第二次阶段性过关考试化学试题湖南省永州市祁阳县高考补习学校2018届高三上学期第二次月考化学试题陕西省西安市长安区第一中学2017-2018学年高一上学期第二次月考化学(实验班)试题福建省长泰县第一中学2020届高三上学期期初考试化学试题人教版(2019)高一必修第一册第三章 铁 金属材料 高考挑战区(苏教版2019)必修第二册专题9 金属与人类文明 C 高考挑战区(已下线)考点14 铝及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)3.2.1 合金-2021-2022学年高一化学课后培优练(人教版2019必修第一册)(已下线)易错专题24 铝及其化合物的两性特点-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)(已下线)专题03 铁 金属材料-2023年高考化学一轮复习小题多维练(全国通用)(已下线)新人教必修1第3章第二节第1课时金属材料与合金(课后)广东省梅州市2021-2022学年高一上学期期末考试化学试题(已下线)3.2.1金属材料-同步学习必备知识广东省广州市第一中学2022-2023学年高一上学期期末考试化学试题广东省广州市真光中学2023-2024学年高一上学期12月阶段性测试化学试题陕西省西安市西安区县联考2023-2024学年高一上学期1月期末化学试题
20-21高三上·河南·阶段练习
名校
解题方法
7 . 甘氨酸亚铁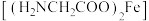 是浅黄褐绿色结晶粉末,易溶于水,难溶于乙醇,能改善缺铁性贫血,实验室合成路线如图所示(异抗坏血酸具有还原性)
是浅黄褐绿色结晶粉末,易溶于水,难溶于乙醇,能改善缺铁性贫血,实验室合成路线如图所示(异抗坏血酸具有还原性)

下列说法错误的是
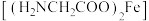 是浅黄褐绿色结晶粉末,易溶于水,难溶于乙醇,能改善缺铁性贫血,实验室合成路线如图所示(异抗坏血酸具有还原性)
是浅黄褐绿色结晶粉末,易溶于水,难溶于乙醇,能改善缺铁性贫血,实验室合成路线如图所示(异抗坏血酸具有还原性)
下列说法错误的是
| A.实验室若无异抗坏血酸试剂,可用维生素C替代 |
| B.步骤Ⅱ若pH过高,甘氨酸中的氨基会发生反应 |
| C.步骤Ⅲ加入乙醇能降低甘氨酸亚铁在水中的溶解度,有利于结晶析出 |
| D.步骤Ⅳ所用到的玻璃仪器有酒精灯、烧杯、玻璃棒、漏斗 |
您最近一年使用:0次
2021-01-05更新
|
716次组卷
|
5卷引用:考点30 物质的分离、提纯和检验-备战2022年高考化学一轮复习考点帮(浙江专用)
(已下线)考点30 物质的分离、提纯和检验-备战2022年高考化学一轮复习考点帮(浙江专用)河南省九师联盟2021届高三上学期12月联考化学试题(已下线)考点30 物质的分离、提纯和检验-备战2022年高考化学一轮复习考点帮(全国通用)湖北省荆州中学2021-2022学年高三上学期期末考试化学试题武汉市第一中学2021-2022学年高三上学期10月月考化学试题
20-21高一上·浙江绍兴·阶段练习
8 . 铁粉和氧化铁粉末的混合物共32.8g,加入到200mL的盐酸中,固体完全溶解,得到标准状况下4.48L氢气。经测定,反应后的溶液中c(H+)为0.5mol/L,反应后的溶液中加入KSCN不变红(忽略反应前后溶液体积变化)。请计算:
(1)反应中放出氢气的质量为__ 。
(2)原混合物中铁和氧化铁的物质的量之比为__ 。
(3)原盐酸的物质的量浓度为_ mol/L。
(1)反应中放出氢气的质量为
(2)原混合物中铁和氧化铁的物质的量之比为
(3)原盐酸的物质的量浓度为
您最近一年使用:0次
20-21高三上·辽宁大连·阶段练习
名校
解题方法
9 . 下列各组澄清溶液中的离子能大量共存,且加入试剂后发生反应的离子方程式书写正确的是
| 选项 | 离子 | 试剂 | 离子方程式 |
| A | NH 、Na+、Fe3+、S2- 、Na+、Fe3+、S2- | 少量铜粉 | 2Fe3++Cu=2Fe2++Cu2+ |
| B | NH 、Fe3+、Br-、SO 、Fe3+、Br-、SO | 过量Na2S | 2Fe3++S2-=2Fe2++S↓ |
| C | K+、Na+、ClO-、SO | 足量SO2 | SO2+2ClO-+H2O=SO +2HClO +2HClO |
| D | K+、Na+、CO 、AlO 、AlO | 少量HCl | H++AlO +H2O=Al(OH)3↓ +H2O=Al(OH)3↓ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-12-15更新
|
1381次组卷
|
5卷引用:解密04 离子反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)
(已下线)解密04 离子反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)辽宁省大连市一〇三中学2021届高三上学期第二阶段模拟考试化学试题(已下线)解密04 离子反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)课时06 与量有关的离子方程式书写-2022年高考化学一轮复习小题多维练(全国通用)河南省洛阳市第四十三中学2022届高三上学期开学考试化学试题
10 . 水泥是重要的建筑材料,硅酸盐水泥主要为硅酸二钙(2CaO·SiO2)、硅酸三钙(3CaO ·SiO2)、铝酸三钙(3CaO·Al2O3)。铁铝酸四钙(4CaO·Al2O3·Fe2O3)和氧化镁等的混合物。《水泥化学分析方法》中用EDTA(一种常用作滴定金属离子含量的有机物)滴定法测定水泥样品中钙、镁的含量。其过程如图所示:
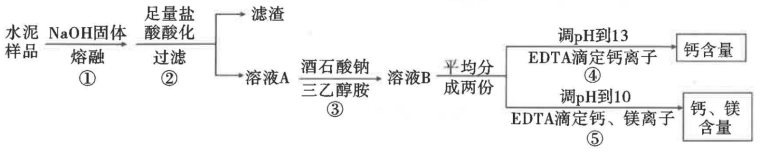
已知:相关金属离子浓度为0.1mol/L时,形成氢氧化物沉淀的pH范围如表:
回答下列问题:
(1)工业制水泥的主要原料是黏土和______ (填名称)。
(2)步骤①中选择用银坩埚而不用瓷坩埚,其理由是_____ .滤渣的主要成分为_____ 。(填化学式)。
(3)步骤③中加入的酒石酸钠和三乙醇胺作为掩蔽剂,可掩蔽杂质离子的干扰,在该过程中,主要掩蔽的离子有_____ 。 掩蔽剂需要在调pH前加入,若在碱性溶液中则起不到掩蔽作用,试从要掩蔽的离子性质分析原因:_______ 。
(4)步骤④和⑤中,调pH时,最好选用试剂_____ (填序号)。
A.氨水 B. MgO C. CaCO3
(5)水泥样品中的钙的含量通过步骤④滴定结果可计算得出;而步骤⑤滴定的是钙、镁总量,所以测定镁的含量准确性还依赖于步骤④。当溶液pH大于12时,会生成硅酸钙沉淀,所以若滴定前,溶液中还有少量的硅酸,则需加入适量氟化钾,以消除硅酸的干扰。若未加氟化钾,残留的硅酸会使镁含量测定结果______ (填“偏高”“偏低”或“无影响”)。
(6)镁含量的测定还受水泥试样中一氧化锰含量的影响,当一氧化锰含量小于0.5%时,干扰不明显,可忽略不计;但大于0.5%时,还需要再测出一氧化锰含量。一氧化锰的测定是在硫酸介质中,用高碘酸钾将其氧化为高锰酸根离子,进行测量。写出该过程中反应的离子方程式:______ (该反应中的一种产物可以作为食盐的添加剂)。

已知:相关金属离子浓度为0.1mol/L时,形成氢氧化物沉淀的pH范围如表:
| 金属离子 | Mg2+ | Ca2+ | Al3+ | Fe3+ |
| 开始沉淀的pH | 11 | 13.5 | 3.5 | 2 |
| 完全沉淀的pH | 13 | >14 | 4.5 | 3.5 |
(1)工业制水泥的主要原料是黏土和
(2)步骤①中选择用银坩埚而不用瓷坩埚,其理由是
(3)步骤③中加入的酒石酸钠和三乙醇胺作为掩蔽剂,可掩蔽杂质离子的干扰,在该过程中,主要掩蔽的离子有
(4)步骤④和⑤中,调pH时,最好选用试剂
A.氨水 B. MgO C. CaCO3
(5)水泥样品中的钙的含量通过步骤④滴定结果可计算得出;而步骤⑤滴定的是钙、镁总量,所以测定镁的含量准确性还依赖于步骤④。当溶液pH大于12时,会生成硅酸钙沉淀,所以若滴定前,溶液中还有少量的硅酸,则需加入适量氟化钾,以消除硅酸的干扰。若未加氟化钾,残留的硅酸会使镁含量测定结果
(6)镁含量的测定还受水泥试样中一氧化锰含量的影响,当一氧化锰含量小于0.5%时,干扰不明显,可忽略不计;但大于0.5%时,还需要再测出一氧化锰含量。一氧化锰的测定是在硫酸介质中,用高碘酸钾将其氧化为高锰酸根离子,进行测量。写出该过程中反应的离子方程式:
您最近一年使用:0次
2020-12-13更新
|
1028次组卷
|
7卷引用:考点10 碳、硅及其无机非金属材料-备战2022年高考化学一轮复习考点帮(浙江专用)
(已下线)考点10 碳、硅及其无机非金属材料-备战2022年高考化学一轮复习考点帮(浙江专用)云南师范大学附属中学2021届高三高考适应性月考(四)理综化学试题(已下线)培优09 除杂提纯类工业流程(提高练)-2021年高考化学大题培优练(新高考地区专用)(已下线)大题02 化学工艺流程题(二)-【考前抓大题】备战2021年高考化学(全国通用)(已下线)考点10 碳、硅及其无机非金属材料-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点12 硅及其无机非金属材料-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点12 硅及其无机非金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)



