名校
1 . 硫酸亚铁广泛应用于临床医疗,主要用于治疗各种因素导致的缺铁性贫血,如慢性失血、营养不良等,同时也可以治疗铁吸收障碍、儿童或婴儿期需铁量增加等因素引起的缺铁性贫血。絮凝剂聚合氯化铝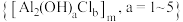 广泛用于废水处理。利用马矿的矿渣(成分为
广泛用于废水处理。利用马矿的矿渣(成分为 、
、 、
、 、
、 )制备绿矾(
)制备绿矾( )和聚合氯化铝的一种工艺流程如下:
)和聚合氯化铝的一种工艺流程如下:
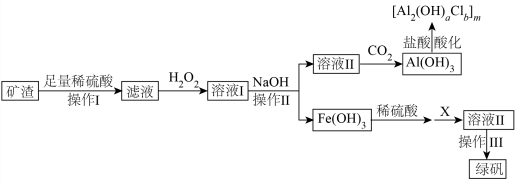
已知: 不溶于稀硫酸;硫酸铝和过量
不溶于稀硫酸;硫酸铝和过量 溶液反应生成
溶液反应生成 ;
; 的絮凝效果可用盐基度(盐基度
的絮凝效果可用盐基度(盐基度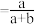 )衡量,当盐基度为0.60~0.85时,絮凝效果较好。
)衡量,当盐基度为0.60~0.85时,絮凝效果较好。
回答下列问题:
(1)操作I的名称是___________ ,需用到的玻璃仪器有___________ 。
(2)“滤液”中加入 发生的离子反应方程式是
发生的离子反应方程式是___________ ,发生该反应时可适当加热加快反应速率,但加热温度不宜过高,原因是___________ 。
(3)“溶液Ⅱ”若浓度较大,则通入过量 (
( 过量时,生成
过量时,生成 )不利于减少
)不利于减少 滤饼中的杂质,其原因是
滤饼中的杂质,其原因是___________ 。
(4)试剂“X”是___________ ,书写试剂“X”参与的化学反应方程式___________ 。
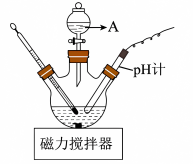
(5)“盐酸酸化”时的装置如图所示,仪器A的名称为___________ ,若要使产品盐基度为 ,则
,则
___________ 。
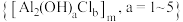 广泛用于废水处理。利用马矿的矿渣(成分为
广泛用于废水处理。利用马矿的矿渣(成分为 、
、 、
、 、
、 )制备绿矾(
)制备绿矾( )和聚合氯化铝的一种工艺流程如下:
)和聚合氯化铝的一种工艺流程如下:
已知:
 不溶于稀硫酸;硫酸铝和过量
不溶于稀硫酸;硫酸铝和过量 溶液反应生成
溶液反应生成 ;
; 的絮凝效果可用盐基度(盐基度
的絮凝效果可用盐基度(盐基度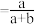 )衡量,当盐基度为0.60~0.85时,絮凝效果较好。
)衡量,当盐基度为0.60~0.85时,絮凝效果较好。回答下列问题:
(1)操作I的名称是
(2)“滤液”中加入
 发生的离子反应方程式是
发生的离子反应方程式是(3)“溶液Ⅱ”若浓度较大,则通入过量
 (
( 过量时,生成
过量时,生成 )不利于减少
)不利于减少 滤饼中的杂质,其原因是
滤饼中的杂质,其原因是(4)试剂“X”是
(5)“盐酸酸化”时的装置如图所示,仪器A的名称为
 ,则
,则

您最近半年使用:0次
名校
解题方法
2 . 向 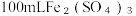 和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中剩余固体的质量与加入铁粉的质量如图所示。(忽略溶液体积的变化)
和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中剩余固体的质量与加入铁粉的质量如图所示。(忽略溶液体积的变化)
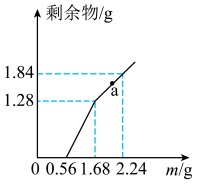
(1)加入少量铁粉时,发生的离子反应______________ 。
(2)原溶液中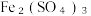 和CuSO4的物质的量之比为
和CuSO4的物质的量之比为_______ 。
(3)a点时溶液中溶质的物质的量浓度为____________ 。
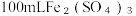 和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中剩余固体的质量与加入铁粉的质量如图所示。(忽略溶液体积的变化)
和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中剩余固体的质量与加入铁粉的质量如图所示。(忽略溶液体积的变化)
(1)加入少量铁粉时,发生的离子反应
(2)原溶液中
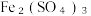 和CuSO4的物质的量之比为
和CuSO4的物质的量之比为(3)a点时溶液中溶质的物质的量浓度为
您最近半年使用:0次
解题方法
3 . 纳米铁是一种黑色粉末,可用于制作高密度磁性材料。以铁屑(含少量 杂质)为原料制备纳米铁粉流程如下:
杂质)为原料制备纳米铁粉流程如下:
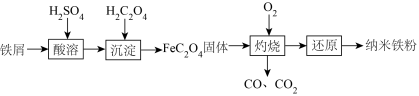
已知:草酸( )是一种二元酸
)是一种二元酸
(1)取少量产品分散于水中,___________ (填操作步骤),可验证所得铁粉直径是否为纳米级。
(2)写出“酸溶”时氧化还原反应的离子方程式:___________ 、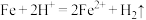 。
。
(3)若加入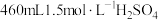 时,铁屑与
时,铁屑与 恰好完全反应,为了使
恰好完全反应,为了使 元素完全转化,则沉淀过程中加入
元素完全转化,则沉淀过程中加入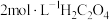 的体积至少为
的体积至少为___________  。
。
(4) 固体经灼烧后得到红棕色固体和
固体经灼烧后得到红棕色固体和 、
、 混合气体,若产物中
混合气体,若产物中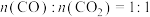 ,则“灼烧”过程中发生反应的化学方程式为
,则“灼烧”过程中发生反应的化学方程式为___________ 。
(5)纳米铁粉可用于处理含氧酸性废水中的 ,反应原理如图所示。
,反应原理如图所示。
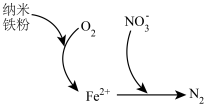
①该过程中体现了纳米铁粉的___________ 性(填“氧化”或“还原”)。
②在铁粉总量一定的条件下,废水中的溶解氧过多不利于 的去除,原因是
的去除,原因是___________ 。
 杂质)为原料制备纳米铁粉流程如下:
杂质)为原料制备纳米铁粉流程如下:
已知:草酸(
 )是一种二元酸
)是一种二元酸(1)取少量产品分散于水中,
(2)写出“酸溶”时氧化还原反应的离子方程式:
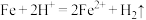 。
。(3)若加入
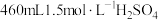 时,铁屑与
时,铁屑与 恰好完全反应,为了使
恰好完全反应,为了使 元素完全转化,则沉淀过程中加入
元素完全转化,则沉淀过程中加入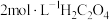 的体积至少为
的体积至少为 。
。(4)
 固体经灼烧后得到红棕色固体和
固体经灼烧后得到红棕色固体和 、
、 混合气体,若产物中
混合气体,若产物中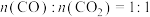 ,则“灼烧”过程中发生反应的化学方程式为
,则“灼烧”过程中发生反应的化学方程式为(5)纳米铁粉可用于处理含氧酸性废水中的
 ,反应原理如图所示。
,反应原理如图所示。
①该过程中体现了纳米铁粉的
②在铁粉总量一定的条件下,废水中的溶解氧过多不利于
 的去除,原因是
的去除,原因是
您最近半年使用:0次
2023高三·全国·专题练习
解题方法
4 . 以硫酸渣(含Fe2O3、SiO2等)为原料制备铁黄(FeOOH)的一种工艺流程如图:
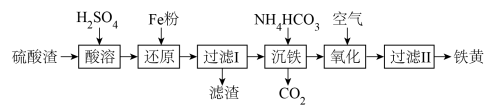
(1)“酸溶”中加快溶解的方法为_______ (任意写出一种)。
(2)“还原”过程中的离子方程式为_______ 。
(3)写出“滤渣”中主要成分的化学式:_______ 。
(4)①“沉铁”过程中生成Fe(OH)2的化学方程式为_______ 。
②若用CaCO3“沉铁”,则生成FeCO3沉淀。当反应完成时,溶液中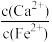 =
=_______ 。[已知Ksp(CaCO3)=2.8×10-9,Ksp(FeCO3)=2×10-11]
(5)“氧化”时,用NaNO2浓溶液代替空气氧化Fe(OH)2浆液,能缩短氧化时间,但缺点是_______ 。

(1)“酸溶”中加快溶解的方法为
(2)“还原”过程中的离子方程式为
(3)写出“滤渣”中主要成分的化学式:
(4)①“沉铁”过程中生成Fe(OH)2的化学方程式为
②若用CaCO3“沉铁”,则生成FeCO3沉淀。当反应完成时,溶液中
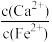 =
=(5)“氧化”时,用NaNO2浓溶液代替空气氧化Fe(OH)2浆液,能缩短氧化时间,但缺点是
您最近半年使用:0次
5 . 铁在冷的稀硝酸中反应的主要还原产物为NO,而在热的稀硝酸中反应其主要还原产物为 ,当溶液更稀主要还原产物为
,当溶液更稀主要还原产物为 ,现向一定量的冷的稀硝酸中逐渐加入铁,如图为反应液中
,现向一定量的冷的稀硝酸中逐渐加入铁,如图为反应液中 的浓度与产生的气体量随铁的物质的量的变化情况(假设在任一气体产生曲线段内只有一种还原产物),下列有关说法不正确的是(已知:
的浓度与产生的气体量随铁的物质的量的变化情况(假设在任一气体产生曲线段内只有一种还原产物),下列有关说法不正确的是(已知: )
)
 ,当溶液更稀主要还原产物为
,当溶液更稀主要还原产物为 ,现向一定量的冷的稀硝酸中逐渐加入铁,如图为反应液中
,现向一定量的冷的稀硝酸中逐渐加入铁,如图为反应液中 的浓度与产生的气体量随铁的物质的量的变化情况(假设在任一气体产生曲线段内只有一种还原产物),下列有关说法不正确的是(已知:
的浓度与产生的气体量随铁的物质的量的变化情况(假设在任一气体产生曲线段内只有一种还原产物),下列有关说法不正确的是(已知: )
)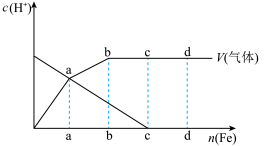
| A.若oa段与ab段铁的物质的量相等,则这两段所产生的气体的物质的量之比为2:1 |
B.bc段发生反应的离子方程式为: |
C.反应到达c点时,溶液中主要阳离子是 |
| D.若反应到达d点时反应完全结束,c、d两点对应的铁的物质的量之比为2:3 |
您最近半年使用:0次
解题方法
6 . 某红色粉末样品可能含有 和
和 中的一种或两种,为探究其组成,研究组同学取少量样品加入过量稀硫酸进行实验。(已知:
中的一种或两种,为探究其组成,研究组同学取少量样品加入过量稀硫酸进行实验。(已知: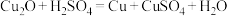 )下列有关说法正确的是
)下列有关说法正确的是
 和
和 中的一种或两种,为探究其组成,研究组同学取少量样品加入过量稀硫酸进行实验。(已知:
中的一种或两种,为探究其组成,研究组同学取少量样品加入过量稀硫酸进行实验。(已知: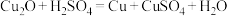 )下列有关说法正确的是
)下列有关说法正确的是A.若固体部分溶解,则样品中一定含有 ,一定不含有 ,一定不含有 |
B.若固体全部溶解,则发生的离子反应只有: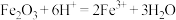 |
C.若固体全部溶解,再滴加KSCN溶液,溶液不变红,则样品中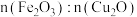 为2∶1 为2∶1 |
D.另取ag样品在空气中充分加热至质量不再变化,称其质量为bg(b>a),则混合物中 的质量分数为 的质量分数为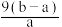 |
您最近半年使用:0次
名校
解题方法
7 . 黄铁矿烧渣(主要成分为Fe2O3、FeO、及少量FeS、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用黄铁矿烧渣为原料制备高档颜料—铁红(Fe2O3)(主要成分为Fe2O3不考虑其他杂质),并以铁红为原料制备硫酸亚铁晶体(FeSO4·7H2O)的工艺:
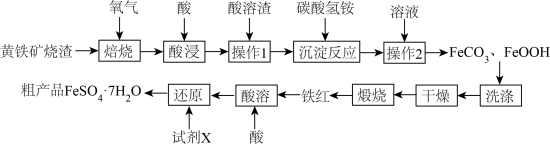
(1)焙烧的过程中采用如图所示的“多层逆流焙烧”,“多层逆流焙烧”的优点是_______ (任答两点)。

(2)“酸浸”时温度比较高,最适合的酸是_______ ,“酸溶渣”的成分是_______ 。
(3)“沉淀反应”中,生成FeCO3的离子方程式是_______ 。
(4)检验FeCO3是否洗涤干净的操作方法_______ 。
(5)从过滤后的滤液中得到产品,应进行的操作是_______ 、_______ 、过滤、洗涤、干燥。
(6)FeSO4·7H2O在医学上常用作补血剂。某课外小组通过以下实验方法测定某补血剂中亚铁离子的含量:
步骤I:取20片补血剂样品除去糖衣、研磨、溶解、过滤,将滤液配成250mL溶液。
步骤Ⅱ:取上述溶液25mL于锥形瓶中,加入少量稀硫酸酸化后,逐渐滴加0.0200 mol/L的KMnO4溶液,至恰好完全反应,记录消耗的KMnO4溶液的体积(假定药品中其他成分不与KMnO4反应,且 )。
)。
步骤Ⅲ:重复“步骤II”2-3次,平均消耗KMnO4溶液10.00mL。
①步骤I中配制溶液时需要的玻璃仪器除烧杯、量筒,玻璃棒外,还需要_______ 、_______ 。
②该补血剂中亚铁离子的含量为_______ mg/片。

(1)焙烧的过程中采用如图所示的“多层逆流焙烧”,“多层逆流焙烧”的优点是

(2)“酸浸”时温度比较高,最适合的酸是
(3)“沉淀反应”中,生成FeCO3的离子方程式是
(4)检验FeCO3是否洗涤干净的操作方法
(5)从过滤后的滤液中得到产品,应进行的操作是
(6)FeSO4·7H2O在医学上常用作补血剂。某课外小组通过以下实验方法测定某补血剂中亚铁离子的含量:
步骤I:取20片补血剂样品除去糖衣、研磨、溶解、过滤,将滤液配成250mL溶液。
步骤Ⅱ:取上述溶液25mL于锥形瓶中,加入少量稀硫酸酸化后,逐渐滴加0.0200 mol/L的KMnO4溶液,至恰好完全反应,记录消耗的KMnO4溶液的体积(假定药品中其他成分不与KMnO4反应,且
 )。
)。步骤Ⅲ:重复“步骤II”2-3次,平均消耗KMnO4溶液10.00mL。
①步骤I中配制溶液时需要的玻璃仪器除烧杯、量筒,玻璃棒外,还需要
②该补血剂中亚铁离子的含量为
您最近半年使用:0次
2022-11-13更新
|
215次组卷
|
2卷引用:浙江省杭州地区(含周边)重点中学2022-2023学年高二上学期期中考试化学试题
解题方法
8 . 下列实验操作、现象和结论都正确的是
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 将HI溶液加入Fe(NO3)3溶液中,充分反应后再加入CCl4混合振荡,静置 | 溶液分层, 下层液体显紫红色 | 氧化性:Fe3+>I2 |
| B | 过量的铁粉和氯气反应,将反应后的固体溶于盐酸后,滴加KSCN溶液 | 溶液不显红色 | 过量铁与氯气反应的产物为FeCl2 |
| C | 室温下,用pH试纸分别测定浓度均为0.1mol/L的Na2SO3溶液和CH3COONa溶液的pH | pH:Na2SO3>CH3COONa | H2SO3酸性弱于CH3COOH |
| D | 向2支装有等物质的量的AgCl、AgI的试管中分别滴加足量等体积等浓度的氨水 | AgCl溶解而AgI不溶解 | 相同温度下,Ksp(AgCl)>Ksp(AgI) |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
9 . 锗是一种稀散金属,在光纤通信、航空航天等领域有广泛应用,模拟从氧化锌烟灰(成分有ZnO、ZnO·GeO2、FeO·GeO2、Fe2O3·GeO2、PbO等)中提取锗元素的流程图如下:
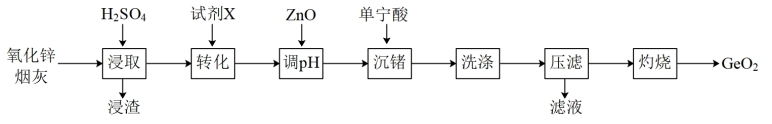
已知:①浸取后溶液pH为2,Ge以GeO2+的形式存在;
②单宁酸为复杂有机酸,易与Fe3+络合沉淀。
(1)浸取时ZnO·GeO2发生反应的化学方程式是_______ ,浸渣的主要成分是_______ 。
(2)试剂X的作用是_______ 。
(3)下图为沉锗时溶液pH对锗沉淀率的影响,则适宜的pH应为_______(填标号)。

(4)沉锗时有一段沉锗和二段沉锗两种工艺,单宁酸用量与锗沉淀率关系如表所示,工业常用二段沉锗工艺且单宁酸总用量为25倍,其原因是_______ 。
(5)可从滤液中回收的金属元素主要有_______ 。
(6)若用C2H2O表示单宁酸,压滤后的含锗沉淀表示为GeO(C2H2O)2SO4,其在空气中灼烧会得到SO2、H2O、CO2三种气体,该反应方程式为_______ 。

已知:①浸取后溶液pH为2,Ge以GeO2+的形式存在;
②单宁酸为复杂有机酸,易与Fe3+络合沉淀。
(1)浸取时ZnO·GeO2发生反应的化学方程式是
(2)试剂X的作用是
(3)下图为沉锗时溶液pH对锗沉淀率的影响,则适宜的pH应为_______(填标号)。

| A.1.0 | B.2.0 | C.2.5 | D.3.0 |
| 一段沉锗单宁酸总用量/倍 | 10 | 15 | 20 | 25 | 30 |
| 锗沉淀率/% | 88.5 | 89.5 | 90.5 | 91.5 | 93.5 |
| 二段沉锗单宁酸总用量/倍 | 10 | 15 | 20 | 25 | 30 |
| 锗沉淀率/% | 92 | 93.5 | 94.5 | 97 | 97.5 |
(6)若用C2H2O表示单宁酸,压滤后的含锗沉淀表示为GeO(C2H2O)2SO4,其在空气中灼烧会得到SO2、H2O、CO2三种气体,该反应方程式为
您最近半年使用:0次
2022-05-19更新
|
1702次组卷
|
7卷引用:安徽省淮南市2022届高三第二次模拟考试理科综合化学试题
安徽省淮南市2022届高三第二次模拟考试理科综合化学试题(已下线)专题15工艺流程题-2022年高考真题+模拟题汇编(全国卷)(已下线)专题16工艺流程题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)第二部分 热点专项突破——解题能力稳提升专项2 物质提纯类的工艺流程(已下线)T26-工业流程题辽宁省沈阳市新民市高级中学2023-2024学年高三上学期10月月考化学试题
解题方法
10 . 某同学实验室研究 时,进行了以下实验,回答有关问题。
时,进行了以下实验,回答有关问题。
(1)配制 溶液
溶液
称取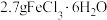 晶体溶解在盛有100mL蒸馏水的烧杯中,搅拌均匀即可制得。
晶体溶解在盛有100mL蒸馏水的烧杯中,搅拌均匀即可制得。
①配制的溶液不显黄色而显红褐色,原因是___________ ;若要获得黄色 溶液,改进配制方法是
溶液,改进配制方法是___________ 。
②配制溶液时没有使用容量瓶,所得溶液___________ (填“能”或“不能”)满足本实验要求。
(2)探究
“实验I”振荡后的现象是___________ ;用离子方程式解释该现象___________ 。
(3)探究实验II中白色沉淀的成分
查阅资料:CuCl、CuSCN均为白色难溶物, ,
, ,
, 与卤素离子性质相似。
与卤素离子性质相似。
为了进一步确定白色沉淀的成分,补充如下实验:
在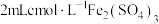 溶液中,加入3滴
溶液中,加入3滴 溶液,再加入足量铜粉,振荡,实验现象与“II”相同。
溶液,再加入足量铜粉,振荡,实验现象与“II”相同。
①c=_______ ,依据该实验可知白色沉淀一定含有_________ 。
②该实验中产生白色沉淀的反应分两步,请写出第二步反应的离子方程式。
i.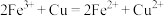 ;
;
ii.___________ 。
③依据以上实验,仍无法确定白色沉淀的组成;还需要将“补充实验”所得混合物进一步实验,即可得出结论。简述操作步骤:_____ 。
 时,进行了以下实验,回答有关问题。
时,进行了以下实验,回答有关问题。(1)配制
 溶液
溶液称取
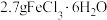 晶体溶解在盛有100mL蒸馏水的烧杯中,搅拌均匀即可制得。
晶体溶解在盛有100mL蒸馏水的烧杯中,搅拌均匀即可制得。①配制的溶液不显黄色而显红褐色,原因是
 溶液,改进配制方法是
溶液,改进配制方法是②配制溶液时没有使用容量瓶,所得溶液
(2)探究

| 序号 | 实验步骤 | 实验现象 |
| I | 在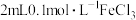 溶液中,加入3滴 溶液中,加入3滴 溶液,再加入足量铁粉,振荡。 溶液,再加入足量铁粉,振荡。 | 溶液变为血红色,振荡后… |
| II | 在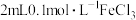 溶液中,加入3滴 溶液中,加入3滴 溶液,再加入足量铜粉,振荡。 溶液,再加入足量铜粉,振荡。 | 溶液变为血红色,振荡后红色褪去,产生白色沉淀。 |
(3)探究实验II中白色沉淀的成分
查阅资料:CuCl、CuSCN均为白色难溶物,
 ,
, ,
, 与卤素离子性质相似。
与卤素离子性质相似。为了进一步确定白色沉淀的成分,补充如下实验:
在
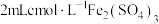 溶液中,加入3滴
溶液中,加入3滴 溶液,再加入足量铜粉,振荡,实验现象与“II”相同。
溶液,再加入足量铜粉,振荡,实验现象与“II”相同。①c=
②该实验中产生白色沉淀的反应分两步,请写出第二步反应的离子方程式。
i.
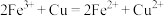 ;
; ii.
③依据以上实验,仍无法确定白色沉淀的组成;还需要将“补充实验”所得混合物进一步实验,即可得出结论。简述操作步骤:
您最近半年使用:0次



