以硫酸渣(含Fe2O3、SiO2等)为原料制备铁黄(FeOOH)的一种工艺流程如图:
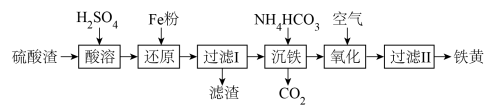
(1)“酸溶”中加快溶解的方法为_______ (任意写出一种)。
(2)“还原”过程中的离子方程式为_______ 。
(3)写出“滤渣”中主要成分的化学式:_______ 。
(4)①“沉铁”过程中生成Fe(OH)2的化学方程式为_______ 。
②若用CaCO3“沉铁”,则生成FeCO3沉淀。当反应完成时,溶液中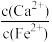 =
=_______ 。[已知Ksp(CaCO3)=2.8×10-9,Ksp(FeCO3)=2×10-11]
(5)“氧化”时,用NaNO2浓溶液代替空气氧化Fe(OH)2浆液,能缩短氧化时间,但缺点是_______ 。

(1)“酸溶”中加快溶解的方法为
(2)“还原”过程中的离子方程式为
(3)写出“滤渣”中主要成分的化学式:
(4)①“沉铁”过程中生成Fe(OH)2的化学方程式为
②若用CaCO3“沉铁”,则生成FeCO3沉淀。当反应完成时,溶液中
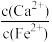 =
=(5)“氧化”时,用NaNO2浓溶液代替空气氧化Fe(OH)2浆液,能缩短氧化时间,但缺点是
2023高三·全国·专题练习 查看更多[1]
(已下线)微专题 无机化工流程题的解题策略
更新时间:2023-11-05 15:43:42
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】废钼催化剂中钼、钴、镍等金属作为二次资源可加以回收利用,一种从废钼催化剂(主要成分为MoO3、MoS2,含少量CoO、CoS、NiO、Fe2O3等)中回收金属的一种工艺流程如图:
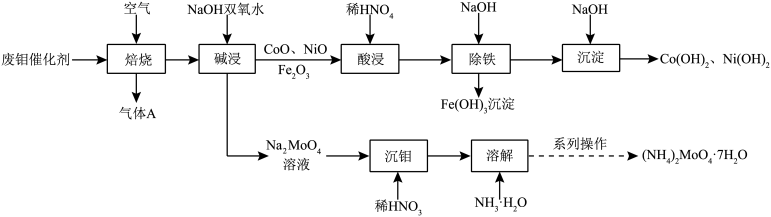
已知:溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)Ni2+价层电子轨道表示式为________ ,“焙烧”时产生的气体A的主要成分为________ 。
(2)“焙烧”时MoS2转化为MoO3,写出“碱浸”时MoO3参与反应的离子方程式_________ 。
(3)“除铁”时应调节溶液pH的范围为___________ ,“沉淀”时调节溶液pH=9.0,则此时溶液中[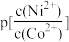 =
=___________ (pX=-lgX)。
(4)“系列操作”为________ 、________ 、过滤、洗涤、干燥得到(NH4)2MoO4·7H2O晶体。
(5)50.00kg该废钼催化剂(含Mo元素质量分数为10.56%)通过该工艺最终得到15.05kg七水钼酸铵(相对分子质量为322)产品,则该工艺中七水钼酸铵的收率为___________ %(保留小数点后一位数字,收率= )。
)。

已知:溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Fe3+ | Co2+ | Ni2+ |
| 开始沉淀时(c=0.01mol·L-1)的pH 沉淀完全时(c=1.0×10-5mol·L-1)的pH | 2.2 3.2 | 6.4 9.0 | 7.2 8.7 |
(1)Ni2+价层电子轨道表示式为
(2)“焙烧”时MoS2转化为MoO3,写出“碱浸”时MoO3参与反应的离子方程式
(3)“除铁”时应调节溶液pH的范围为
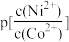 =
=(4)“系列操作”为
(5)50.00kg该废钼催化剂(含Mo元素质量分数为10.56%)通过该工艺最终得到15.05kg七水钼酸铵(相对分子质量为322)产品,则该工艺中七水钼酸铵的收率为
 )。
)。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】过渡金属催化的反应已成为重要的合成工具,贵金属成本高,会对环境造成的不利影响。因此研究成本低廉的含锰、铁、钴、镍、铜等催化剂应用成为热点。以下是以含钴废渣(主要成分CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程:
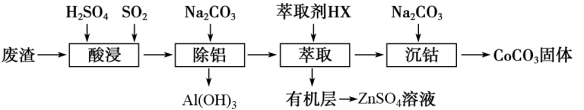
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算)
回答下列问题:
(1)“酸浸”时通入SO2的目的是____________ ,反应的离子方程式为______________ 。
(2)“萃取”过程可表示为ZnSO4(水层)+2HX(有机层) ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是 __________________ 。
(3)“沉钴”时Na2CO3溶液需缓慢滴加的原因是____________ 。
(4)用得到的CoCO3等为原料采用微波水热法和常规水热法可以制得两种CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价),均可用作H2O2分解的催化剂,有较高的活性。如图是两种不同方法制得的CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知:____________ 法制取得到的催化剂活性更高,由此推测Co2+、Ni2+两种离子中催化效果更好的是____________ 。

(5)用纯碱沉淀转化法也可以从草酸钴(CoC2O4)废料得到CoCO3,向含有CoC2O4固体的溶液中滴加Na2CO3溶液,当有CoCO3沉淀生成时,溶液中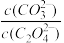 =
=___________ 。[已知Ksp(CoC2O4)=6.3×10-8 Ksp (CoCO3) =1.4×10- 13]

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算)
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Co2+ | 7.6 | 9.4 |
| Al3+ | 3.0 | 5.0 |
| Zn2+ | 5.4 | 8.0 |
(1)“酸浸”时通入SO2的目的是
(2)“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)
 ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是 (3)“沉钴”时Na2CO3溶液需缓慢滴加的原因是
(4)用得到的CoCO3等为原料采用微波水热法和常规水热法可以制得两种CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价),均可用作H2O2分解的催化剂,有较高的活性。如图是两种不同方法制得的CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知:

(5)用纯碱沉淀转化法也可以从草酸钴(CoC2O4)废料得到CoCO3,向含有CoC2O4固体的溶液中滴加Na2CO3溶液,当有CoCO3沉淀生成时,溶液中
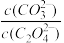 =
=
您最近一年使用:0次
【推荐3】工业上由含铜废料(含有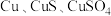 等)制备硝酸铜晶体的流程如图所示:
等)制备硝酸铜晶体的流程如图所示:

(1)写出由 “焙烧”生成
“焙烧”生成 和
和 的化学方程式:
的化学方程式:_______ 。
(2)“淘洗”所用的溶液A可以是_______(填字母)。
(3)①“反应”步骤中,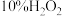 为氧化剂,
为氧化剂,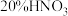 提供
提供 ,可以避免污染性气体的产生,则理论上消耗的
,可以避免污染性气体的产生,则理论上消耗的 和
和 的物质的量之比为
的物质的量之比为_______ 。
②若不加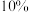 的
的 溶液,只用
溶液,只用 的
的 溶液,随着反应的进行,温度上升并出现大量红棕色气体,反应的离子方程式为
溶液,随着反应的进行,温度上升并出现大量红棕色气体,反应的离子方程式为_______ 。
(4)根据下图分析从“反应”所得溶液中析出 的方法是
的方法是_______ 。已知室温下 的
的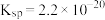 ,则
,则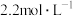 的
的 溶液在室温下结晶时为了避免生成
溶液在室温下结晶时为了避免生成 沉淀,需控制
沉淀,需控制
_______ 。

(5)大量排放 容易造成酸雨等环境问题,工业上可用双碱法脱硫法处理废气。过程如图所示,写出双碱法脱硫法的总反应方程式:
容易造成酸雨等环境问题,工业上可用双碱法脱硫法处理废气。过程如图所示,写出双碱法脱硫法的总反应方程式:_______ 。

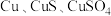 等)制备硝酸铜晶体的流程如图所示:
等)制备硝酸铜晶体的流程如图所示:
(1)写出由
 “焙烧”生成
“焙烧”生成 和
和 的化学方程式:
的化学方程式:(2)“淘洗”所用的溶液A可以是_______(填字母)。
| A.稀硫酸 | B.浓硫酸 | C.稀硝酸 | D.浓硝酸 |
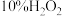 为氧化剂,
为氧化剂,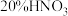 提供
提供 ,可以避免污染性气体的产生,则理论上消耗的
,可以避免污染性气体的产生,则理论上消耗的 和
和 的物质的量之比为
的物质的量之比为②若不加
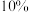 的
的 溶液,只用
溶液,只用 的
的 溶液,随着反应的进行,温度上升并出现大量红棕色气体,反应的离子方程式为
溶液,随着反应的进行,温度上升并出现大量红棕色气体,反应的离子方程式为(4)根据下图分析从“反应”所得溶液中析出
 的方法是
的方法是 的
的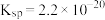 ,则
,则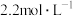 的
的 溶液在室温下结晶时为了避免生成
溶液在室温下结晶时为了避免生成 沉淀,需控制
沉淀,需控制

(5)大量排放
 容易造成酸雨等环境问题,工业上可用双碱法脱硫法处理废气。过程如图所示,写出双碱法脱硫法的总反应方程式:
容易造成酸雨等环境问题,工业上可用双碱法脱硫法处理废气。过程如图所示,写出双碱法脱硫法的总反应方程式:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】二氧化铈可用在化妆品中起到抗紫外线作用,工业上以氟碳铈矿(CeCO3F,含Fe2O3、SiO2、Al2O3等杂质)为原料制备二氧化铈、硫酸铝铵晶体 和硫酸亚铁铵
和硫酸亚铁铵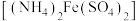 晶体,其工艺流程如图所示:
晶体,其工艺流程如图所示:
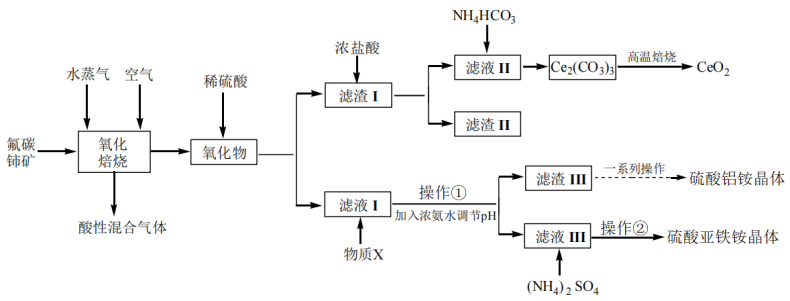
已知:①CeO2不溶于稀硫酸,也不溶于NaOH溶液,Ce2O3易溶于强酸。
②常见离子开始沉淀和完全沉淀pH表
回答下列问题:
(1)“氧化焙烧”时,气体与矿料逆流而行进行投料,其目的是___________ ,此时,发生化学方程式为___________ 。
(2)“滤渣Ⅰ”的主要成分是___________ 和___________ (填化学式)。虽浓盐酸价格便宜,但用于溶解“滤渣Ⅰ”的缺点是___________ ,若用稀硫酸和双氧水代替浓盐酸,则发生反应的离子方程式为___________ 。
(3)“滤液Ⅰ”中加入物质X的目的是___________ 。
(4)“操作①”加入浓氨水调节pH后,溶液pH范围是___________ 。
(5)“滤渣Ⅲ”在制备硫酸铝铵晶体过程中,理论上需加入稀硫酸和(NH4)2SO4的物质的量之比为___________ 。
 和硫酸亚铁铵
和硫酸亚铁铵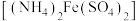 晶体,其工艺流程如图所示:
晶体,其工艺流程如图所示:
已知:①CeO2不溶于稀硫酸,也不溶于NaOH溶液,Ce2O3易溶于强酸。
②常见离子开始沉淀和完全沉淀pH表
| 离子 |  |  |  |
| 开始沉淀时的pH | 7.6 | 1.5 | 3.4 |
| 完全沉淀时的pH | 9.6 | 2.8 | 4.7 |
(1)“氧化焙烧”时,气体与矿料逆流而行进行投料,其目的是
(2)“滤渣Ⅰ”的主要成分是
(3)“滤液Ⅰ”中加入物质X的目的是
(4)“操作①”加入浓氨水调节pH后,溶液pH范围是
(5)“滤渣Ⅲ”在制备硫酸铝铵晶体过程中,理论上需加入稀硫酸和(NH4)2SO4的物质的量之比为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐2】现有金属单质A、B、C、D和气体甲、乙、丙及物质E、F、G、H、I,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
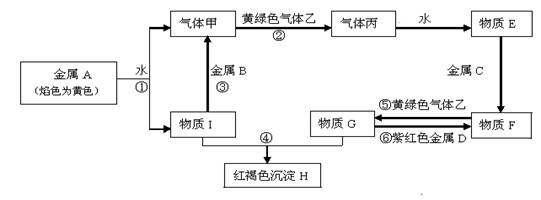
请根据以上信息回答下列问题:
(1)写出下列物质的化学式: B____________ ; F_____________ ;
(2)已知A的一种氧化物可以做核潜艇的供氧剂,则其氧化物供氧时的化学方程式为_____________
(3)①、④离子方程式:________________ ;________________ 。

请根据以上信息回答下列问题:
(1)写出下列物质的化学式: B
(2)已知A的一种氧化物可以做核潜艇的供氧剂,则其氧化物供氧时的化学方程式为
(3)①、④离子方程式:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐3】某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如下,请回答下列问题:

(1)步骤①的作用是清洗废铁屑表面的油污,其中加热的目的是____________ 。
(2)写出步骤②中生成 的离子方程式
的离子方程式______________________ 。(写一个即可)
(3)步骤③中“氯气”不引入杂质但有毒,可以用___________ 代替(填化学式)。
(4)若溶液B中只含有 而不含
而不含 ,可证明该事实的实验操作是
,可证明该事实的实验操作是__________ 。
(5)步骤⑤产生金属铜的化学方程式为______________________________ 。

(1)步骤①的作用是清洗废铁屑表面的油污,其中加热的目的是
(2)写出步骤②中生成
 的离子方程式
的离子方程式(3)步骤③中“氯气”不引入杂质但有毒,可以用
(4)若溶液B中只含有
 而不含
而不含 ,可证明该事实的实验操作是
,可证明该事实的实验操作是(5)步骤⑤产生金属铜的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质。湿法炼锌产生的铜镉渣用于生产金属镉的工艺流程如图:

表中列出了相关金属离子生成氢氧化物沉淀的pH(金属离子的起始浓度为0.1mol·L-1)
(1)酸浸时粉碎铜镉渣的目的是___ 。
(2)操作Ⅰ产生的滤渣主要成分为__ (填化学式)。
(3)①操作Ⅲ中先加入适量H2O2,发生反应的离子方程式为__ 。
②再加入ZnO控制反应液的pH,pH范围为__ ,判断依据是__ 。
③若加入的H2O2不足,加入ZnO后所得的电解液中会含有Fe元素。请设计实验方案加以鉴别:__ 。
(4)处理含镉废水常用加入碳酸钙实现沉淀转化,该沉淀转化的反应方程式为___ 。除去工业废水中的Cd2+时,若反应达到平衡后溶液中c(Ca2+)=0.1mol·L-1,溶液中c(Cd2+)=__ mol·L-1[已知25℃,Ksp(CdCO3)=5.6×10-12,Ksp(CaCO3)=2.8×10-9]。

表中列出了相关金属离子生成氢氧化物沉淀的pH(金属离子的起始浓度为0.1mol·L-1)
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 |
| 沉淀完全的pH | 3.3 | 9.9 | 9.5 |
(1)酸浸时粉碎铜镉渣的目的是
(2)操作Ⅰ产生的滤渣主要成分为
(3)①操作Ⅲ中先加入适量H2O2,发生反应的离子方程式为
②再加入ZnO控制反应液的pH,pH范围为
③若加入的H2O2不足,加入ZnO后所得的电解液中会含有Fe元素。请设计实验方案加以鉴别:
(4)处理含镉废水常用加入碳酸钙实现沉淀转化,该沉淀转化的反应方程式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属化学平衡。根据要求回答问题:
(1)常温下浓度均为 的8种溶液:①
的8种溶液:① 溶液;②
溶液;② 溶液;③
溶液;③ 溶液;④
溶液;④ 溶液;⑤
溶液;⑤ 溶液;⑥
溶液;⑥ 溶液;⑦
溶液;⑦ 溶液;⑧
溶液;⑧ 溶液,这些溶液的pH由小到大的顺序是
溶液,这些溶液的pH由小到大的顺序是______________ (填序号)。
(2)常温下, 的盐酸和
的盐酸和 的
的 溶液中,水电离出的
溶液中,水电离出的 分别为
分别为 和
和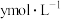 ,二者的关系正确的是
,二者的关系正确的是____________ (填字母)。
a.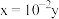 b.
b.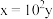 c.
c. d.
d.
(3)室温下,测得用氨水吸收 时,溶液中含碳(氮)各粒子的物质的量分数和pH的关系如图,若所得溶液
时,溶液中含碳(氮)各粒子的物质的量分数和pH的关系如图,若所得溶液 ,则溶液中
,则溶液中 =
=_________ (已知 )。
)。
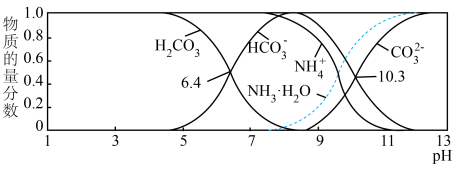
(4)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体 ,其产物之一是
,其产物之一是 。已知常温下碳酸的电离常数
。已知常温下碳酸的电离常数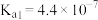 ,
,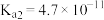 ,
, 的电离常数
的电离常数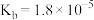 ,则所得
,则所得 溶液中
溶液中
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(5)常温下,将 的氨水溶液加水稀释,下列数值一定减小的是____________(填字母)。
的氨水溶液加水稀释,下列数值一定减小的是____________(填字母)。
(6)某温度下,测得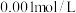 的
的 溶液中水电离出的
溶液中水电离出的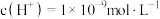 ,将
,将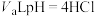 溶液和
溶液和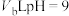 的
的 溶液混合均匀,测得溶液的
溶液混合均匀,测得溶液的 ,则
,则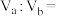
___________ 。
(7)常温下,若在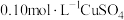 溶液中加入
溶液中加入 稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的
稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的 时,
时,
_________  。
。
(1)常温下浓度均为
 的8种溶液:①
的8种溶液:① 溶液;②
溶液;② 溶液;③
溶液;③ 溶液;④
溶液;④ 溶液;⑤
溶液;⑤ 溶液;⑥
溶液;⑥ 溶液;⑦
溶液;⑦ 溶液;⑧
溶液;⑧ 溶液,这些溶液的pH由小到大的顺序是
溶液,这些溶液的pH由小到大的顺序是(2)常温下,
 的盐酸和
的盐酸和 的
的 溶液中,水电离出的
溶液中,水电离出的 分别为
分别为 和
和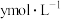 ,二者的关系正确的是
,二者的关系正确的是a.
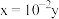 b.
b.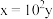 c.
c. d.
d.
(3)室温下,测得用氨水吸收
 时,溶液中含碳(氮)各粒子的物质的量分数和pH的关系如图,若所得溶液
时,溶液中含碳(氮)各粒子的物质的量分数和pH的关系如图,若所得溶液 ,则溶液中
,则溶液中 =
= )。
)。
(4)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体
 ,其产物之一是
,其产物之一是 。已知常温下碳酸的电离常数
。已知常温下碳酸的电离常数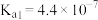 ,
,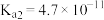 ,
, 的电离常数
的电离常数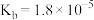 ,则所得
,则所得 溶液中
溶液中
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(5)常温下,将
 的氨水溶液加水稀释,下列数值一定减小的是____________(填字母)。
的氨水溶液加水稀释,下列数值一定减小的是____________(填字母)。A. | B. | C. | D. |
(6)某温度下,测得
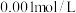 的
的 溶液中水电离出的
溶液中水电离出的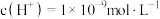 ,将
,将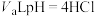 溶液和
溶液和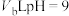 的
的 溶液混合均匀,测得溶液的
溶液混合均匀,测得溶液的 ,则
,则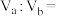
(7)常温下,若在
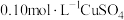 溶液中加入
溶液中加入 稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的
稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的 时,
时,
 。
。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】废旧电池镍钴锰酸锂三元正极材料的主要成分为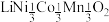 ,通过高温氢化和湿法冶金的方法回收其中的镍、钴、锰、锂,其工艺流程如图所示。
,通过高温氢化和湿法冶金的方法回收其中的镍、钴、锰、锂,其工艺流程如图所示。
②M2+(Co2+或Ni2+)的萃取原理:2HR(有机相)+M2+(水相)⇌MR2(有机相)+2H+(水相)。
回答下列问题:
(1)“高温氢化”时固体产物为Co、Ni、MnO和LiOH,该反应的化学方程式为_______ ;实际生产中还有少量的Li2CO3生成,原因是_______ 。
(2)“酸洗”的目的是_______ ;若“洗液”中c(Li+)=2.0mol•L-1,加入Na2CO3固体后,为使沉淀Li2CO3中Li元素含量不小于Li元素总量的95%,则1.0L“洗液”中至少需要加入Na2CO3的物质的量为______ mol[忽略溶液体积变化,Ksp(Li2CO3)=2.2×10-3]。
(3)“沉锰”过程中pH对金属沉淀率的影响如图所示。_______ 。
②pH=0.5时,有少量钴、镍析出,可能的原因是_______ ;应选择的最佳pH为_______ 。
(4)“反萃取”的目的是将有机层中Co2+、Ni2+转移到水层。
①试剂X为_______ (填试剂名称)。
②为使Co2+、Ni2+尽可能多地转移到水层,应采取的实验操作有_______ 。
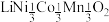 ,通过高温氢化和湿法冶金的方法回收其中的镍、钴、锰、锂,其工艺流程如图所示。
,通过高温氢化和湿法冶金的方法回收其中的镍、钴、锰、锂,其工艺流程如图所示。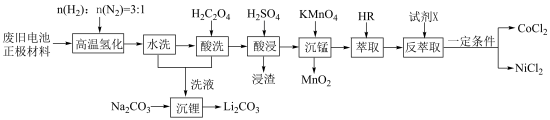
②M2+(Co2+或Ni2+)的萃取原理:2HR(有机相)+M2+(水相)⇌MR2(有机相)+2H+(水相)。
回答下列问题:
(1)“高温氢化”时固体产物为Co、Ni、MnO和LiOH,该反应的化学方程式为
(2)“酸洗”的目的是
(3)“沉锰”过程中pH对金属沉淀率的影响如图所示。
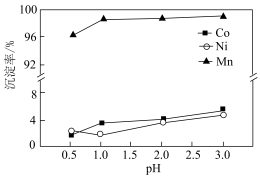
②pH=0.5时,有少量钴、镍析出,可能的原因是
(4)“反萃取”的目的是将有机层中Co2+、Ni2+转移到水层。
①试剂X为
②为使Co2+、Ni2+尽可能多地转移到水层,应采取的实验操作有
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】 Na2S2O3俗称大苏打、海波,易溶于水,在中性或碱性环境中能稳定存在,食品工业用作螯合剂、抗氧化剂,医药工业用作洗涤剂、消毒剂。实验室用SO2通入Na2S和Na2CO3的混合溶液中来制备Na2S2O3并测定所得产品中其晶体纯度。
(1)用图甲所示装置制取Na2S2O3。

①装置中用于滴加浓硫酸的仪器通常换成仪器A,仪器A的名称为___________ ,仪器A与原仪器相比,其优点是___________ 。
②三颈烧瓶中制取Na2S2O3的反应的化学方程式为__________ ,使用搅拌器搅拌的目的是___________ 。
③将获得的产品经过加热浓缩、降温结晶等步骤得到Na2S2O3∙5H2O的晶体样品,欲得到此晶体为何不通过蒸发结晶:___________ ,此样品中含有少量Na2SO3,也可能含有Na2SO4,如何验证此晶体样品中杂质Na2SO4的存在:___________ 。
(2)测定实验室制取的样品中Na2S2O3∙5H2O的纯度。
采用氧化还原滴定法测定所制取的样品中Na2S2O3∙5H2O的纯度,相关反应为2Na2S2O3+I2=2NaI+Na2S4O6。准确称取9.50g样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用1.00 mol/L碘的标准溶液进行滴定,滴定终点的现象是___________ ,碘水标准液应放在___________ 滴定管中,若滴定起始和终点的液面位置如图乙所示,且三次结果均和图乙数据一致,此样品中Na2S2O3∙5H2O的纯度为___________ (保留2位有效数字)。

(1)用图甲所示装置制取Na2S2O3。

①装置中用于滴加浓硫酸的仪器通常换成仪器A,仪器A的名称为
②三颈烧瓶中制取Na2S2O3的反应的化学方程式为
③将获得的产品经过加热浓缩、降温结晶等步骤得到Na2S2O3∙5H2O的晶体样品,欲得到此晶体为何不通过蒸发结晶:
(2)测定实验室制取的样品中Na2S2O3∙5H2O的纯度。
采用氧化还原滴定法测定所制取的样品中Na2S2O3∙5H2O的纯度,相关反应为2Na2S2O3+I2=2NaI+Na2S4O6。准确称取9.50g样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用1.00 mol/L碘的标准溶液进行滴定,滴定终点的现象是

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】废铅蓄电池的一种回收利用工艺流程如下图所示:
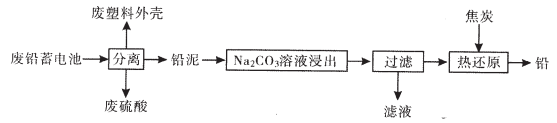
部分难溶电解质的性质如下表:

回答下列问题:
(1)铅蓄电池在生产、生活中使用广泛,铅蓄电池的缺点有____(写一条)。
(2)燃烧废塑料外壳可以发电,其一系列能量转换过程:化学能→ → →电能。
(3)将流程图中的废硫酸和滤液按一定比例混合,再将所得的混合液经____、____、____等操作,可以析出十水硫酸钠晶体。
(4)利用铅泥中的PbS04溶于CH3COONa溶液生成弱电解质(CH3COO)2Pb,(CH3COO)2Pb溶液与KC10在强碱性条件下反应制取Pb02,写出后一步生成PbO2的离子方程式 。
(5)250C时,Na2CO3溶液浸出时发生的反应为:CO32-(aq)+ PbSO4(s) PbCO3(s)+SO42-(aq),计算该反应的平衡常数K=____。以滤渣PbCO3和焦炭为原料可制备金属铅,用化学方程式表示制备过程。
PbCO3(s)+SO42-(aq),计算该反应的平衡常数K=____。以滤渣PbCO3和焦炭为原料可制备金属铅,用化学方程式表示制备过程。
(6)已知Pb(OH)2是既能溶于稀硝酸,又能溶于KOH溶液的两性氢氧化物。设计实验区别PbCrO4和BaCrO4: 。

部分难溶电解质的性质如下表:

回答下列问题:
(1)铅蓄电池在生产、生活中使用广泛,铅蓄电池的缺点有____(写一条)。
(2)燃烧废塑料外壳可以发电,其一系列能量转换过程:化学能→ → →电能。
(3)将流程图中的废硫酸和滤液按一定比例混合,再将所得的混合液经____、____、____等操作,可以析出十水硫酸钠晶体。
(4)利用铅泥中的PbS04溶于CH3COONa溶液生成弱电解质(CH3COO)2Pb,(CH3COO)2Pb溶液与KC10在强碱性条件下反应制取Pb02,写出后一步生成PbO2的离子方程式 。
(5)250C时,Na2CO3溶液浸出时发生的反应为:CO32-(aq)+ PbSO4(s)
 PbCO3(s)+SO42-(aq),计算该反应的平衡常数K=____。以滤渣PbCO3和焦炭为原料可制备金属铅,用化学方程式表示制备过程。
PbCO3(s)+SO42-(aq),计算该反应的平衡常数K=____。以滤渣PbCO3和焦炭为原料可制备金属铅,用化学方程式表示制备过程。(6)已知Pb(OH)2是既能溶于稀硝酸,又能溶于KOH溶液的两性氢氧化物。设计实验区别PbCrO4和BaCrO4: 。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐3】锡是大名鼎鼎的“五金”之一,早在远古时代人们便发现并加以利用。现从电镀锡渣(主要成分为Sn、SnO,含有砷和难溶于酸碱的杂质)中制取二水合氯化亚锡和锡酸钠,工艺流程如图所示:
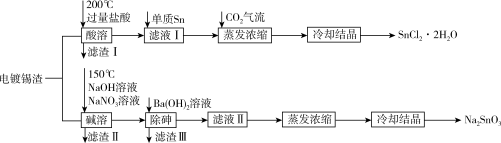
已知:①Sn(Ⅱ)具有还原性,可与Cl-形成[SnCl3]-;②As在碱溶时转化为Na3AsO4溶液;③20℃时,Ksp[Ba3(AsO4)2]=2.7×10-10
回答下列问题:
(1)在自然界中,锡很少以游离态存在但是远古时期人们已经会冶炼Sn,采用的方法是____ 。
(2)SnCl2溶液可用作电镀锡的电解液,阴极的电极反应式为_______ 。
(3)“酸溶”时SnO发生反应的离子方程式为____ 。在CO2气流中蒸发浓缩的目的是_____ 。
(4)“碱溶”时的还原产物是空气的主要成分之一,写出Sn在该步骤中发生反应的化学方程式_______ 。
(5)“滤液I”中,需加入少量单质Sn,原因除了防止Sn(Ⅱ)被氧化,还有_______ 。
(6)“除砷”时,若溶液中c( )=4mol/L,加入等体积的Ba(OH)2溶液后,“滤液II”中c(Ba2+)=3×l0-3mol/L,则沉淀中的As元素占原As元素总量的百分数为
)=4mol/L,加入等体积的Ba(OH)2溶液后,“滤液II”中c(Ba2+)=3×l0-3mol/L,则沉淀中的As元素占原As元素总量的百分数为_______ 。
(7)蒸发浓缩“滤液Ⅱ”前,可往体系中加入适量的NaOH溶液,目的是_______ 。

已知:①Sn(Ⅱ)具有还原性,可与Cl-形成[SnCl3]-;②As在碱溶时转化为Na3AsO4溶液;③20℃时,Ksp[Ba3(AsO4)2]=2.7×10-10
回答下列问题:
(1)在自然界中,锡很少以游离态存在但是远古时期人们已经会冶炼Sn,采用的方法是
(2)SnCl2溶液可用作电镀锡的电解液,阴极的电极反应式为
(3)“酸溶”时SnO发生反应的离子方程式为
(4)“碱溶”时的还原产物是空气的主要成分之一,写出Sn在该步骤中发生反应的化学方程式
(5)“滤液I”中,需加入少量单质Sn,原因除了防止Sn(Ⅱ)被氧化,还有
(6)“除砷”时,若溶液中c(
 )=4mol/L,加入等体积的Ba(OH)2溶液后,“滤液II”中c(Ba2+)=3×l0-3mol/L,则沉淀中的As元素占原As元素总量的百分数为
)=4mol/L,加入等体积的Ba(OH)2溶液后,“滤液II”中c(Ba2+)=3×l0-3mol/L,则沉淀中的As元素占原As元素总量的百分数为(7)蒸发浓缩“滤液Ⅱ”前,可往体系中加入适量的NaOH溶液,目的是
您最近一年使用:0次



