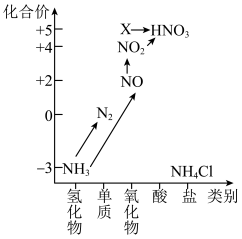
1 . 依据图中氮元素及其化合物的转化关系,回答下列问题:______ 。
(2)回答下列关于 的问题:
的问题:
①利用下列方法制氨气,其中合理的是______ (填字母)。
A.将浓氨水滴入氢氧化钠固体中
B.将氯化铵稀溶液滴入氧化钙固体中
C.将氯化铵固体加热分解
D.加热浓氨水
E.将浓氨水滴入碱石灰固体中
②氨气是重要的化工原料,可以合成多种物质,写出其催化氧化的化学方程式:______ 。
③ 、
、 合成
合成 的反应中,当分别用以下各种物质表示反应速率时,则反应速率最快的是
的反应中,当分别用以下各种物质表示反应速率时,则反应速率最快的是______ 。
A. B.
B.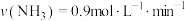
C.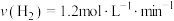 D.
D.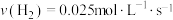
(3)下列关于NO、 的问题:
的问题:
①汽车排气管上装有催化转化器可减少尾气对环境的污染,汽车尾气中的有害气体C0和NO反应可转化为无害气体排放,写出相关反应的化学方程式:______ 。
②NO和 按一定比例混合可以被NaOH溶液完全吸收生成一种正盐,写出相关反应的化学方程式:
按一定比例混合可以被NaOH溶液完全吸收生成一种正盐,写出相关反应的化学方程式:______ 。
(2)回答下列关于
 的问题:
的问题:①利用下列方法制氨气,其中合理的是
A.将浓氨水滴入氢氧化钠固体中
B.将氯化铵稀溶液滴入氧化钙固体中
C.将氯化铵固体加热分解
D.加热浓氨水
E.将浓氨水滴入碱石灰固体中
②氨气是重要的化工原料,可以合成多种物质,写出其催化氧化的化学方程式:
③
 、
、 合成
合成 的反应中,当分别用以下各种物质表示反应速率时,则反应速率最快的是
的反应中,当分别用以下各种物质表示反应速率时,则反应速率最快的是A.
 B.
B.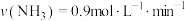
C.
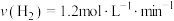 D.
D.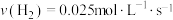
(3)下列关于NO、
 的问题:
的问题:①汽车排气管上装有催化转化器可减少尾气对环境的污染,汽车尾气中的有害气体C0和NO反应可转化为无害气体排放,写出相关反应的化学方程式:
②NO和
 按一定比例混合可以被NaOH溶液完全吸收生成一种正盐,写出相关反应的化学方程式:
按一定比例混合可以被NaOH溶液完全吸收生成一种正盐,写出相关反应的化学方程式:
您最近半年使用:0次
2 . 完成下列问题。
(1)某化学研究性学习小组用NH4Cl、KCl、(NH4)2SO4配制含有 、Cl-、K+、
、Cl-、K+、 的溶液,且要求该溶液中,c(Cl-)=c(K+)=c(
的溶液,且要求该溶液中,c(Cl-)=c(K+)=c( )=0.4mol/L,则
)=0.4mol/L,则 的物质的量浓度为
的物质的量浓度为___________ 。
(2)向含有2molHNO3和0.6molH2SO4的混合稀溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。

①a表示的是___________ 的变化曲线。
②n1=___________ ,n3=___________ 。
③向P点溶液中加入铜粉,最多可溶解铜粉的质量是___________ g。
(1)某化学研究性学习小组用NH4Cl、KCl、(NH4)2SO4配制含有
 、Cl-、K+、
、Cl-、K+、 的溶液,且要求该溶液中,c(Cl-)=c(K+)=c(
的溶液,且要求该溶液中,c(Cl-)=c(K+)=c( )=0.4mol/L,则
)=0.4mol/L,则 的物质的量浓度为
的物质的量浓度为(2)向含有2molHNO3和0.6molH2SO4的混合稀溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。

①a表示的是
②n1=
③向P点溶液中加入铜粉,最多可溶解铜粉的质量是
您最近半年使用:0次
名校
解题方法
3 . 向含有0.8mol的稀硝酸溶液中慢慢加入22.4g的铁粉。假设反应分为两个阶段。第一阶段为:Fe+HNO3→Fe(NO3)3+NO↑+H2O
(1)写出这两个阶段反应的离子方程式___________ 、___________ 。
(2)求这两个阶段反应中,加入铁粉的物质的量和溶液中铁元素存在的形式_________ 。
(3)在图中画出溶液中Fe2+、 离子的物质的量随加入铁粉的物质的量变化的关系图像
离子的物质的量随加入铁粉的物质的量变化的关系图像___________ (纵坐标是溶液中离子的物质的量)。

(1)写出这两个阶段反应的离子方程式
(2)求这两个阶段反应中,加入铁粉的物质的量和溶液中铁元素存在的形式
(3)在图中画出溶液中Fe2+、
 离子的物质的量随加入铁粉的物质的量变化的关系图像
离子的物质的量随加入铁粉的物质的量变化的关系图像
您最近半年使用:0次
4 . 分析以下几个反应(未配平),填空:
①Fe2++Zn→Zn2++Fe
②Fe2++Cl2→Fe3++Cl—
③Fe3++Fe→Fe2+
(1)Fe2+体现氧化性的是___________ (填反应的序号)。
(2)写出反应①对应的一个化学反应方程式___________ 。
(3)反应②中每1molCl2完全反应转移电子为___________ mol。
(4)对反应③进行配平,并用单线桥标注电子转移的方向和数目。______
___________Fe3++___________Fe=___________Fe2+
①Fe2++Zn→Zn2++Fe
②Fe2++Cl2→Fe3++Cl—
③Fe3++Fe→Fe2+
(1)Fe2+体现氧化性的是
(2)写出反应①对应的一个化学反应方程式
(3)反应②中每1molCl2完全反应转移电子为
(4)对反应③进行配平,并用单线桥标注电子转移的方向和数目。
___________Fe3++___________Fe=___________Fe2+
您最近半年使用:0次
名校
解题方法
5 . 现将有铜的印刷线路板浸入120mL氯化铁浓溶液中,有9.6g铜被腐蚀掉。取出印刷线路板,向溶液中加入8.4g铁粉,经充分反应,溶液中还存在4.8g不溶解的物质。(设溶液体积不变,且不考虑金属离子水解)。请回答下列问题:
(1)充分反应后,溶液中存在4.8g不溶物的成分为___________ (用化学式表示)。
(2)充分反应后溶液中一定不存在的金属离子为___________ 。
(3)比较 、
、 、
、 的氧化性大小:
的氧化性大小:___________ 。
(4)试计算最后溶液中 离子的物质的量浓度
离子的物质的量浓度___________ mol/L。
(1)充分反应后,溶液中存在4.8g不溶物的成分为
(2)充分反应后溶液中一定不存在的金属离子为
(3)比较
 、
、 、
、 的氧化性大小:
的氧化性大小:(4)试计算最后溶液中
 离子的物质的量浓度
离子的物质的量浓度
您最近半年使用:0次
6 . Ⅰ.钠、铝、铁是三种重要的金属,它们的单质及其化合物在生活生产中有重要的作用。请回答下列问题:
(1)钠着火不能用二氧化碳来灭火,已知钠在足量二氧化碳中燃烧生成炭黑和一种白色固体。根据实验现象写出方程式:_______ ,该反应中氧化剂和还原剂的物质的量之比为______ 。
Ⅱ.一些活泼金属也可作还原剂,将相对不活泼的金属从其化合物中置换出来。例如“铝热反应”的原理是: 。其反应装置如下图所示,已知镁条与氯酸钾反应产生高温可引发“铝热反应”。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入装有沙子的蒸发皿中”。由化学手册查阅得有关物质的熔、沸点数据如下表。
。其反应装置如下图所示,已知镁条与氯酸钾反应产生高温可引发“铝热反应”。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入装有沙子的蒸发皿中”。由化学手册查阅得有关物质的熔、沸点数据如下表。
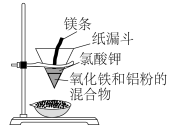
(2)该同学推测,铝热反应所得到的熔融物可能是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_____ (填化学式),该试剂与金属铝反应的离子方程式为_______ 。
(3)另一同学推测铝热反应得到的熔融物中还含有 ,他设计了如下方案来验证熔融物是否有
,他设计了如下方案来验证熔融物是否有 剩余:取一块该熔融物冷却后投入到稍过量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有
剩余:取一块该熔融物冷却后投入到稍过量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有 。则物质甲是
。则物质甲是_______ (填化学式)。该同学的实验方案是否合理?______ (填“合理”或“不合理”)。理由:_______ (用离子方程式说明)。
(1)钠着火不能用二氧化碳来灭火,已知钠在足量二氧化碳中燃烧生成炭黑和一种白色固体。根据实验现象写出方程式:
Ⅱ.一些活泼金属也可作还原剂,将相对不活泼的金属从其化合物中置换出来。例如“铝热反应”的原理是:
 。其反应装置如下图所示,已知镁条与氯酸钾反应产生高温可引发“铝热反应”。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入装有沙子的蒸发皿中”。由化学手册查阅得有关物质的熔、沸点数据如下表。
。其反应装置如下图所示,已知镁条与氯酸钾反应产生高温可引发“铝热反应”。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入装有沙子的蒸发皿中”。由化学手册查阅得有关物质的熔、沸点数据如下表。
| 物质 | Al |  | Fe |  |
| 熔点/℃ | 660 | 2054 | 1535 | 1460 |
| 沸点/℃ | 2467 | 2980 | 2750 |
(2)该同学推测,铝热反应所得到的熔融物可能是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是
(3)另一同学推测铝热反应得到的熔融物中还含有
 ,他设计了如下方案来验证熔融物是否有
,他设计了如下方案来验证熔融物是否有 剩余:取一块该熔融物冷却后投入到稍过量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有
剩余:取一块该熔融物冷却后投入到稍过量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有 。则物质甲是
。则物质甲是
您最近半年使用:0次
2024-01-14更新
|
161次组卷
|
2卷引用:辽宁省部分高中2023-2024学年高一上学期期末考试高化学试题
名校
解题方法
7 . 向 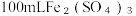 和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中剩余固体的质量与加入铁粉的质量如图所示。(忽略溶液体积的变化)
和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中剩余固体的质量与加入铁粉的质量如图所示。(忽略溶液体积的变化)
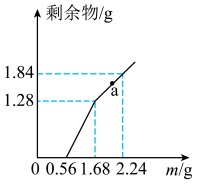
(1)加入少量铁粉时,发生的离子反应______________ 。
(2)原溶液中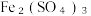 和CuSO4的物质的量之比为
和CuSO4的物质的量之比为_______ 。
(3)a点时溶液中溶质的物质的量浓度为____________ 。
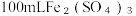 和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中剩余固体的质量与加入铁粉的质量如图所示。(忽略溶液体积的变化)
和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中剩余固体的质量与加入铁粉的质量如图所示。(忽略溶液体积的变化)
(1)加入少量铁粉时,发生的离子反应
(2)原溶液中
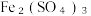 和CuSO4的物质的量之比为
和CuSO4的物质的量之比为(3)a点时溶液中溶质的物质的量浓度为
您最近半年使用:0次
名校
8 . 填空。
(1)欲除去FeCl2溶液中的Fe3+,可向溶液中加少量___________ ,请用离子方程式表示除杂原理___________ 。
(2)下列属于氮的固定的是___________ (填序号)。
①工业合成氨
②雷雨天气N2与O2反应
③工业制硝酸的第一步反应:氨的催化氧化
写出上述反应①③的化学方程式:①___________ ,③___________ 。
(3)Fe2O3和铝粉常用于野外焊接钢轨,试写出其化学方程式:___________ 。
(4)检验 的离子方程式:
的离子方程式:___________ 。
(1)欲除去FeCl2溶液中的Fe3+,可向溶液中加少量
(2)下列属于氮的固定的是
①工业合成氨
②雷雨天气N2与O2反应
③工业制硝酸的第一步反应:氨的催化氧化
写出上述反应①③的化学方程式:①
(3)Fe2O3和铝粉常用于野外焊接钢轨,试写出其化学方程式:
(4)检验
 的离子方程式:
的离子方程式:
您最近半年使用:0次
9 . 沈阳市位于辽宁省东北部,是中国重要的工业城市之一、随着城市的不断发展和人口的增加,污水处理厂的作用也愈加重要。在垃圾清理、路面施工以及工厂废水排放等方面都会产生大量的废水。某Y形河流上游两旁有甲、乙两个化工厂,其位置如图所示。经某化学课外活动小组检测,已知它们排放的工业废水中,共含 ,
, 、
、 ,
, ,
, ,
, 六种离子。若甲、乙两厂分别含有不同的三种离子,请回答下列问题:
六种离子。若甲、乙两厂分别含有不同的三种离子,请回答下列问题:
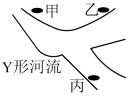
(1)经该小组检测,甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是___________ (填离子符号)。
(2)该小组认为,乙厂的废水中含有另外三种离子,如果加适量的___________ (填“活性炭”“硫酸亚铁”或“铁粉”),不但可以回收其中的一种金属,达到变废为宝的目的,还可以降低重金属离子污染,这个过程用离子方程式表示为___________ 。
(3)该小组有一个设想,建议甲厂和乙厂联合起来,把废水按适当比例混合,这样可以使废水中的___________ (填离子符号)结合转化为沉淀。再在丙地建立一个灌溉站,将过滤后的河水用来浇灌农田。他们的理由是经过滤后的废水主要含___________ (填化学式),可以促进农作物的生长,你认为他们的方案是否可行,并写出理由:___________ 。
 ,
, 、
、 ,
, ,
, ,
, 六种离子。若甲、乙两厂分别含有不同的三种离子,请回答下列问题:
六种离子。若甲、乙两厂分别含有不同的三种离子,请回答下列问题:
(1)经该小组检测,甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是
(2)该小组认为,乙厂的废水中含有另外三种离子,如果加适量的
(3)该小组有一个设想,建议甲厂和乙厂联合起来,把废水按适当比例混合,这样可以使废水中的
您最近半年使用:0次
名校
10 . 基础知识填空
(1)目前用途最广、使用量最大的合金是___________ 。
(2)重晶石的化学式为___________ 。
(3)除去 粉末中混有的少量
粉末中混有的少量 所涉及的反应的化学方程式为
所涉及的反应的化学方程式为___________ 。
(4)实验室中制备气体 的化学方程式为
的化学方程式为___________ ; 与氧气在红热的铂丝作用下的化学方程式为
与氧气在红热的铂丝作用下的化学方程式为___________ 。
(5)规范叙述-用实验方法证明某种白色晶体是
___________ 。
(6)将适量铁粉放入 溶液中,完全反应后,溶液中的
溶液中,完全反应后,溶液中的 和
和 浓度相等。则未反应的
浓度相等。则未反应的 和已反应的
和已反应的 的物质的量之比是
的物质的量之比是___________ 。
(1)目前用途最广、使用量最大的合金是
(2)重晶石的化学式为
(3)除去
 粉末中混有的少量
粉末中混有的少量 所涉及的反应的化学方程式为
所涉及的反应的化学方程式为(4)实验室中制备气体
 的化学方程式为
的化学方程式为 与氧气在红热的铂丝作用下的化学方程式为
与氧气在红热的铂丝作用下的化学方程式为(5)规范叙述-用实验方法证明某种白色晶体是

(6)将适量铁粉放入
 溶液中,完全反应后,溶液中的
溶液中,完全反应后,溶液中的 和
和 浓度相等。则未反应的
浓度相等。则未反应的 和已反应的
和已反应的 的物质的量之比是
的物质的量之比是
您最近半年使用:0次



