解题方法
1 . 攀枝花铁矿,探明储量的钒钛磁铁矿达近百亿吨,其中钒、钛储量分别占全国已探明储量的87%和94.3%,分别居世界第三位和第一位,有“世界钒钛之都”之称,是全国四大铁矿区之一,炼铁厂以磁铁矿石、焦炭、空气等为主要原料炼铁,主要反应过程如图所示:

请根据所学知识回答下列问题。
(1)磁铁矿的主要成分是___________ (填化学式),铁元素在元素周期表中位于第___________ 周期第___________ 族。
(2)生铁和钢相比,含碳量更高的是___________ 。
(3)原料中焦炭的作用是___________ 。写出反应③的化学方程式:___________ 。
(4)铁的化合物之一聚合硫酸铁[Fe2(OH)6-2n(SO4)n]m高铁酸盐均可用作水处理剂。以绿矾(FeSO4·7H2O)为原料,可制备聚合硫酸铁和高铁酸盐。
①为检验绿矾是否变质,可采取的操作方法是___________ 。
②取2ml FeSO4溶液于试管中,向其中滴加氢氧化钠溶液,观察到生成的白色沉淀迅速变为灰绿色, 最终变为红褐色,写出此过程中涉及的氧化还原反应的化学方程式:___________ 。已知在浓碱溶液中,NaClO能将Fe(OH)3,氧化为含FeO 的紫红色溶液,请写出该过程中发生反应的离子方程式:
的紫红色溶液,请写出该过程中发生反应的离子方程式:___________ 。

请根据所学知识回答下列问题。
(1)磁铁矿的主要成分是
(2)生铁和钢相比,含碳量更高的是
(3)原料中焦炭的作用是
(4)铁的化合物之一聚合硫酸铁[Fe2(OH)6-2n(SO4)n]m高铁酸盐均可用作水处理剂。以绿矾(FeSO4·7H2O)为原料,可制备聚合硫酸铁和高铁酸盐。
①为检验绿矾是否变质,可采取的操作方法是
②取2ml FeSO4溶液于试管中,向其中滴加氢氧化钠溶液,观察到生成的白色沉淀迅速变为灰绿色, 最终变为红褐色,写出此过程中涉及的氧化还原反应的化学方程式:
 的紫红色溶液,请写出该过程中发生反应的离子方程式:
的紫红色溶液,请写出该过程中发生反应的离子方程式:
您最近一年使用:0次
2 . 白硼钙石的主要成分是Ca4B10O19·7H2O(含有少量Fe2O3、FeO、CaCO3和SiO2等杂质),利用白硼钙石制取强还原剂NaBH4的工艺流程如下:
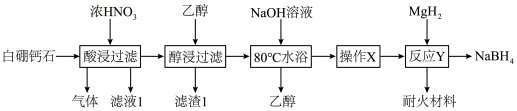
| A.“滤渣1”的主要成分是SiO2 |
| B.“气体”的主要成分是NO2 |
| C.“操作X”涉及到蒸发浓缩、降温结晶 |
D.“反应Y”的化学方程式是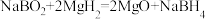 |
您最近一年使用:0次
2024-03-15更新
|
964次组卷
|
6卷引用:湖南省衡阳市衡阳县第一中学2023-2024学年高三下学期4月月考化学试题
湖南省衡阳市衡阳县第一中学2023-2024学年高三下学期4月月考化学试题河北省唐山市2023-2024学年高三一模化学试题河北省唐山市2024届高三一模化学试题河北省石家庄市第二中学2023-2024学年高三下学期质检二模拟化学试题湖南省常德市汉寿县第一中学2023-2024学年高三下学期4月月考化学试题(已下线)压轴题03?物质的制备、检验、分离与提纯(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
3 . 软锰矿(主要成分为 ,含有
,含有 、
、 、
、 等杂质)可以作为很多含锰化合物制备的工业原料,以其为原料制备
等杂质)可以作为很多含锰化合物制备的工业原料,以其为原料制备 (可表示为
(可表示为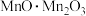 )的工艺流程如下图所示:
)的工艺流程如下图所示:

根据流程回答下列问题:
(1) 中锰元素的价态为
中锰元素的价态为___________ 。
(2)“酸浸、还原”步骤中,为加快浸取速率,可以采取的操作为___________ (至少写两条)。
(3)“氧化1”步骤中,加入 的目的是
的目的是___________ (用离子方程式表示)。
(4)“调节pH”步骤后,经过滤得到的滤渣中X的化学式为___________ 。
(5)请写出“沉锰”步骤的离子方程式:___________ 。
(6)实验表明,“沉锰”步骤中控制温度在50℃左右沉锰效果最好,温度不宜过高的原因是___________ 。
(7)“氧化2”步骤中,理论上消耗的氧化剂与还原剂的物质的量之比为___________ 。
 ,含有
,含有 、
、 、
、 等杂质)可以作为很多含锰化合物制备的工业原料,以其为原料制备
等杂质)可以作为很多含锰化合物制备的工业原料,以其为原料制备 (可表示为
(可表示为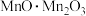 )的工艺流程如下图所示:
)的工艺流程如下图所示:
根据流程回答下列问题:
(1)
 中锰元素的价态为
中锰元素的价态为(2)“酸浸、还原”步骤中,为加快浸取速率,可以采取的操作为
(3)“氧化1”步骤中,加入
 的目的是
的目的是(4)“调节pH”步骤后,经过滤得到的滤渣中X的化学式为
(5)请写出“沉锰”步骤的离子方程式:
(6)实验表明,“沉锰”步骤中控制温度在50℃左右沉锰效果最好,温度不宜过高的原因是
(7)“氧化2”步骤中,理论上消耗的氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
名校
解题方法
4 . I.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中还原剂是___________ (填化学式)。
(2)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、 、Cl-、H2O。
、Cl-、H2O。
①请依据上述信息,写出并配平湿法制高铁酸钾的离子方程式:___________ 。
②每生成2mol 转移
转移___________ mol电子,若反应过程中转移了0.5mol电子,则还原产物的物质的量为___________ mol。
II.工业上用氯化铁腐蚀铜箔、制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:

回答下列问题:
(3)试剂a是___________ ,操作I用到的玻璃仪器有烧杯、玻璃棒和___________ 。
(4)滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为___________ 。
(5)上述流程中操作III包括___________ 、___________ 、过滤、洗涤。
(1)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中还原剂是
(2)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O。
、Cl-、H2O。①请依据上述信息,写出并配平湿法制高铁酸钾的离子方程式:
②每生成2mol
 转移
转移II.工业上用氯化铁腐蚀铜箔、制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:

回答下列问题:
(3)试剂a是
(4)滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为
(5)上述流程中操作III包括
您最近一年使用:0次
2023-07-15更新
|
367次组卷
|
2卷引用:湖南省衡阳市2022-2023学年高一下学期期末检测化学试题
解题方法
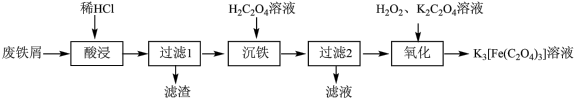
5 . 以废铁屑(含 及少量
及少量 )为原料制备
)为原料制备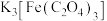 溶液的流程如下:
溶液的流程如下:
已知:①草酸 为二元弱酸
为二元弱酸
②常温下,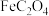 难溶于水。请回答相关问题:
难溶于水。请回答相关问题:
(1)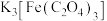 中
中 元素的化合价为
元素的化合价为_______ 。
(2)为了加快“酸浸”速率,可以采取的措施为_______ (任填一点)。
(3)“滤渣”的主要成分是_______ (填化学式)。
(4)“沉铁”时,生成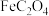 的离子方程式是
的离子方程式是_______ 。
(5)“氧化”时发生的反应为: 。该反应中氧化剂与还原剂的物质的量之比为
。该反应中氧化剂与还原剂的物质的量之比为_______ 。“氧化”结束后需要再加入适量草酸,其原因是_______ 。
(6)“过滤1”得到的滤液中的含铁盐与 反应可制备
反应可制备 ,同时可产生的气体为
,同时可产生的气体为_______ 。
 及少量
及少量 )为原料制备
)为原料制备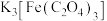 溶液的流程如下:
溶液的流程如下:
已知:①草酸
 为二元弱酸
为二元弱酸②常温下,
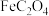 难溶于水。请回答相关问题:
难溶于水。请回答相关问题:(1)
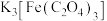 中
中 元素的化合价为
元素的化合价为(2)为了加快“酸浸”速率,可以采取的措施为
(3)“滤渣”的主要成分是
(4)“沉铁”时,生成
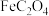 的离子方程式是
的离子方程式是(5)“氧化”时发生的反应为:
 。该反应中氧化剂与还原剂的物质的量之比为
。该反应中氧化剂与还原剂的物质的量之比为(6)“过滤1”得到的滤液中的含铁盐与
 反应可制备
反应可制备 ,同时可产生的气体为
,同时可产生的气体为
您最近一年使用:0次
名校
解题方法
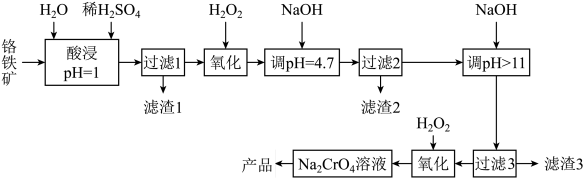
6 . 工业上铬铁矿主要成分为亚铬酸亚铁[Fe(CrO2)2],还含少量MgCO3、Al2O3、SiO2等杂质。以铬铁矿为原料制取铬酸钠(Na2CrO4)晶体,其工艺流程如图:
已知:a.+3价Cr在酸性溶液中性质稳定,当pH>9时,以CrO 形式存在且易被氧化。
形式存在且易被氧化。
b.常温下,氢氧化铁的Ksp=4.0×10-38、氢氧化镁的Ksp=1.8×10-11、氢氧化铝的Ksp=3.2×10-34。
(1)为了提高酸浸速率和反应充分,可以采取的措施有_____ (填两条)。
(2)滤渣2的主要成分为______ (写化学式)。
(3)流程中两次使用了H2O2,分别写出两次反应的离子方程式:_____ 。
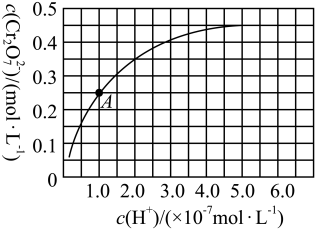
(4)产品铬酸钠溶于水后,CrO 和Cr2O
和Cr2O 在溶液中可相互转化。室温下,初始浓度为1.0mol•L-1的Na2CrO4溶液中c(Cr2O
在溶液中可相互转化。室温下,初始浓度为1.0mol•L-1的Na2CrO4溶液中c(Cr2O )随c(H+)的变化如图所示,用离子方程式表示Na2CrO4溶液中的转化反应:
)随c(H+)的变化如图所示,用离子方程式表示Na2CrO4溶液中的转化反应:_____ ,根据A点数据计算出该转化反应的平衡常数为_____ ,温度升高,溶液中CrO 的平衡转化率减小,则该反应的△H
的平衡转化率减小,则该反应的△H_____ (填“>”“<”或“=”)0。

已知:a.+3价Cr在酸性溶液中性质稳定,当pH>9时,以CrO
 形式存在且易被氧化。
形式存在且易被氧化。b.常温下,氢氧化铁的Ksp=4.0×10-38、氢氧化镁的Ksp=1.8×10-11、氢氧化铝的Ksp=3.2×10-34。
(1)为了提高酸浸速率和反应充分,可以采取的措施有
(2)滤渣2的主要成分为
(3)流程中两次使用了H2O2,分别写出两次反应的离子方程式:
(4)产品铬酸钠溶于水后,CrO
 和Cr2O
和Cr2O 在溶液中可相互转化。室温下,初始浓度为1.0mol•L-1的Na2CrO4溶液中c(Cr2O
在溶液中可相互转化。室温下,初始浓度为1.0mol•L-1的Na2CrO4溶液中c(Cr2O )随c(H+)的变化如图所示,用离子方程式表示Na2CrO4溶液中的转化反应:
)随c(H+)的变化如图所示,用离子方程式表示Na2CrO4溶液中的转化反应: 的平衡转化率减小,则该反应的△H
的平衡转化率减小,则该反应的△H
您最近一年使用:0次
2023-02-06更新
|
317次组卷
|
5卷引用:湖南省衡阳市第一中学2022-2023学年高三第七次月考化学试题
湖南省衡阳市第一中学2022-2023学年高三第七次月考化学试题湖南省长沙市第一中学2022-2023学年高三上学期月考(六)化学试题湖南省常德市第一中学2023届高三第五次月考化学试题湖南省郴州市第一中学2023届高三下学期第七次月考化学试题(已下线)预测卷04-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)
2022·河北·模拟预测
名校
解题方法
7 . 工业上以硼镁矿(主要成分为 ,还含有少量
,还含有少量 、
、 、
、 、
、 和
和 等)为原料生产硼酸晶体的工艺流程如图所示。
等)为原料生产硼酸晶体的工艺流程如图所示。
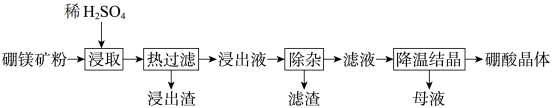
已知:① 的溶解度随温度的升高显著增大;
的溶解度随温度的升高显著增大;
② 、
、 、
、 和
和 以氢氧化物的形式完全沉淀时,溶液的
以氢氧化物的形式完全沉淀时,溶液的 分别为3.2、9.7、5.2和12.4。
分别为3.2、9.7、5.2和12.4。
下列说法错误的是
 ,还含有少量
,还含有少量 、
、 、
、 、
、 和
和 等)为原料生产硼酸晶体的工艺流程如图所示。
等)为原料生产硼酸晶体的工艺流程如图所示。
已知:①
 的溶解度随温度的升高显著增大;
的溶解度随温度的升高显著增大;②
 、
、 、
、 和
和 以氢氧化物的形式完全沉淀时,溶液的
以氢氧化物的形式完全沉淀时,溶液的 分别为3.2、9.7、5.2和12.4。
分别为3.2、9.7、5.2和12.4。下列说法错误的是
| A.“浸取”时要分批慢慢加入稀硫酸 |
B.“热过滤”的目的是防止温度降低时 从溶液中析出 从溶液中析出 |
C.“除杂”时需向“浸出液”中依次加入 和 和 溶液,以除去 溶液,以除去 、 、 、 、 等杂质离子 等杂质离子 |
| D.“母液”中的溶质主要是硫酸镁 |
您最近一年使用:0次
2023-01-20更新
|
656次组卷
|
8卷引用:湖南省衡阳八中2022-2023学年高三第四次月考化学试题
湖南省衡阳八中2022-2023学年高三第四次月考化学试题(已下线)2022年河北省新高考测评卷(一)(已下线)秘籍17 工艺流程的条件控制与计算-备战2022年高考化学抢分秘籍(全国通用)(已下线)专题14 物质的反应和转化-三年(2020-2022)高考真题分项汇编超重点7 金属与非金属交界处的3种重要元素湖南省常德市第一中学2022-2023学年高三下学期第六次月考化学试题湖南省攸县第一中学2023届高三第七次月考化学试题天津经济技术开发区第一中学(泰达一中)2023-2024学年高三上学期期中考试化学试卷
名校
解题方法
8 . 实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知Fe3+在pH=5时沉淀完全)。其中分析错误的是


| A.步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O |
| B.步骤②可用氯水、硝酸等强氧化剂代替H2O2 |
| C.步骤③用CuCO3代替CuO也可调节溶液的pH |
| D.步骤⑤的操作为:向漏斗中加入少量冷的蒸馏水至浸没晶体,待水自然流下,重复操作2~3次 |
您最近一年使用:0次
2022-10-18更新
|
216次组卷
|
18卷引用:2017届湖南衡阳八中高三实验班暑期第一次月考理综化学
2017届湖南衡阳八中高三实验班暑期第一次月考理综化学2015届湖北省武汉市高三五月模拟考试理综化学试卷2015-2016学年湖南二校高一理科实验班上联考2化学卷2017届江西省上高二中高三上第一次月考(开学考试)化学2016-2017学年云南省临沧一中高二上起点考试化学卷吉林省实验中学2016-2017学年高二下学期第二次月考(5月)化学试题江西省上饶县中学2018届高三上学期第一次月考化学试题四川省成都实验高级中学2020届高三上学期入学考试化学试题江西省上高县第二中学2020届高三上学期第二次月考化学试题江西省上饶市“山江湖”协作体2019-2020学年高一上学期期中联考化学(自主班)试题2019-2020学年人教版高中化学高考基础复习专题10《无机化学基础》测试卷2020届人教版本高三化学第一轮复习第十章《化学实验热点》测试卷2020届高中化学第一轮复习第十章《化学实验热点》测试卷B内蒙古壮族自治区乌兰察布市化德县第一中学2021届高三上学期期中考试化学试题广东省汕头市澄海中学2021届高三上学期第一次学段考试化学试题(已下线)第9周 周测卷-备战2022年高考化学周测与晚练(新高考专用)四川省广安市邻水县二中2022-2023学年高三上学期10月月考化学试题湖北省十堰市部分重点中学2022-2023学年高一下学期5月联考化学试题
9 . 某铬铁矿含有的主要成分是 还有
还有 等杂质,因此该矿石可以制备氧化铬(
等杂质,因此该矿石可以制备氧化铬( )颜料,该颜料性质稳定,有着橄榄绿色调。其工艺流程如下。
)颜料,该颜料性质稳定,有着橄榄绿色调。其工艺流程如下。
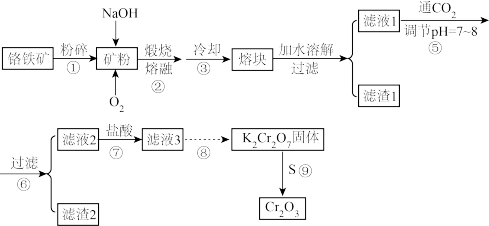
(1)实验室模拟过程②不可使用石英坩埚的原因是_______ ,杂质 在熔融状态下和NaOH和
在熔融状态下和NaOH和 的反应的化学方程式为
的反应的化学方程式为_______ 。
(2)过程④通常加入足量水并小火加热至沸腾此步操作的目的是_______ ,请列举滤渣1的一种用途:_______ 。
(3)过程⑤把pH由大调小,可以沉淀的离子为_______ ,过程⑦的离子方程式为_______ 。
(4)过程⑧为了获得纯净的 固体,其详细操作为
固体,其详细操作为_______ 、过滤、洗涤、干燥,该过程残留废弃液中存在的 具有较强毒性,可以将其处理为
具有较强毒性,可以将其处理为 ,再调节pH达到沉淀铬元素的目的。若用
,再调节pH达到沉淀铬元素的目的。若用 (焦亚硫酸钠)处理该废水,反应的离子方程式为
(焦亚硫酸钠)处理该废水,反应的离子方程式为_______ 。
(5)该铬铁矿含Cr元素的质量分数为33.6%,取100t该矿石,最终得到46.6t的 ,则
,则 的产率约为
的产率约为_______ (保留三位有效数字)。
 还有
还有 等杂质,因此该矿石可以制备氧化铬(
等杂质,因此该矿石可以制备氧化铬( )颜料,该颜料性质稳定,有着橄榄绿色调。其工艺流程如下。
)颜料,该颜料性质稳定,有着橄榄绿色调。其工艺流程如下。
(1)实验室模拟过程②不可使用石英坩埚的原因是
 在熔融状态下和NaOH和
在熔融状态下和NaOH和 的反应的化学方程式为
的反应的化学方程式为(2)过程④通常加入足量水并小火加热至沸腾此步操作的目的是
(3)过程⑤把pH由大调小,可以沉淀的离子为
(4)过程⑧为了获得纯净的
 固体,其详细操作为
固体,其详细操作为 具有较强毒性,可以将其处理为
具有较强毒性,可以将其处理为 ,再调节pH达到沉淀铬元素的目的。若用
,再调节pH达到沉淀铬元素的目的。若用 (焦亚硫酸钠)处理该废水,反应的离子方程式为
(焦亚硫酸钠)处理该废水,反应的离子方程式为(5)该铬铁矿含Cr元素的质量分数为33.6%,取100t该矿石,最终得到46.6t的
 ,则
,则 的产率约为
的产率约为
您最近一年使用:0次
名校
解题方法
10 . 以高硫铝土矿(主要成分为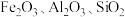 ,少量
,少量 和硫酸盐)为原料制备聚合硫酸铁
和硫酸盐)为原料制备聚合硫酸铁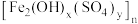 和明矾的部分工艺流程如下,下列说法错误的是
和明矾的部分工艺流程如下,下列说法错误的是
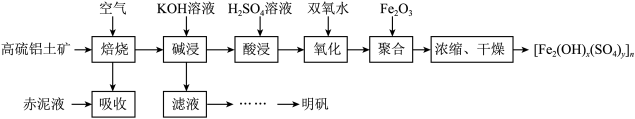
已知:赤泥液的主要成分为
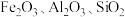 ,少量
,少量 和硫酸盐)为原料制备聚合硫酸铁
和硫酸盐)为原料制备聚合硫酸铁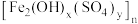 和明矾的部分工艺流程如下,下列说法错误的是
和明矾的部分工艺流程如下,下列说法错误的是
已知:赤泥液的主要成分为

A.赤泥液的作用是吸收“焙烧”阶段中产生的 |
B.聚合硫酸铁可用于净化自来水,与其组成中的 具有氧化性有关 具有氧化性有关 |
C.在“聚合”阶段,若增加 用量,会使 用量,会使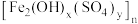 中x变小 中x变小 |
| D.从“滤液”到“明矾”的过程中还应有“除硅”步骤 |
您最近一年使用:0次
2022-05-12更新
|
828次组卷
|
7卷引用:湖南省常宁市第一中学2022届高三下学期第三次模拟考试化学试题
湖南省常宁市第一中学2022届高三下学期第三次模拟考试化学试题河南省大联考2022届高三上学期阶段性测试(一)化学试题(已下线)第二单元 化学物质及其变化(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)福建省龙岩第一中学2021-2022学年高三上学期第二次月考化学试题山西省怀仁市2021-2022学年高三上学期期中化学试题江西省景德镇市第一中学2021-2022学年高二上学期期末(重点班)化学试题湖南省郴州市第一中学2022届高三下学期期中考试化学试题



