2018·浙江·一模
名校
解题方法
1 . 为将含FeCl3、FeCl2、CuCl2的废液中的Cu2+还原回收,某同学在含有ag铁粉的容器中加入废液,探究了加入废液体积与完全反应后体系中固体质量的关系,部分实验数据如下表所示。已知:废液中c(Cu2+)=0.7mol·L-1;废液体积大于0.5L,充分反应后才能检测出Cu2+。
下列说法不正确 的是
| 废液体积/L | ≤0.5 | 1 | 2 | 3 | ≥4 |
| 固体质量/g | a | 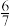 a a | 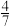 a a | 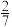 a a | 0 |
| A.当铁粉与0.25L废液反应完全后,固体成分为Fe与Cu |
| B.废液中c(Fe3+)=0.2mol·L-1 |
| C.要将1L废液中的Cu2+全部还原,则至少需要铁粉44.8g |
| D.当铁粉与1L废液反应完全后,再加入废液时发生的离子反应为:Fe+2Fe3+=3Fe2+ |
您最近一年使用:0次
2021-03-12更新
|
135次组卷
|
11卷引用:专题03 铁 金属材料-2023年高考化学一轮复习小题多维练(全国通用)
(已下线)专题03 铁 金属材料-2023年高考化学一轮复习小题多维练(全国通用)【省级联考】浙江省2018-2019学年高二上学期2019年1月学业水平考试化学试题2019-2020学年新新教材同步人教版高中化学必修第一册 (模块)质量检测高一必修第一册(鲁科2019)第3章 第1节 铁的多样性人教版(2019)高一必修第一册 第三章 铁 金属材料 第一节 铁及其化合物黑龙江省哈尔滨三中2021届高三上学期期中考试化学试题江西省景德镇一中2020-2021学年高一上学期期中考试化学(1班)试题(已下线)【浙江新东方】双师103(已下线)【浙江新东方】高中化学20210304-015湖南省邵阳市第二中学2023-2024学年高一上学期第二次月考化学试题浙江省瑞安中学2023-2024学年高一上学期12月月考化学试卷
20-21高一上·湖北荆州·期末
名校
解题方法
2 . 向一定量的Fe、Fe2O3和CuO混合物投入100mL 0.9mol/L的硫酸溶液中,充分反应后生成448mL标准状况下的气体,得不溶物0.03mol。向滤液中加入2mol/L的NaOH溶液,加至10mL时开始出现沉淀。忽略溶液的体积变化,下列说法不正确的
| A.0.03mol不溶物全为Cu | B.混合物中氧原子的物质的量为0.05mol |
| C.滤液中的阳离子只有两种 | D.滤液中的Fe2+的物质的量浓度为0.8mol/L |
您最近一年使用:0次
2021-02-02更新
|
1341次组卷
|
8卷引用:专题讲座(一) 化学计算的常用方法(精练)-2022年高考化学一轮复习讲练测
(已下线)专题讲座(一) 化学计算的常用方法(精练)-2022年高考化学一轮复习讲练测湖北省沙市中学2020-2021学年高一上学期期末考试化学试题(已下线)3.1.2 不同价态铁元素之间的转化-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)江西省景德镇一中2022-2023学年高一上学期期中考试(19班)化学试题湖北省武汉市第六中学2021-2022学年高一上学期12月月考化学试题重庆市南开中学2022-2023学年高一上学期12月定时练习化学试题湖南省邵阳市第二中学2023-2024学年高一下学期第一次月考化学试题福建师范大学附属中学2021-2022学年高一下学期期末考试化学试题
20-21高二上·陕西汉中·阶段练习
解题方法
3 . 某兴趣小组用Fe3+与I-间的反应探究氧化还原反应规律与平衡移动原理的关系,回答下列问题:
(1)用Fe2(SO4)3晶体配制100 mL 0.05 mol/L的溶液,配制时需先把Fe2(SO4)3晶体溶解在较浓的硫酸中,再用水稀释,加入硫酸的目的是_____ (结合化学方程式回答)。
(2)甲组同学将0.10 mol/L的KI溶液和0.05 mol/L的Fe2(SO4)3溶液各5 mL混合充分反应后,溶液变为棕黄色,现进行如下实验①②。
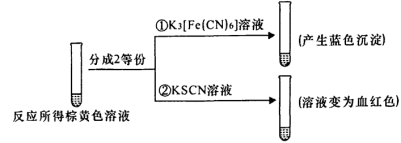
实验①中产生蓝色沉淀的离子方程式为_______ ,根据以上反应现象写出甲组同学实验中的离子方程式:_______ ,在甲组同学的反应中,I2和Fe3+的氧化性强弱顺序为_______ 。
(1)用Fe2(SO4)3晶体配制100 mL 0.05 mol/L的溶液,配制时需先把Fe2(SO4)3晶体溶解在较浓的硫酸中,再用水稀释,加入硫酸的目的是
(2)甲组同学将0.10 mol/L的KI溶液和0.05 mol/L的Fe2(SO4)3溶液各5 mL混合充分反应后,溶液变为棕黄色,现进行如下实验①②。

实验①中产生蓝色沉淀的离子方程式为
您最近一年使用:0次
20-21高一上·广东深圳·期末
4 . FeCl3溶液作为腐蚀液制作印刷电路板的原理是,将预先设计好的电路在覆铜板上用蜡覆盖,再把覆铜板放在FeCl3溶液浸泡,蜡没有覆盖到的铜会发生腐蚀反应而溶解,可制得印刷电路板,下列说法不正确的是
| A.FeCl3溶液能与铜反应,与蜡不反应 |
| B.腐蚀反应既是离子反应又是氧化还原反应 |
| C.腐蚀反应说明Cu的还原性比Fe2+强 |
| D.向腐蚀反应后溶液加入一定量铁粉,充分反应后,有固体存在,此时溶液一定不含Fe3+、Cu2+ |
您最近一年使用:0次
2021·河北·模拟预测
5 . 硫化镍矿的主要成分是 ,还含有
,还含有 、
、 、一些不溶性物质等,工业上用硫化镍矿制备金属镍的工艺流程如图所示:
、一些不溶性物质等,工业上用硫化镍矿制备金属镍的工艺流程如图所示:
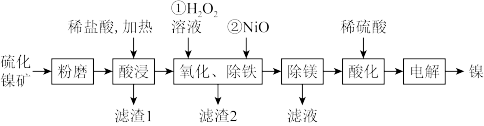
(1)硫化镍矿粉磨的目的是_______ ,“酸浸”时,硫化镍与稀盐酸反应的化学方程式为_______ 。
(2)“氧化、除铁”过程中加入 溶液时,发生反应的离子方程式为
溶液时,发生反应的离子方程式为_______ ;加入氧化镍的目的是除去铁元素,用化学平衡移动原理解释除去铁元素的原因_______ 。
(3)已知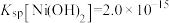 ,
,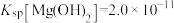 ,若“除镁”后的滤液中
,若“除镁”后的滤液中 的浓度不大于
的浓度不大于 ,则滤液中
,则滤液中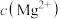 ≤
≤_______ 。
(4)电解硫酸镍溶液时,在_______ 极得到镍单质,电解产物_______ (填化学式)可以循环使用。
 ,还含有
,还含有 、
、 、一些不溶性物质等,工业上用硫化镍矿制备金属镍的工艺流程如图所示:
、一些不溶性物质等,工业上用硫化镍矿制备金属镍的工艺流程如图所示:
(1)硫化镍矿粉磨的目的是
(2)“氧化、除铁”过程中加入
 溶液时,发生反应的离子方程式为
溶液时,发生反应的离子方程式为(3)已知
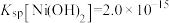 ,
,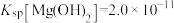 ,若“除镁”后的滤液中
,若“除镁”后的滤液中 的浓度不大于
的浓度不大于 ,则滤液中
,则滤液中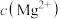 ≤
≤(4)电解硫酸镍溶液时,在
您最近一年使用:0次
19-20高一下·湖南常德·阶段练习
解题方法
6 . 下列物质反应后一定有+3价铁生成的是
①过量的Fe与Cl2反应;②Fe与过量稀硫酸反应;③FeCl2溶液中通入少量Cl2;④Fe和Fe2O3的混合物溶于盐酸中
①过量的Fe与Cl2反应;②Fe与过量稀硫酸反应;③FeCl2溶液中通入少量Cl2;④Fe和Fe2O3的混合物溶于盐酸中
| A.只有① | B.①③ |
| C.①②③ | D.①③④ |
您最近一年使用:0次
名校
解题方法
7 . 已知氧化性:Fe3+>Cu2+,现向1L含有0.1molFe2(SO4)3和0.2molCuCl2的某混合溶液中加入0.2molFe,充分反应后(忽略溶液体积变化),下列说法正确的是
| A.析出0.2molCu | B.剩余0.1molFe |
| C.溶液中c(Fe2+)=0.4mol·L-1 | D.反应后溶液中c(Fe2+)∶c(Cu2+)=1∶1 |
您最近一年使用:0次
2021-01-06更新
|
249次组卷
|
12卷引用:夯基提能2020届高三化学选择题对题专练——氧化还原反应的综合分析(基础过关)
夯基提能2020届高三化学选择题对题专练——氧化还原反应的综合分析(基础过关)2020届高三化学无机化学二轮专题复习——铁及其化合物的相关计算2【精编24题】2020届高三化学无机化学二轮专题复习——铁及其化合物的相互转化【精编25题】湖南省长沙市第一中学2017-2018学年高一上学期期中考试化学试题【全国百强校】河北省辛集中学2018-2019学年高一上学期期中考试化学试题河南省新乡市辉县市第一高级中学2018-2019学年高一上学期第二次阶段性考试化学试题鲁科版(2019)高一必修第一册第三章第1节 铁的多样性 课时2 铁及其化合物之间的转化关系(已下线)湖北省宜昌市葛洲坝中学2018-2019学年高一上学期期末考试化学试题河南省驻马店新蔡高中2020-2021学年高一上学期阶段性检测(三)化学试题陕西省咸阳市实验中学2020-2021学年高一上学期第四次月考化学试题吉林省长春市第二实验中学2021-2022学年高一上学期期中考试化学试题辽宁省丹东市凤城市第一中学2021-2022学年高一上学期11月月考化学试题
20-21高三上·广东广州·阶段练习
名校
8 . 下列离子方程式与所述事实相符且正确的是
A.用草酸钠为标准液,通过氧化还原滴定来测定高锰酸钾溶液的浓度,其反应的离子方程式为:5C2O +2MnO +2MnO +16H+=2Mn2++10CO2↑+8H2O +16H+=2Mn2++10CO2↑+8H2O |
| B.Fe(OH)3固体溶于HI溶液:Fe(OH)3+3H+=Fe3++3H2O |
C.向NaHSO4中滴入Ba(OH)2溶液至恰好显中性:H++ +Ba2++OH-=H2O+BaSO4↓ +Ba2++OH-=H2O+BaSO4↓ |
D.向明矾溶液中加入Ba(OH)2溶液至生成沉淀的物质的量最多:Al3++2 +2Ba2++4OH-= AlO +2Ba2++4OH-= AlO +2BaSO4↓+2H2O +2BaSO4↓+2H2O |
您最近一年使用:0次
20-21高三·广东·阶段练习
解题方法
9 . 铋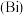 与氮同主族,在中性及碱性环境下常以
与氮同主族,在中性及碱性环境下常以 的形式存在,铋及其化合物广泛应用于电子、医药等领域。以辉铋矿(主要成分为
的形式存在,铋及其化合物广泛应用于电子、医药等领域。以辉铋矿(主要成分为 ,含少量杂质
,含少量杂质 等)为原料,采用湿法治金制备精铋工艺流程如下,下列说法错误的是
等)为原料,采用湿法治金制备精铋工艺流程如下,下列说法错误的是

 与氮同主族,在中性及碱性环境下常以
与氮同主族,在中性及碱性环境下常以 的形式存在,铋及其化合物广泛应用于电子、医药等领域。以辉铋矿(主要成分为
的形式存在,铋及其化合物广泛应用于电子、医药等领域。以辉铋矿(主要成分为 ,含少量杂质
,含少量杂质 等)为原料,采用湿法治金制备精铋工艺流程如下,下列说法错误的是
等)为原料,采用湿法治金制备精铋工艺流程如下,下列说法错误的是
A.“浸出”产生S的主要离子反应为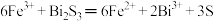 |
| B.“浸出”时盐酸可以还原杂质PbO2 |
| C.“浸出、置换、再生、电解精炼”工序中不全是氧化还原反应 |
| D.再生液可以加入“浸出”操作中循环利用 |
您最近一年使用:0次
2020-12-15更新
|
677次组卷
|
4卷引用:押山东卷第09题 化工生产流程选择题-备战2021年高考化学临考题号押题(山东卷)
(已下线)押山东卷第09题 化工生产流程选择题-备战2021年高考化学临考题号押题(山东卷)广东省2021届高三“六校联盟”第二次联考化学试卷湖南省岳阳市2021届高三二模考试化学试题江苏省(天一中学.海门中学.姜堰中学.淮阴中学)四校2021届高三4月联考化学试题
2014·湖南长沙·二模
名校
10 . 在混合体系中,确认化学反应先后顺序有利于解决问题,下列反应先后顺序判断正确的是( )
| A.在含FeBr2、FeI2的溶液中缓慢通入Cl2:I-,Br-,Fe2+ |
| B.在含Fe3+,Cu2+、H+的溶液中加入Zn:Fe3+,Cu2+、H+、Fe2+ |
| C.在含Ba(OH)2、KOH的溶液中通入CO2:KOH,Ba(OH)2,BaCO3、K2CO3 |
D.在含[Al(OH)4]-、OH-,CO 溶液中,逐滴加入盐酸:[Al(OH)4]-、Al(OH)3、OH-、CO 溶液中,逐滴加入盐酸:[Al(OH)4]-、Al(OH)3、OH-、CO |
您最近一年使用:0次
2020-12-07更新
|
236次组卷
|
25卷引用:黄金30题系列 高三化学 小题易丢分
(已下线)黄金30题系列 高三化学 小题易丢分(已下线)考点04 离子反应——备战2019年浙江新高考化学考点(已下线)2013-2014湖南省长沙市高三高考二模理综化学试卷2016届湖南省长沙市雅礼中学高三上学期月考化学试卷2016届重庆市万州第二高级中学高三11月月考理科综合化学试卷2016届江西省宜春市丰城中学高三上学期第四次月考化学试卷2017届河北省唐山一中高三上10月月考化学试卷2016-2017学年河北省武邑中学高二上学期期末考试化学试卷江西省抚州市临川区第一中学2018届高三上学期第一次月考化学试题福建省三明市第一中学2018届高三上学期期中考试化学试题黑龙江省哈尔滨师范大学附属中学2018届高三10月月考化学试题【全国百强校】黑龙江省哈尔滨师范大学附属中学2019届高三上学期开学考试化学试题河北省石家庄第二中学2019届高三上学期9月月考化学试题【全国百强校】山东省济南市历城第二中学2019届高三上学期11月月考理科综合化学试题安徽省定远重点中学2019届高三上学期第三次月考化学试题甘肃省武威第一中学2019届高三上学期期末考试化学试题江西省南昌市第十中学2020届高三上学期期中考试化学试题福建省厦门双十中学2018届高三期中考试化学试题(已下线)考点03 氧化还原反应-2020年【衔接教材·暑假作业】新高三一轮复习化学安徽省安庆市宜秀区白泽湖中学2021届高三上学期入学考试化学试题内蒙古自治区呼和浩特市和林格尔县第一中学2018-2019学年高二上学期第一次月考化学试题江西省丰城市第九中学2020届高三上学期期中考试化学试题安徽省淮北市孙疃中学2020-2021学年高二上学期第一次月考化学(实验班)试题福建省泰宁第一中学2020届高三上学期第二次阶段考试化学试题青海省湟川中学2020-2021学年高一下学期开学考试化学试题



