20-21高三上·黑龙江牡丹江·开学考试
名校
解题方法
1 . 500 mL 2 mol·L-1FeCl3溶液和500 mL 2 mol·L-1明矾溶液分别滴入沸水中,加热制成分散系甲、乙,经测定,甲分散系中分散质的粒子直径大小在1~100 nm之间,乙分散系中分散质的粒子直径大小在10-9~10-7m之间。下列关于甲、乙分散系的判断合理的是( )
| A.向甲、乙中分别滴加过量的氢碘酸,最终现象分别是深褐色溶液、白色沉淀 |
| B.向甲、乙中分别滴加过量的氢氧化钠溶液,现象都是“先聚沉,后溶解” |
| C.在暗室里用一束明亮的“强光”照射甲、乙,发现甲、乙均有丁达尔效应 |
| D.根据丁达尔现象可以将分散系分为溶液、胶体和浊液 |
您最近一年使用:0次
19-20高二下·辽宁大连·阶段练习
解题方法
2 . 利用硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)生产铁基颜料铁黄(FeOOH)的制备流程如下:
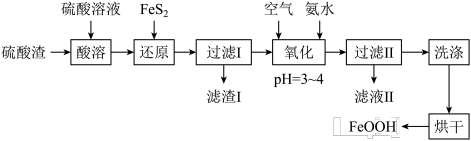
(1)“酸溶”时,Fe2O3与硫酸反应的离子方程式为___________________ 。
(2)滤渣I的主要成分是FeS2、S和___________ (填化学式);Fe3+被FeS2还原的离子方程式为_______________ 。
(3)“氧化”中,生成FeOOH的离子方程式为_______________ 。

(1)“酸溶”时,Fe2O3与硫酸反应的离子方程式为
(2)滤渣I的主要成分是FeS2、S和
(3)“氧化”中,生成FeOOH的离子方程式为
您最近一年使用:0次
19-20高二下·河南焦作·期末
3 . 某化学兴趣小组设计如下两个实验证明:①氧化性:Fe3+>I2,②反应2Fe3++2I-=2Fe2++I2为可逆反应,下列说法中错误的是
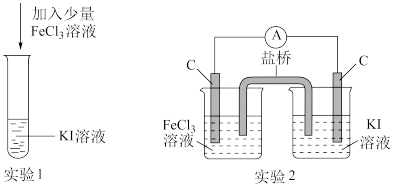

| A.实验1试管中加入淀粉后溶液变蓝,该条件下氧化性:Fe3+>I2 |
| B.实验2中最后电流表指针不再偏转可证明上述反应为可逆反应 |
| C.实验1反应结束后,向试管中加入KSCN能判断该反应是否为可逆反应 |
| D.实验2电流表指针不再偏转时,向右侧烧杯中加入单质碘可判断该反应是否为可逆反应 |
您最近一年使用:0次
19-20高三上·北京房山·期末
名校
解题方法
4 . 某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
下列说法不正确的是( )
| 序号 | I | II | III |
| 实验步骤 | 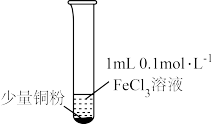 充分振荡,加2mL蒸馏水 |  充分振荡,加入2mL蒸馏水 | 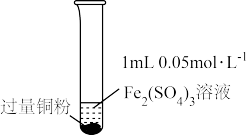 充分振荡,加入2mL蒸馏水 |
| 实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去, 变成蓝色,加入蒸馏水后无白色沉淀 |
| A.实验I、II、III中均发生了反应2Fe3++Cu=2Fe2++Cu2+ |
| B.对比实验I、II、III说明白色沉淀的产生可能与铜粉的量及溶液的阴离子种类有关 |
| C.实验I、III中加入蒸馏水后c(Cu2+)相同 |
| D.向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀 |
您最近一年使用:0次
2020-07-06更新
|
220次组卷
|
7卷引用:第7讲 铁及其化合物-2021年高考化学一轮复习名师精讲练
19-20高二下·北京顺义·期末
解题方法
5 . 某校化学兴趣小组探究SO2与FeCl3溶液的反应,装置如下图所示。
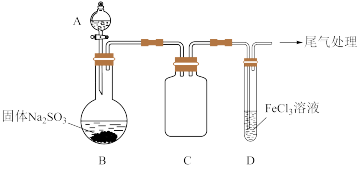
已知:
i.Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。
ii.生成Fe(HSO3)2+离子的反应为:Fe3+ +HSO ⇌Fe(HSO3)2+。
⇌Fe(HSO3)2+。
步骤一:实验准备:
如上图连接装置,并配制100mL 1.0 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管D 中。
(1)配制100mL1.0 mol·L-1 FeCl3溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和______ ,装置C的作用为:________________ 。
(2)用离子方程式解释1.0 mol·L-1 FeCl3溶液(未用盐酸酸化)pH=1的原因:________
步骤二:预测实验
(3)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色。
该小组同学预测的理论依据为:________________
步骤三:动手实验
(4)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,将混合液放置12小时,溶液才变成浅绿色。
①SO2与FeCl3溶液反应生成了Fe(HSO3)2+离子的实验证据为:__________ 。证明浅绿色溶液中含有Fe2+的实验操作为:_____________ 。
②为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了如下实验。
综合上述实验探究过程,得出的结论为:____________ 。
步骤四:反思实验:
(5)在制备SO2的过程中,同学们发现,使用70%的硫酸比用98%的浓硫酸反应速率快,分析其中的原因是_________ 。

已知:
i.Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。
ii.生成Fe(HSO3)2+离子的反应为:Fe3+ +HSO
 ⇌Fe(HSO3)2+。
⇌Fe(HSO3)2+。步骤一:实验准备:
如上图连接装置,并配制100mL 1.0 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管D 中。
(1)配制100mL1.0 mol·L-1 FeCl3溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和
(2)用离子方程式解释1.0 mol·L-1 FeCl3溶液(未用盐酸酸化)pH=1的原因:
步骤二:预测实验
(3)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色。
该小组同学预测的理论依据为:
步骤三:动手实验
(4)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,将混合液放置12小时,溶液才变成浅绿色。
①SO2与FeCl3溶液反应生成了Fe(HSO3)2+离子的实验证据为:
②为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了如下实验。
| 实验I | 往5mL1mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色。 |
| 实验II | 往5mL重新配制的1mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 |
综合上述实验探究过程,得出的结论为:
步骤四:反思实验:
(5)在制备SO2的过程中,同学们发现,使用70%的硫酸比用98%的浓硫酸反应速率快,分析其中的原因是
您最近一年使用:0次
19-20高二下·黑龙江哈尔滨·阶段练习
名校
解题方法
6 . 下表中离子方程式及其评价均合理的是( )
| 选项 | 化学反应及离子方程式 | 评价 |
| A | 氧化亚铁溶于稀硝酸FeO+2H+=Fe2++H2O | 碱性氧化物与酸反应生成盐和水,正确 |
| B | 向亚硫酸铵溶液中加少量氢氧化钡溶液Ba2++SO =BaSO3↓ =BaSO3↓ | 复分解反应,有沉淀生成,正确 |
| C | 含nmolFeBr2的溶液中通入nmolCl2完全反应:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | 氧化还原反应离子方程式满足元素守恒、电子守恒、电荷守恒,正确 |
| D | 氯化铁溶液中滴入硫氰化钾溶液:Fe3++3SCN-=Fe(SCN)3 | 复分解反应,无气体生成,无沉淀生成,不正确 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020·北京海淀·三模
名校
解题方法
7 . 近年来我国在天然气脱硫研究方面取得了新进展,利用如图1装置可完成天然气脱硫,甲池中发生反应如图2所示。

下列关于该装置工作原理的说法中,正确的是( )

下列关于该装置工作原理的说法中,正确的是( )
| A.碳棒为该脱硫装置的负极 |
| B.乙池中发生的反应为:H2S+2e-=S+2H+ |
| C.AQ与H2AQ间的转化属于非氧化还原反应 |
D.除I /I-外,Fe3+/Fe2+也能实现如图所示循环过程 /I-外,Fe3+/Fe2+也能实现如图所示循环过程 |
您最近一年使用:0次
2020-06-28更新
|
790次组卷
|
4卷引用:第18讲 原电池 化学电源(精练)-2022年高考化学一轮复习讲练测
(已下线)第18讲 原电池 化学电源(精练)-2022年高考化学一轮复习讲练测北京市海淀区十一学校2020届高三教与学质量诊断(三模) 化学试题河南省实验中学2020-2021学年高二上学期期中考试化学试题山东省济南市西城实验学校2021届高三下学期3月月考化学试题
2020·江苏扬州·三模
解题方法
8 . 下列指定反应的离子方程式正确的是
A.向NaClO溶液中通入过量CO2:ClO-+ CO2 + H2O = HClO + HCO |
| B.向FeCl3溶液中加入铜粉:Fe3+ + Cu = Fe2+ + Cu2+ |
C.用NaOH溶液吸收NO2:2OH-+ 2NO2 = 2NO + H2O + H2O |
| D.向AlCl3溶液中滴加氨水:Al3+ + 3OH-=Al(OH)3↓ |
您最近一年使用:0次
2020·山东·模拟预测
解题方法
9 . 下列对实验事实的解释错误的是( )
| 选项 | 实验事实 | 解释 |
| A | 实验室用粗锌与稀盐酸反应制H2比纯锌快 | 粗锌与稀盐酸构成原电池 |
| B | 浓硝酸保存在棕色试剂瓶中 | 4HNO3 2H2O+4NO2↑+O2↑ 2H2O+4NO2↑+O2↑ |
| C | 向10mL0.2mol·L-1ZnSO4,溶液中加入10mL0.4mol·L-1Na2S溶液,产生白色沉淀,再滴加CuSO4溶液,沉淀变黑 | Ksp(CuS)<Ksp(ZnS) |
| D | 做过银镜反应的试管可用铁盐溶液洗涤,加入稀盐酸,清洗效果更好 | Fe3++Ag Fe2++Ag+,加入盐酸,Ag+与Cl-结合成氯化银沉淀,使平衡右移 Fe2++Ag+,加入盐酸,Ag+与Cl-结合成氯化银沉淀,使平衡右移 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
10 . 某小组同学以不同方案探究Cu粉与FeCl3溶液的反应。
(1)甲同学向FeCl3溶液中加入Cu粉,观察到溶液的颜色变为浅蓝色,由此证明发生了反应,其离子方程式是__ 。
(2)乙同学通过反应物的消耗证明了上述反应的发生:将Cu粉加入到滴有少量KSCN的FeCl3溶液中,观察到溶液红色褪色,有白色沉淀A产生。
针对白色沉淀A,查阅资料:A可能为CuCl和CuSCN(其中硫元素的化合价为-2价)中的一种或两种。实验过程如下:
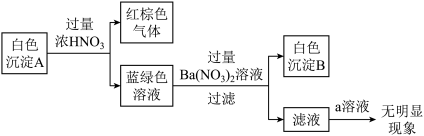
请回答:
①根据白色沉淀B是__ (填化学式),判断沉淀A中一定存在CuSCN。
②仅根据白色沉淀A与过量浓HNO3反应产生的实验现象,不能判断白色沉淀A中一定存在CuSCN,从氧化还原角度说明理由:__ 。
③向滤液中加入a溶液后无明显现象,说明A不含CuCl,则a是__ (填化学式)。
根据以上实验,证明A仅为CuSCN。
④进一步查阅资料并实验验证了CuSCN的成因,将该反应的方程式补充完整:
_ Cu2++_ SCN-=_ CuSCN↓+_ (SCN)2
⑤结合上述过程以及Fe(SCN)3 Fe3++3SCN-的平衡,分析(2)中溶液红色褪去的原因:
Fe3++3SCN-的平衡,分析(2)中溶液红色褪去的原因:__ 。
(3)已知(SCN)2称为拟卤素,其氧化性与Br2相近。将KSCN溶液滴入(1)所得的溶液中,观察到溶液变红色,则溶液变红的可能原因是__ 或__ 。
(1)甲同学向FeCl3溶液中加入Cu粉,观察到溶液的颜色变为浅蓝色,由此证明发生了反应,其离子方程式是
(2)乙同学通过反应物的消耗证明了上述反应的发生:将Cu粉加入到滴有少量KSCN的FeCl3溶液中,观察到溶液红色褪色,有白色沉淀A产生。
针对白色沉淀A,查阅资料:A可能为CuCl和CuSCN(其中硫元素的化合价为-2价)中的一种或两种。实验过程如下:

请回答:
①根据白色沉淀B是
②仅根据白色沉淀A与过量浓HNO3反应产生的实验现象,不能判断白色沉淀A中一定存在CuSCN,从氧化还原角度说明理由:
③向滤液中加入a溶液后无明显现象,说明A不含CuCl,则a是
根据以上实验,证明A仅为CuSCN。
④进一步查阅资料并实验验证了CuSCN的成因,将该反应的方程式补充完整:
⑤结合上述过程以及Fe(SCN)3
 Fe3++3SCN-的平衡,分析(2)中溶液红色褪去的原因:
Fe3++3SCN-的平衡,分析(2)中溶液红色褪去的原因:(3)已知(SCN)2称为拟卤素,其氧化性与Br2相近。将KSCN溶液滴入(1)所得的溶液中,观察到溶液变红色,则溶液变红的可能原因是
您最近一年使用:0次
2020-04-27更新
|
321次组卷
|
5卷引用:2020届高三化学二轮冲刺新题专练——卤素互化物、拟卤素



