1 . 某固体粉末可能含有KCl、K2CO3、Ba(NO3)2、CuSO4和Na2SO4,进行如下实验:
①取固体粉末加足量的水,振荡,有白色沉淀生成;
②向此悬浊液中加稀盐酸,沉淀不溶解,过滤,得到无色滤液;
③取无色滤液,滴加AgNO3溶液,产生白色沉淀。
依据实验现象,下列关于固体粉末的判断正确的是
| A.可能含K2CO3和CuSO4 |
| B.可能含KCl,一定含Ba(NO3)2和Na2SO4 |
| C.一定含KCl、Ba(NO3)2和Na2SO4 |
| D.一定含Ba(NO3)2、Na2SO4和K2CO3 |
您最近一年使用:0次
2024-01-20更新
|
184次组卷
|
4卷引用:北京市西城区2023-2024学年高一上学期期末考试化学试卷
名校
2 . 要证明 溶液显蓝色不是由于
溶液显蓝色不是由于 造成的,下列实验无意义的是
造成的,下列实验无意义的是
 溶液显蓝色不是由于
溶液显蓝色不是由于 造成的,下列实验无意义的是
造成的,下列实验无意义的是A.观察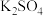 溶液的颜色 溶液的颜色 |
B.加水稀释 或溶液,溶液的颜色变浅 或溶液,溶液的颜色变浅 |
C.向 溶液中滴加过量的NaOH溶液,振荡后静置,溶液变成无色 溶液中滴加过量的NaOH溶液,振荡后静置,溶液变成无色 |
D.向 溶液中滴加过量的 溶液中滴加过量的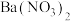 溶液,振荡后静置,溶液仍为蓝色 溶液,振荡后静置,溶液仍为蓝色 |
您最近一年使用:0次
名校
解题方法
3 . 为证明 溶液显蓝色与
溶液显蓝色与 有关而与
有关而与 无关,某同学设计了下列实验,其中对实验目的没有意义的是:
无关,某同学设计了下列实验,其中对实验目的没有意义的是:
①观察稀硫酸颜色
②观察无水硫酸铜粉末颜色
③稀释 溶液,观察溶液蓝色变化
溶液,观察溶液蓝色变化
④往 溶液中滴加少量NaOH溶液,生成蓝色沉淀,过滤,观察滤液颜色变化
溶液中滴加少量NaOH溶液,生成蓝色沉淀,过滤,观察滤液颜色变化
⑤往 溶液中滴加足量
溶液中滴加足量 溶液,生成白色沉淀,过滤,观察滤液颜色变化
溶液,生成白色沉淀,过滤,观察滤液颜色变化
 溶液显蓝色与
溶液显蓝色与 有关而与
有关而与 无关,某同学设计了下列实验,其中对实验目的没有意义的是:
无关,某同学设计了下列实验,其中对实验目的没有意义的是:①观察稀硫酸颜色
②观察无水硫酸铜粉末颜色
③稀释
 溶液,观察溶液蓝色变化
溶液,观察溶液蓝色变化④往
 溶液中滴加少量NaOH溶液,生成蓝色沉淀,过滤,观察滤液颜色变化
溶液中滴加少量NaOH溶液,生成蓝色沉淀,过滤,观察滤液颜色变化⑤往
 溶液中滴加足量
溶液中滴加足量 溶液,生成白色沉淀,过滤,观察滤液颜色变化
溶液,生成白色沉淀,过滤,观察滤液颜色变化| A.①②④ | B.②③④ | C.②③⑤ | D.①④⑤ |
您最近一年使用:0次
名校
4 . 秦始皇兵马俑是世界文化遗产,兵马俑表面的彩绘体现了当时彩绘工艺和颜料制作工艺水平,具有极高的历史价值和艺术价值。下列对于兵马俑使用颜料的主要成分与其类别的对应关系正确的是


| 选项 | A | B | C | D |
| 颜色 | 绿色 | 棕红色 | 大红色 | 黑色 |
| 主要成分 | 石绿 | 赭石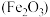 | 朱砂( ) ) | 炭黑(C) |
| 类别 | 碱 | 酸性氧化物 | 电解质 | 有机物 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-07-16更新
|
347次组卷
|
3卷引用:北京市中国人民大学附属中学2022-2023学年高一下学期期末考试化学试题
名校
5 . 兴趣小组通过实验探究溶解铜的方法和本质。
(1)将铜粉分别加到稍过量的氯化铁溶液和硫酸铁溶液中,铜粉溶解,溶液变成浅绿色,两个反应的共同点是(用离子方程式表示)_______ 。
(2)在热水浴中进行4个实验,部分实验报告如下表所示。
①实验操作Ⅲ是_______ 。
②实验I、Ⅱ、Ⅲ的目的是_______ 。
③实验Ⅳ中反应的本质是(用离子方程式表示)_______ 。
(3)将铜粉加到混有硫酸的过氧化氢溶液中,溶液逐渐变成蓝色,该反应的离子方程式是_______ 。
(1)将铜粉分别加到稍过量的氯化铁溶液和硫酸铁溶液中,铜粉溶解,溶液变成浅绿色,两个反应的共同点是(用离子方程式表示)
(2)在热水浴中进行4个实验,部分实验报告如下表所示。
| 序号 | 实验操作 | 实验现象 |
| Ⅰ | 稀硫酸中加入铜片 | 无明显变化 |
| Ⅱ | 硝酸钠溶液中加入铜片 | 无明显变化 |
| Ⅲ | 无明显变化 | |
| Ⅳ | 稀硫酸中加入硝酸钠溶液 | 无明显变化 |
| 再加入铜片 | 有无色气泡;溶液变蓝 |
②实验I、Ⅱ、Ⅲ的目的是
③实验Ⅳ中反应的本质是(用离子方程式表示)
(3)将铜粉加到混有硫酸的过氧化氢溶液中,溶液逐渐变成蓝色,该反应的离子方程式是
您最近一年使用:0次
名校
6 . 以反应 为例,探究影响平衡移动的因素。取相同浓度的
为例,探究影响平衡移动的因素。取相同浓度的 溶液,分别进行下列实验,对实验现象的分析
溶液,分别进行下列实验,对实验现象的分析不正确 的是
 为例,探究影响平衡移动的因素。取相同浓度的
为例,探究影响平衡移动的因素。取相同浓度的 溶液,分别进行下列实验,对实验现象的分析
溶液,分别进行下列实验,对实验现象的分析| 操作和现象 | 分析 | |
| A | 观察溶液为绿色 | 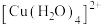 和 和 同时存在 同时存在 |
| B | 升高温度,溶液变为黄绿色 | 平衡正移, 的浓度增大 的浓度增大 |
| C | 加少量 片,静置, 片,静置, 片上覆盖红色固体 片上覆盖红色固体 |  的浓度增大 的浓度增大 |
| D | 加几滴 溶液,静置,上层清液为蓝色 溶液,静置,上层清液为蓝色 | 平衡逆移, 的浓度减小 的浓度减小 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-02-13更新
|
298次组卷
|
13卷引用:北京市朝阳区2021-2022学年高二上学期期末考试化学试题
北京市朝阳区2021-2022学年高二上学期期末考试化学试题北京市房山区2022届高三一模化学试题北京市第二十二中学 2021-2022 学年高二下学期期中考试化学试题北京市顺义区顺义第一中学2022-2023学年高二上学期期中考试化学试题北京市第八中学2022-2023学年高二上学期期末考试化学试题北京市昌平区第一中学2022-2023学年高二上学期期末考试化学试题北京交通大学附属中学2023-2024学年高三上学期10月月考化学试题北京市日坛中学2023-2024学年高三上学期10月检测化学试题广东省广州市第六中学2022-2023学年高二上学期期中考试化学试题重庆市南开中学校2022-2023学年高二下学期开学考试化学试题天津市南开区2022~2023 学年高三上学期阶段性质量监测 (二) 化学试题河南省信阳市2022-2023学年高二上学期期末考试化学试题重庆市万州第二高级中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
7 . 已知①有些离子带颜色,如 (紫色)、Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄色);
(紫色)、Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄色);
②常温下,pH<7的溶液显酸性;pH=7的溶液显中性;pH>7的溶液显碱性;
③碳酸氢钠溶液既能和盐酸、又能和氢氧化钠溶液发生离子反应: +H+=CO2↑+H2O、
+H+=CO2↑+H2O、 +OH-=
+OH-= +H2O。
+H2O。
在pH=1的无色溶液中,可以大量共存的离子组是
 (紫色)、Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄色);
(紫色)、Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄色);②常温下,pH<7的溶液显酸性;pH=7的溶液显中性;pH>7的溶液显碱性;
③碳酸氢钠溶液既能和盐酸、又能和氢氧化钠溶液发生离子反应:
 +H+=CO2↑+H2O、
+H+=CO2↑+H2O、 +OH-=
+OH-= +H2O。
+H2O。在pH=1的无色溶液中,可以大量共存的离子组是
A.Cu2+、 、H+、Cl- 、H+、Cl- | B.Fe3+、 、OH-、K+ 、OH-、K+ |
C. 、 、 、Na+、Ba2+ 、Na+、Ba2+ | D. 、K+、Cl-、 、K+、Cl-、 |
您最近一年使用:0次
2022-11-04更新
|
238次组卷
|
2卷引用:北京市怀柔区第一中学2022-2023学年高一上学期期中检测化学试题
2022·黑龙江佳木斯·三模
名校
解题方法
8 . 氯化亚铜 CuCl 是一种无机物,可用作催化剂、杀菌剂、媒染剂、脱色剂。它难溶于水,溶于浓盐酸和氨水,不溶于乙醇,在潮湿空气中可被迅速氧化成 Cu2(OH)3Cl。制备方法如下:

Ⅰ.途径一,以海绵铜(主要成分是 Cu 和少量的 CuO)为原料,回答下列问题:
(1)海绵铜在溶解之前进行“预处理”操作以去除表面的矿物油污,可以选择_______ 。
A.纯碱溶液浸泡 B.NaOH 溶液浸泡 C.酒精清洗
(2)溶解步骤温度控制在 60℃的原因是_______ 。
(3)反应步骤的离子方程式_______ 。
Ⅱ.途径二,以刻蚀废液(主要成分是 FeCl3、FeCl2、CuCl2)为原料,回答下列问题:
(4)刻蚀废液进行“预处理”时,先加入合适的氧化剂,再加入 Na2CO3溶液。加入Na2CO3调节溶液至微酸性而不是碱性的原因是_______ 。
(5)析出的氯化亚铜晶体要立即水洗后醇洗,在真空干燥机内于 60℃干燥 2 小时,冷却后真空包装,否则会发生反应的化学方程式为_______ 。
Ⅲ.在湿法炼锌的电解循环溶液中,较高浓度的 Cl-会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-。已知:Cu+Cu2+ 2Cu+ K =7.6×10-7;Ksp(CuCl) = 2.0×10-6
2Cu+ K =7.6×10-7;Ksp(CuCl) = 2.0×10-6
(6)通过计算说明上述除Cl-的反应能完全进行的原因_______ 。
(7)若用Zn替换Cu可加快除Cl-的速率,但需控制溶液的 pH。若pH过低,除 Cl-效果下降的原因是_______ 。

Ⅰ.途径一,以海绵铜(主要成分是 Cu 和少量的 CuO)为原料,回答下列问题:
(1)海绵铜在溶解之前进行“预处理”操作以去除表面的矿物油污,可以选择
A.纯碱溶液浸泡 B.NaOH 溶液浸泡 C.酒精清洗
(2)溶解步骤温度控制在 60℃的原因是
(3)反应步骤的离子方程式
Ⅱ.途径二,以刻蚀废液(主要成分是 FeCl3、FeCl2、CuCl2)为原料,回答下列问题:
(4)刻蚀废液进行“预处理”时,先加入合适的氧化剂,再加入 Na2CO3溶液。加入Na2CO3调节溶液至微酸性而不是碱性的原因是
(5)析出的氯化亚铜晶体要立即水洗后醇洗,在真空干燥机内于 60℃干燥 2 小时,冷却后真空包装,否则会发生反应的化学方程式为
Ⅲ.在湿法炼锌的电解循环溶液中,较高浓度的 Cl-会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-。已知:Cu+Cu2+
 2Cu+ K =7.6×10-7;Ksp(CuCl) = 2.0×10-6
2Cu+ K =7.6×10-7;Ksp(CuCl) = 2.0×10-6(6)通过计算说明上述除Cl-的反应能完全进行的原因
(7)若用Zn替换Cu可加快除Cl-的速率,但需控制溶液的 pH。若pH过低,除 Cl-效果下降的原因是
您最近一年使用:0次
2022-09-16更新
|
700次组卷
|
3卷引用:2022年北京高考真题化学试题变式题(工业流程题)
(已下线)2022年北京高考真题化学试题变式题(工业流程题)黑龙江省佳木斯市第一中学2022届高三第三次模拟理科综合化学试题新疆维吾尔自治区和田地区洛浦县2022-2023学年高三上学期11月期中考试化学试题
9 . 某研究小组探究CuSO4溶液和弱酸盐的反应。
【资料】H2S2O3是一种弱酸,易分解为SO2和S。
(1)实验I中过程i产生的蓝色絮状沉淀为Cu(OH)2,同时产生的少量气泡主要成分是_______ 。
(2)实验Ⅱ中过程ii产生的天蓝色粉末状沉淀中肯定含有的阴离子是_______ 。
(3)对比实验Ⅰ、Ⅱ中过程ii,II中产生气泡明显更快的原因是_______ 。
(4)实验Ⅲ中,经检验产生的黑色沉淀为CuS。推测CuS的产生原因。
推测1. 酸性条件下,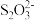 发生分解,随后分解产物再与Cu2+产生CuS;
发生分解,随后分解产物再与Cu2+产生CuS;
推测2. 酸性条件下,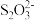 与Cu2+直接反应产生CuS,同时有
与Cu2+直接反应产生CuS,同时有 生成。
生成。
经实验及理论证明推测1和推测2均合理。
①证明推测1合理,应设计的实验方案是_______ 。
②推测2发生反应的离子方程式是_______ 。
③从化学反应速率和限度的角度解释酸性条件下,Na2S2O3溶液与CuSO4溶液酸性条件下反应,实验现象中反应初期产生黄色沉淀,反应中后期产生黑色沉淀的原因_______ 。
【资料】H2S2O3是一种弱酸,易分解为SO2和S。
| 序号 | 实验操作 | 实验现象 |
| Ⅰ | 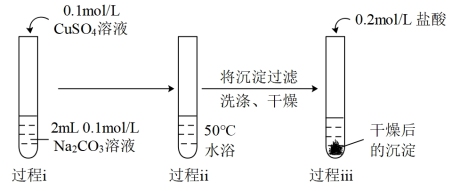 | 过程ⅰ:立即产生蓝色絮状沉淀,继续滴加至1mL,沉淀增多且蓝色加深,并出现少量气泡。 过程ⅱ:产生气泡增多且速率明显加快,蓝色絮状沉淀沉降在试管底部。 过程ⅲ:沉淀溶解并有极少量的气泡生成。 |
| Ⅱ | 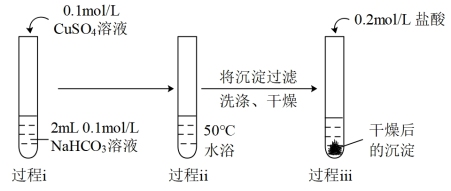 | 过程ⅰ:立即产生浅蓝绿色絮状沉淀,继续滴加至1mL,沉淀增多且蓝绿色加深,并出现少量气泡。 过程ⅱ:产生的气泡比实验Ⅰ过程ⅱ增加更多更快,最终得到天蓝色粉末状沉淀。 过程ⅲ:沉淀溶解并有较多气泡生成。 |
| Ⅲ | 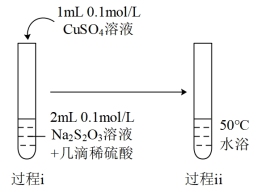 | 过程ⅰ:较快出现淡黄色悬浮物。 过程ⅱ:黄色逐渐加深,依次变为土黄色、棕色,最终变为黑色,同时产生刺激性气味气体,且通入品红试剂出现溶液褪色现象。 |
(2)实验Ⅱ中过程ii产生的天蓝色粉末状沉淀中肯定含有的阴离子是
(3)对比实验Ⅰ、Ⅱ中过程ii,II中产生气泡明显更快的原因是
(4)实验Ⅲ中,经检验产生的黑色沉淀为CuS。推测CuS的产生原因。
推测1. 酸性条件下,
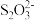 发生分解,随后分解产物再与Cu2+产生CuS;
发生分解,随后分解产物再与Cu2+产生CuS;推测2. 酸性条件下,
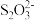 与Cu2+直接反应产生CuS,同时有
与Cu2+直接反应产生CuS,同时有 生成。
生成。经实验及理论证明推测1和推测2均合理。
①证明推测1合理,应设计的实验方案是
②推测2发生反应的离子方程式是
③从化学反应速率和限度的角度解释酸性条件下,Na2S2O3溶液与CuSO4溶液酸性条件下反应,实验现象中反应初期产生黄色沉淀,反应中后期产生黑色沉淀的原因
您最近一年使用:0次
10 . 下列变化与氧化还原反应无关的是
| A.向CuSO4溶液中加入少量锌粉,溶液蓝色变浅 |
| B.棕黄色FeCl3饱和溶液滴入沸水中变红褐色 |
| C.紫色酸性KMnO4溶液通入乙烯气体后褪色 |
| D.Na露置于空气中逐渐变为白色 |
您最近一年使用:0次



