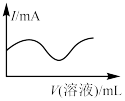解题方法
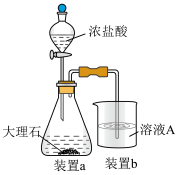
1 . 为探索某工厂的废金属屑(主要成分为Fe、Cu、Al、Al2O3、Fe2O3等)的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、胆矾晶体(CuSO4·5H2O,M=250g/mol)和水处理剂高铁酸钾(K2FeO4)
(1)试剂X是___________ ;试剂Y是___________ 。
(2)分离溶液A和固体B的操作中,所需要的玻璃仪器除了烧杯外还需要___________ 。
(3)写出溶液A转化为固体C的离子方程式___________ 。
(4)在步骤Ⅱ时,小组成员小明用下图装置进行试验,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,你的建议是___________ 。___________ 。___________ 。
(7)该小组同学取用100.0g该废金属屑,经过实验,最终得到胆矾晶体25.0g,该废料中铜的质量分数约为___________ 。

(1)试剂X是
(2)分离溶液A和固体B的操作中,所需要的玻璃仪器除了烧杯外还需要
(3)写出溶液A转化为固体C的离子方程式
(4)在步骤Ⅱ时,小组成员小明用下图装置进行试验,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,你的建议是
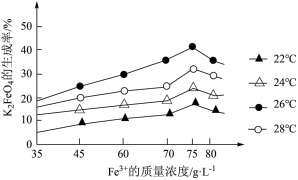
(7)该小组同学取用100.0g该废金属屑,经过实验,最终得到胆矾晶体25.0g,该废料中铜的质量分数约为
您最近半年使用:0次
2 . 实验室以(NH4)2CO3和Cu(OH)2为原料制备高纯Cu2(OH)2CO3的方法如下:___________ (答两点)。
(2)“蒸氨”在如图所示的实验装置中进行。___________ 。
②实验采用三个盛有水的洗气瓶吸收尾气的目的为___________ ;与上图所示洗气瓶相比,采用三个如图所示装置的优点为___________ 。___________ 。
(3)已知:①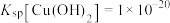 ;
;
②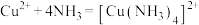
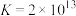 ;
;
③沉淀速率过快时,Cu(OH)2絮状沉淀易裹挟杂质。
以CuSO4∙5H2O固体为原料,补充完整制备纯净Cu(OH)2的实验方案:取一定质量的CuSO4∙5H2O固体分批加入蒸馏水中,搅拌至完全溶解,___________ ,低温烘干。(须使用的试剂:浓氨水、1mol∙L-1 NaOH溶液、0.1mol∙L-1 BaCl2溶液、蒸馏水)
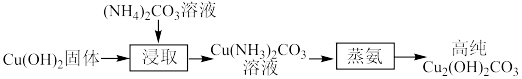
(2)“蒸氨”在如图所示的实验装置中进行。

②实验采用三个盛有水的洗气瓶吸收尾气的目的为
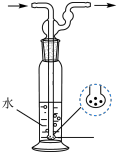
(3)已知:①
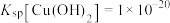 ;
;②
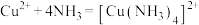
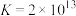 ;
;③沉淀速率过快时,Cu(OH)2絮状沉淀易裹挟杂质。
以CuSO4∙5H2O固体为原料,补充完整制备纯净Cu(OH)2的实验方案:取一定质量的CuSO4∙5H2O固体分批加入蒸馏水中,搅拌至完全溶解,
您最近半年使用:0次
3 . 下列物质或主要成分对应的化学式正确的是
| A.芒硝:Na2SO4·2H2O | B.胆矾:CuSO4·5H2O |
| C.石膏:CaSO4·H2O | D.黄铁矿:CuFeS2 |
您最近半年使用:0次
名校
4 . 氯化亚铜化学式为CuCl,白色立方结晶或白色粉末,难溶于水,在潮湿的空气中易氧化,不溶于乙醇,常用作催化剂、杀菌剂、媒染剂、脱色剂等。
I.CuCl的制备
取25g CuSO4∙5H2O和6.43gNaCl并加少量水溶解,将溶液倒入如图所示的三颈烧瓶中,加热至50℃,向三颈烧瓶中缓慢滴加Na2SO3和Na2CO3的混合溶液,使其持续反应30min。待反应结束后将混合物静置一段时间,抽滤,沉淀依次用36%的乙酸、无水乙醇、无水乙醚洗涤多次,得白色固体,真空或者充氮气保存。___________ 。
(2)反应时使用NaCl浓溶液,主要目的是___________ 。
(3)三颈烧瓶中CuSO4、NaCl、Na2SO3反应生成CuCl的离子方程式为___________ ;缓慢滴加Na2SO3和Na2CO3的混合溶液的主要原因是___________ 。
(4)沉淀用无水乙醇洗涤的目的是___________ 。
II.CuCl样品纯度的测定
准确称取CuCl样品0.25g,将其置于足量FeCl3溶液中,待固体完全溶解后,加水50mL和邻菲啰啉指示剂2滴,立即用amol∙L-1 Ce(SO4)2标准溶液滴定至绿色出现且30s不褪色,即为终点,重复2~3次,平均消耗Ce(SO4)2标准溶液bmL(已知: ,
, )
)
(5)滴定时应将Ce(SO4)2标准溶液加入___________ (填“酸式滴定管”或“碱式滴定管”)中;该样品中CuCl的质量分数为___________ ×100%。(用含a、b的代数式表示,列出计算式即可)
(6)下列操作可能会导致样品纯度测量结果偏低的是___________。(填标号)
I.CuCl的制备
取25g CuSO4∙5H2O和6.43gNaCl并加少量水溶解,将溶液倒入如图所示的三颈烧瓶中,加热至50℃,向三颈烧瓶中缓慢滴加Na2SO3和Na2CO3的混合溶液,使其持续反应30min。待反应结束后将混合物静置一段时间,抽滤,沉淀依次用36%的乙酸、无水乙醇、无水乙醚洗涤多次,得白色固体,真空或者充氮气保存。

(2)反应时使用NaCl浓溶液,主要目的是
(3)三颈烧瓶中CuSO4、NaCl、Na2SO3反应生成CuCl的离子方程式为
(4)沉淀用无水乙醇洗涤的目的是
II.CuCl样品纯度的测定
准确称取CuCl样品0.25g,将其置于足量FeCl3溶液中,待固体完全溶解后,加水50mL和邻菲啰啉指示剂2滴,立即用amol∙L-1 Ce(SO4)2标准溶液滴定至绿色出现且30s不褪色,即为终点,重复2~3次,平均消耗Ce(SO4)2标准溶液bmL(已知:
 ,
, )
)(5)滴定时应将Ce(SO4)2标准溶液加入
(6)下列操作可能会导致样品纯度测量结果偏低的是___________。(填标号)
| A.样品在空气中放置时间过长 |
| B.盛装Ce(SO4)2标准溶液的滴定管未用标准溶液润洗 |
| C.锥形瓶中装待测液前未干燥 |
| D.滴定管内部滴定前无气泡,滴定后有气泡 |
您最近半年使用:0次
2024-04-26更新
|
429次组卷
|
3卷引用:山西省太原市2024届高三一模理综试卷-高中化学
山西省太原市2024届高三一模理综试卷-高中化学(已下线)题型9 实验综合题(25题)-2024年高考化学常考点必杀300题(新高考通用)河南省郑州市宇华实验学校2024届高三下学期第三次模拟考试化学试题
名校
5 . 工业上制备下列物质的生产流程不合理的是
A.以废铜屑制硝酸铜: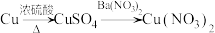 |
B.由黄铁矿制硫酸: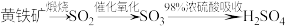 |
C.工业制硝酸: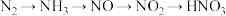 |
D.由石英砂制高纯硅: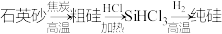 |
您最近半年使用:0次
6 . 氯化亚铜(CuCl)是一种易水解的白色固体。以低品位铜矿砂(主要成分CuS)为原料制备CuCl的工艺流程如图所示。
(1)“酸溶1”时,CuS作_______ (填“氧化剂”或“还原剂”)。
(2)“除锰”时,Cu2+转化为Cu(NH3)4CO3,Mn2+转化为MnCO3沉淀。沉锰的反应化学方程式为_______ 。将生成的MnCO3分离出来的实验操作为_______ 。
(3)“酸溶2”投料后,以一定的速率搅拌反应,可提高铜浸出率的措施有_______ (只答一种方法)。
(4)合成步骤加入Na2SO3的速率不宜过快,否则会产生_______ 气体。
(5)“洗涤”应先用稀盐酸洗涤,其目的是_______ 。

(1)“酸溶1”时,CuS作
(2)“除锰”时,Cu2+转化为Cu(NH3)4CO3,Mn2+转化为MnCO3沉淀。沉锰的反应化学方程式为
(3)“酸溶2”投料后,以一定的速率搅拌反应,可提高铜浸出率的措施有
(4)合成步骤加入Na2SO3的速率不宜过快,否则会产生
(5)“洗涤”应先用稀盐酸洗涤,其目的是
您最近半年使用:0次
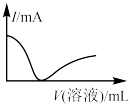
7 . 向一定量的CuSO4溶液中逐滴加入Ba(OH)2溶液至沉淀刚好不再增加,然后再逐滴加入稀盐酸至过量,下列各项中的曲线可近似表示整个过程中混合溶液的导电能力(用电流强度I表示)变化的是
|
|
|
|
| A | B | C | D |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
8 . 氯化亚铜(CuCl)是一种重要的化工原料,化学小组用如图装置(部分夹持装置略去)制备CuCl。
②在酸性条件下,某些中间价态的离子能发生自身氧化还原反应。
实验步骤:
I.打开分液漏斗活塞,向三颈瓶中加盐酸调pH至2~3,打开活塞K,通入SO2,溶液中产生白色沉淀,待反应完全后,再通一段时间气体。
Ⅱ.将反应混合液过滤、洗涤、干燥得CuCl粗产品,纯化后得CuCl产品。
回答下列问题:
(1)装置B的作用是_______ ,置C中的试剂为_______ 。
(2)步骤I中通入SO2发生反应的离子方程式是_______ 。
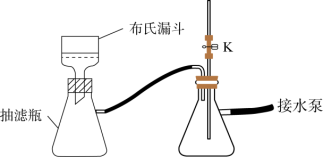
(3)步骤Ⅱ中采用抽滤法过滤的主要目的是:_____ ;抽滤采用下图装置。滤完毕需进行下列操作,从实验安全角度考虑,你认为最合理的第一步操作为_______ (填标号)。
(4)某小组同学发现,将分液漏斗中的0.1 mol·L-1盐酸换为6 mol·L-1盐酸,通入SO2,最终未得到白色沉淀。对此现象有如下猜想:
猜想一:Cl-浓度过大,与CuCl发生反应查阅资料知: CuCl+Cl- CuCl
CuCl ,据此设计实验:将上述未得到沉淀的溶液
,据此设计实验:将上述未得到沉淀的溶液__________ (填操作),若观察到有白色沉淀析出,证明猜想一正确。
猜想二:________ 。设计验证猜想二是否成立的实验方案:________ 。
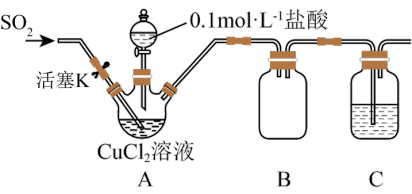
②在酸性条件下,某些中间价态的离子能发生自身氧化还原反应。
实验步骤:
I.打开分液漏斗活塞,向三颈瓶中加盐酸调pH至2~3,打开活塞K,通入SO2,溶液中产生白色沉淀,待反应完全后,再通一段时间气体。
Ⅱ.将反应混合液过滤、洗涤、干燥得CuCl粗产品,纯化后得CuCl产品。
回答下列问题:
(1)装置B的作用是
(2)步骤I中通入SO2发生反应的离子方程式是
(3)步骤Ⅱ中采用抽滤法过滤的主要目的是:
(4)某小组同学发现,将分液漏斗中的0.1 mol·L-1盐酸换为6 mol·L-1盐酸,通入SO2,最终未得到白色沉淀。对此现象有如下猜想:
猜想一:Cl-浓度过大,与CuCl发生反应查阅资料知: CuCl+Cl-
 CuCl
CuCl ,据此设计实验:将上述未得到沉淀的溶液
,据此设计实验:将上述未得到沉淀的溶液猜想二:
您最近半年使用:0次
9 . 一水硫酸四氨合铜[Cu(NH3)4SO4·H2O]是一种易溶于水,难溶于乙醇的绛蓝色晶体,可作高效安全的广谱杀菌剂。成外某兴趣小组查阅资料后设计实验方案制备出该晶体并对制备出的晶体进行成分检验和性质探究。
I.制备少量Cu(NH3)4SO4·H2O晶体:___________ (填仪器名称)。___________ 。
(3)步骤Ⅲ的离子方程式为___________ 。
(4)有同学查阅资料得知:(NH4)2SO4也难溶于乙醇。故对于制备出的晶体的成分,该同学提出如下假设:
假设一:只有(NH4)2SO4
假设二:只有Cu(NH3)4SO4·H2O
假设三:(NH4)2SO4和Cu(NH3)4SO4·H2O两种成分都有
已知产物晶体为蓝色,则无需实验即可排除___________ 。(填“假设一”、“假设二”、“假设三”)
Ⅱ.对制备出的晶体的成分进行检验和性质探究
(5)检验该晶体中阴离子的方法:___________ 。
(6)用所得晶体加水得到深蓝色溶液。取三份1L试样,分别加入一定量的水、稀硫酸、热的浓氢氧化钠溶液,实验现象记录如下:
结合化学用语,解释加入稀硫酸后出现的现象的原因___________ 。请补充完整加入热的浓氢氧化钠溶液后的现象:___________ 。
(7)晶体中N含量的测定
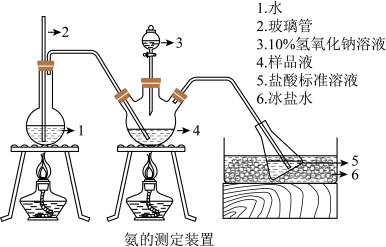
精确称取mg晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入VmL10%NaOH溶液,通入水蒸气,并用蒸馏水冲洗导管内壁,用V1mLc1mol/L的盐酸标准溶液完全吸收。取下接收瓶,用c2mol/LNaOH标准溶液滴定过剩的HCl,到终点时消耗V2mL溶液。___________ ,样品中N的质量分数的表达式为___________ ,最终通过N的质量分数确定了样品的成分。
I.制备少量Cu(NH3)4SO4·H2O晶体:
(3)步骤Ⅲ的离子方程式为
(4)有同学查阅资料得知:(NH4)2SO4也难溶于乙醇。故对于制备出的晶体的成分,该同学提出如下假设:
假设一:只有(NH4)2SO4
假设二:只有Cu(NH3)4SO4·H2O
假设三:(NH4)2SO4和Cu(NH3)4SO4·H2O两种成分都有
已知产物晶体为蓝色,则无需实验即可排除
Ⅱ.对制备出的晶体的成分进行检验和性质探究
(5)检验该晶体中阴离子的方法:
(6)用所得晶体加水得到深蓝色溶液。取三份1L试样,分别加入一定量的水、稀硫酸、热的浓氢氧化钠溶液,实验现象记录如下:
| 加入试剂 | 水 | 稀硫酸 | 热的氢氧化钠溶液 |
| 现象 | 深蓝色稍变浅 | 溶液颜色变成浅蓝色且与同浓度硫酸铜颜色相当 | 溶液最终变为无色 |
(7)晶体中N含量的测定
精确称取mg晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入VmL10%NaOH溶液,通入水蒸气,并用蒸馏水冲洗导管内壁,用V1mLc1mol/L的盐酸标准溶液完全吸收。取下接收瓶,用c2mol/LNaOH标准溶液滴定过剩的HCl,到终点时消耗V2mL溶液。
您最近半年使用:0次
名校
10 . 在中华文明的历史长河中,江西人才辈出,文化璀璨,下列说法正确的是
| A.“落木千山天远大,澄江一道月分明”,月亮倒映在江水中的现象属于丁达尔效应 |
B.白鹿洞书院建筑群易受酸雨腐蚀, 的雨水为酸雨 的雨水为酸雨 |
C.“庐山山南刷铜绿”,“铜绿”的主要成分为 |
| D.“白如玉,明如镜,薄如纸,声如馨”的景德镇白瓷的主要成分为无机硅酸盐材料 |
您最近半年使用:0次