名校
1 . 在一定温度下,硫酸铜的溶解度为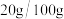 水,现往该温度下的饱和硫酸铜溶液中加入
水,现往该温度下的饱和硫酸铜溶液中加入 硫酸铜,可析出晶体的质量是
硫酸铜,可析出晶体的质量是
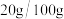 水,现往该温度下的饱和硫酸铜溶液中加入
水,现往该温度下的饱和硫酸铜溶液中加入 硫酸铜,可析出晶体的质量是
硫酸铜,可析出晶体的质量是A.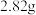 | B. | C.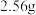 | D.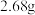 |
您最近一年使用:0次
2023-05-29更新
|
288次组卷
|
2卷引用:上海市吴淞中学2022-2023学年高一下学期检测2化学试题
名校
解题方法
2 . 氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业,是难溶于水的白色固体,能溶解于硝酸,在潮湿空气中可被迅速氧化。实验室用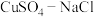 混合液与
混合液与 溶液反应制取CuCl。相关装置及数据如图:
溶液反应制取CuCl。相关装置及数据如图:

回答以下问题:
(1)图甲中仪器1的名称是___________ ;制备过程中 过量会发生副反应生成
过量会发生副反应生成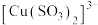 ,为提高产率,仪器2中所加试剂应为
,为提高产率,仪器2中所加试剂应为___________ 。
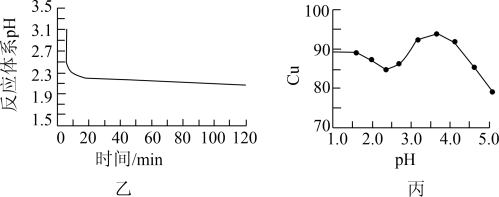
(2)如图乙所示是体系pH随时间变化关系图,写出制备CuCl的离子方程式___________ 。丙图是产率随pH变化关系图,实验过程中往往用 混合溶液代替
混合溶液代替 溶液,其中
溶液,其中 的作用是
的作用是___________ ,为保证较高产率pH应维持在___________ 左右。
(3)反应完成后经抽滤、洗涤、干燥获得产品。洗涤时,用“去氧水”作洗涤剂洗涤产品,作用是___________ 。
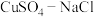 混合液与
混合液与 溶液反应制取CuCl。相关装置及数据如图:
溶液反应制取CuCl。相关装置及数据如图:
回答以下问题:
(1)图甲中仪器1的名称是
 过量会发生副反应生成
过量会发生副反应生成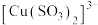 ,为提高产率,仪器2中所加试剂应为
,为提高产率,仪器2中所加试剂应为(2)如图乙所示是体系pH随时间变化关系图,写出制备CuCl的离子方程式
 混合溶液代替
混合溶液代替 溶液,其中
溶液,其中 的作用是
的作用是
(3)反应完成后经抽滤、洗涤、干燥获得产品。洗涤时,用“去氧水”作洗涤剂洗涤产品,作用是
您最近一年使用:0次
名校
3 . CuCl用于石油工业脱硫与脱色,还可用作CO吸附剂和脱氧剂。CuCl是一种不溶于水和乙醇的白色粉末,在潮湿空气中可被迅速氧化。
Ⅰ.利用以下装置可制备CuCl

已知: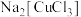 为无色溶液,加水稀释即析出CuCl白色固体,回答下列问题:
为无色溶液,加水稀释即析出CuCl白色固体,回答下列问题:
(1)制取 :A中发生的反应氧化剂和还原剂的物质的量之比为
:A中发生的反应氧化剂和还原剂的物质的量之比为_______ ,为吸收 尾气,C中可选用试剂
尾气,C中可选用试剂_______ (填标号)。
A. 溶液 B.饱和食盐水 C.
溶液 B.饱和食盐水 C. 溶液 D.浓
溶液 D.浓
(2)制备CuCl:打开分液漏斗旋塞与搅拌器,B中依次发生反应的离子方程式为:
①
②_______
③
观察到_______ 时停止反应。将B中溶液倾入盛有_______ 的烧杯中,立即得到白色CuCl沉淀。过滤得CuCl粗品。
(3)洗涤CuCl:洗涤时最好用_______ (填序号)洗涤滤饼3~4次,其目的是_______ 。
a. b.稀硫酸 c.95%的乙醇
b.稀硫酸 c.95%的乙醇
Ⅱ.工业上常用CuCl作 、CO的吸收剂,某同学利用如下图所示装置模拟工业上测定高炉煤气中CO、
、CO的吸收剂,某同学利用如下图所示装置模拟工业上测定高炉煤气中CO、 、
、 和
和 的含量。
的含量。
已知: 和KOH的混合溶液也能吸收氧气。
和KOH的混合溶液也能吸收氧气。
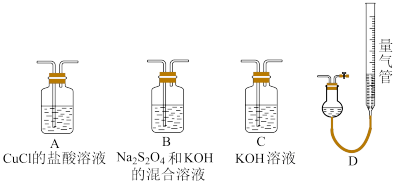
(4)装置的连接顺序应为_______ 。
(5)用D装置测 含量,若读数时右侧量气管液面高于左侧液面,则测得
含量,若读数时右侧量气管液面高于左侧液面,则测得 含量
含量_______ (填“偏大”“偏小”或“不变”)。
Ⅰ.利用以下装置可制备CuCl

已知:
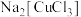 为无色溶液,加水稀释即析出CuCl白色固体,回答下列问题:
为无色溶液,加水稀释即析出CuCl白色固体,回答下列问题:(1)制取
 :A中发生的反应氧化剂和还原剂的物质的量之比为
:A中发生的反应氧化剂和还原剂的物质的量之比为 尾气,C中可选用试剂
尾气,C中可选用试剂A.
 溶液 B.饱和食盐水 C.
溶液 B.饱和食盐水 C. 溶液 D.浓
溶液 D.浓
(2)制备CuCl:打开分液漏斗旋塞与搅拌器,B中依次发生反应的离子方程式为:
①

②
③

观察到
(3)洗涤CuCl:洗涤时最好用
a.
 b.稀硫酸 c.95%的乙醇
b.稀硫酸 c.95%的乙醇Ⅱ.工业上常用CuCl作
 、CO的吸收剂,某同学利用如下图所示装置模拟工业上测定高炉煤气中CO、
、CO的吸收剂,某同学利用如下图所示装置模拟工业上测定高炉煤气中CO、 、
、 和
和 的含量。
的含量。已知:
 和KOH的混合溶液也能吸收氧气。
和KOH的混合溶液也能吸收氧气。
(4)装置的连接顺序应为
(5)用D装置测
 含量,若读数时右侧量气管液面高于左侧液面,则测得
含量,若读数时右侧量气管液面高于左侧液面,则测得 含量
含量
您最近一年使用:0次
4 .  是一种清洁、高效、具有优良环保性能的燃料,有良好的应用前景。
是一种清洁、高效、具有优良环保性能的燃料,有良好的应用前景。
(1)科研人员设计了甲烷燃料电池并用于电解。如图1所示,电解质是掺杂了 与
与 的固体,可在高温下传导
的固体,可在高温下传导 。
。
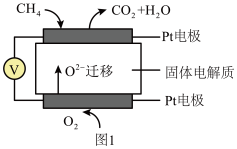
①该电池工作时负极反应方程式为_______ 。
②用该电池电解 溶液得到12.8gCu,理论上需要使用
溶液得到12.8gCu,理论上需要使用 的体积(标准状况)为
的体积(标准状况)为_______ 。
(2)化学链燃烧技术主要由载氧体、燃料反应器和空气反应器组成。载氧体作为氧的载体,在反应器中循环,实现氧的转移。
①利用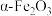 载氧体的甲烷化学链燃烧法,其示意图如图2所示。甲烷脱氢过程可描述为
载氧体的甲烷化学链燃烧法,其示意图如图2所示。甲烷脱氢过程可描述为_______ 。
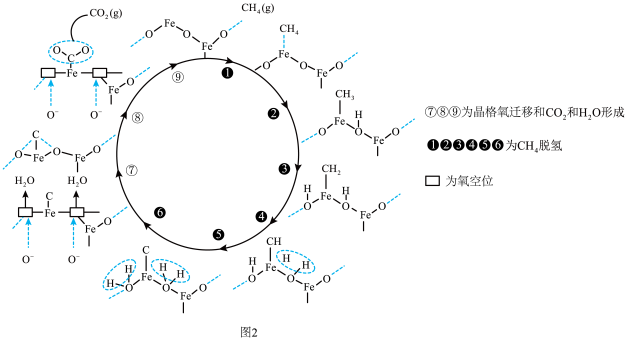
② 也可作为甲烷燃烧的载氧体。往盛有
也可作为甲烷燃烧的载氧体。往盛有 载氧体的刚性密闭容器中充入空气(
载氧体的刚性密闭容器中充入空气( 的物质的量分数为21%),发生反应。平衡时
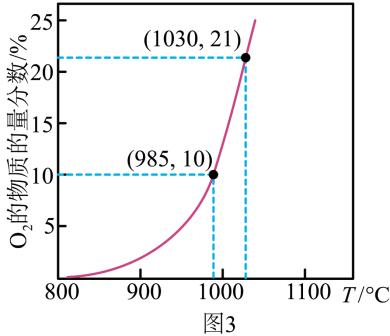
的物质的量分数为21%),发生反应。平衡时 的物质的量分数随反应温度T变化的曲线如图3所示。
的物质的量分数随反应温度T变化的曲线如图3所示。 的物质的量分数随温度升高而增大的原因是
的物质的量分数随温度升高而增大的原因是_______ ,反应温度必须控制在1030℃以下,原因是_______ 。
 是一种清洁、高效、具有优良环保性能的燃料,有良好的应用前景。
是一种清洁、高效、具有优良环保性能的燃料,有良好的应用前景。(1)科研人员设计了甲烷燃料电池并用于电解。如图1所示,电解质是掺杂了
 与
与 的固体,可在高温下传导
的固体,可在高温下传导 。
。
①该电池工作时负极反应方程式为
②用该电池电解
 溶液得到12.8gCu,理论上需要使用
溶液得到12.8gCu,理论上需要使用 的体积(标准状况)为
的体积(标准状况)为(2)化学链燃烧技术主要由载氧体、燃料反应器和空气反应器组成。载氧体作为氧的载体,在反应器中循环,实现氧的转移。
①利用
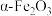 载氧体的甲烷化学链燃烧法,其示意图如图2所示。甲烷脱氢过程可描述为
载氧体的甲烷化学链燃烧法,其示意图如图2所示。甲烷脱氢过程可描述为
②
 也可作为甲烷燃烧的载氧体。往盛有
也可作为甲烷燃烧的载氧体。往盛有 载氧体的刚性密闭容器中充入空气(
载氧体的刚性密闭容器中充入空气( 的物质的量分数为21%),发生反应。平衡时
的物质的量分数为21%),发生反应。平衡时 的物质的量分数随反应温度T变化的曲线如图3所示。
的物质的量分数随反应温度T变化的曲线如图3所示。 的物质的量分数随温度升高而增大的原因是
的物质的量分数随温度升高而增大的原因是
您最近一年使用:0次
2023-03-01更新
|
406次组卷
|
2卷引用:江苏省连云港市2022-2023学年高三下学期2月调研考试化学试题
名校
解题方法
5 . 用粗铜精炼工业中产生的铜阳极泥(主要含Cu2Se、Ag2Se、金和铂等)为原料,回收并制备硝酸铜和硒的工艺流程如图:
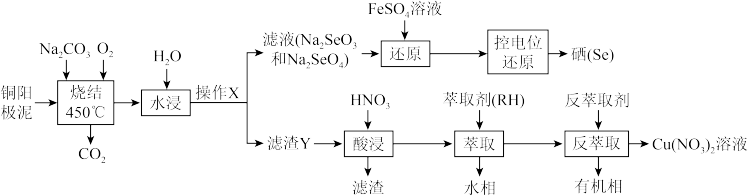
(1)“烧结”时发生如下反应,请完善该反应方程式:___________ 。
 ___
___ _____
_____ ___
___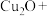 ______
______ _____
_____
工业上,采用通入高压氧气使铜阳极泥处于“沸腾”状态,其目的是___________ 。
(2)在实验室,操作X的名称为___________ 。
(3)滤渣Y的成分有Ag2O、_____ (填化学式,下同);已知萃取与反萃取原理为:2RH+Cu2+→R2Cu+2H+,则“反萃取”时反萃取剂最好选用_____ 溶液。
(4)FeSO4的作用是“还原”Na2SeO4制备Na2SeO3,每摩尔Na2SeO4消耗FeSO4的物质的量为___________ mol;常温下,H2SeO3的Ka1=1.0x10-3,Ka2=1.0x10-7;当常温下溶液的pH=4.4时,Na2SeO3溶液中最主要的含Se粒子是___________ 。
(5)“控电位还原”是指在一定电压下,电位高的氧化剂优先被还原,电位低的氧化剂保留在溶液中,以达到硒与杂质金属的分离;下表为一些氧化剂的电位(A/B:A代表氧化剂,B代表还原产物)。
则SeO 、Fe3+和Cu2+的氧化性由强到弱的顺序为
、Fe3+和Cu2+的氧化性由强到弱的顺序为___________ ,在0.740V时Fe3+优先被还原,其还原反应(半反应)式为___________ 。

(1)“烧结”时发生如下反应,请完善该反应方程式:
 ___
___ _____
_____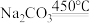 ___
___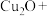 ______
______ _____
_____
工业上,采用通入高压氧气使铜阳极泥处于“沸腾”状态,其目的是
(2)在实验室,操作X的名称为
(3)滤渣Y的成分有Ag2O、
(4)FeSO4的作用是“还原”Na2SeO4制备Na2SeO3,每摩尔Na2SeO4消耗FeSO4的物质的量为
(5)“控电位还原”是指在一定电压下,电位高的氧化剂优先被还原,电位低的氧化剂保留在溶液中,以达到硒与杂质金属的分离;下表为一些氧化剂的电位(A/B:A代表氧化剂,B代表还原产物)。
| 名称 | 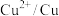 | 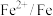 |  |  |
| 电位/V | 0.345 | 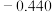 | 0.770 | 0.740 |
 、Fe3+和Cu2+的氧化性由强到弱的顺序为
、Fe3+和Cu2+的氧化性由强到弱的顺序为
您最近一年使用:0次
2022-03-25更新
|
927次组卷
|
4卷引用:四川省遂宁市2022届高三第二次诊断性考试(二模)理综化学试题
四川省遂宁市2022届高三第二次诊断性考试(二模)理综化学试题四川省内江市2022届高三下学期第二次模拟考试理科综合化学试题(已下线)微专题15 铜及其化合物的性质、制备与实验探究-备战2023年高考化学一轮复习考点微专题四川省泸县第一中学2023-2024学年高三上学期期末考试理综试题-高中化学
6 . 以印刷线路板的碱性蚀刻废液(主要成分为[Cu(NH3)4]Cl2)或焙烧过的铜精炼炉渣(主要成分为CuO、SiO2少量Fe2O3)为原料均能制备CuSO4·5H2O晶体。
(1)取一定量蚀刻废液和稍过量的NaOH溶液加入到如图所示实验装置的三颈瓶中,在搅拌下加热反应并通入空气,待产生大量的黑色沉淀时停止反应,趁热过滤、洗涤,得到CuO固体;所得固体经酸溶、结晶、过滤等操作,得到CuSO4·5H2O晶体。_______ 。
②检验CuO固体是否洗净的实验操作是_______ 。
③装置图中装置X的作用是_______ 。
(2)以焙烧过的铜精炼炉渣为原料制备CuSO4·5H2O晶体时,请补充完整相应的实验方案:取一定量焙烧过的铜精炼炉渣,_______ ,加热浓缩、冷却结晶、过滤、晾干,得到CuSO4·5H2O晶体。已知:①该实验中pH=3.2时,Fe3+完全沉淀;pH=4.7时,Cu2+开始沉淀。②实验中可选用的试剂:1.0 mol/L H2SO4、1.0 mol/L HCl、1.0 mol/L NaOH。
(3)通过下列方法测定产品纯度:准确称取0.5000g CuSO4·5H2O样品,加适量水溶解,转移至碘量瓶中,加过量KI溶液并用稀H2SO4酸化,以淀粉溶液为指示剂,用0.1000 mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3的溶液19.48mL。测定过程中发生下列反应:2Cu2++4I-=2CuI↓+I2、2S2O +I2= S4O
+I2= S4O +2I-。计算CuSO4·5H2O样品的纯度:
+2I-。计算CuSO4·5H2O样品的纯度:_______ 。
(1)取一定量蚀刻废液和稍过量的NaOH溶液加入到如图所示实验装置的三颈瓶中,在搅拌下加热反应并通入空气,待产生大量的黑色沉淀时停止反应,趁热过滤、洗涤,得到CuO固体;所得固体经酸溶、结晶、过滤等操作,得到CuSO4·5H2O晶体。
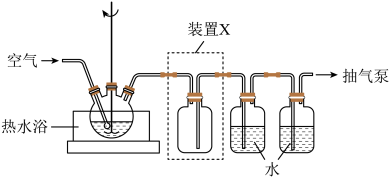
②检验CuO固体是否洗净的实验操作是
③装置图中装置X的作用是
(2)以焙烧过的铜精炼炉渣为原料制备CuSO4·5H2O晶体时,请补充完整相应的实验方案:取一定量焙烧过的铜精炼炉渣,
(3)通过下列方法测定产品纯度:准确称取0.5000g CuSO4·5H2O样品,加适量水溶解,转移至碘量瓶中,加过量KI溶液并用稀H2SO4酸化,以淀粉溶液为指示剂,用0.1000 mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3的溶液19.48mL。测定过程中发生下列反应:2Cu2++4I-=2CuI↓+I2、2S2O
 +I2= S4O
+I2= S4O +2I-。计算CuSO4·5H2O样品的纯度:
+2I-。计算CuSO4·5H2O样品的纯度:
您最近一年使用:0次
2021-07-15更新
|
868次组卷
|
10卷引用:江苏省2021年普通高中学业水平选择考适应性测试化学试题
江苏省2021年普通高中学业水平选择考适应性测试化学试题(已下线)大题03 无机制备类实验题-【考前抓大题】备战2021年高考化学(全国通用)(已下线)培优01 无机制备类实验 基础训练-2021年高考化学大题培优练(新高考地区专用)江苏省苏州市姑苏区第十中学2020-2021学年高一下学期期初化学考试山东省济南大学城实验高级中学2021届高三4月阶段性测试化学试题黑龙江省哈尔滨师范大学附属中学2020-2021学年高二下学期期末考试化学试题江苏省淮安市高中校协作体2021-2022学年高三上学期期中考试化学试题江苏省苏州市张家港市2021-2022学年高三下学期开学考试化学试题湖南省常宁市第一中学2021-2022学年高三下学期期中考试化学试题江苏省苏州实验中学2021-2022学年高二下学期期中考试化学试题
7 . 甲烷在加热条件下可还原氧化铜,某化学小组利用如图装置探究其反应产物。
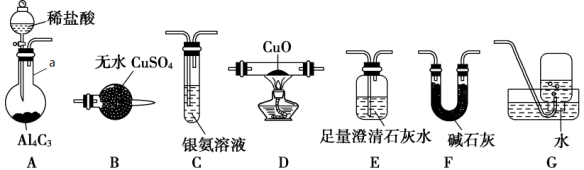
查阅资料:①CO能与银氨溶液反应:
②Cu2O为红色,能发生反应: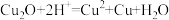
(1)仪器a的名称是___________ ,装置A中反应的化学方程式为___________ 。
(2)按气流方向各装置从左到右的连接顺序为A→F→D→___________→___________→___________→G(填字母编号)。___________
(3)已知气体产物中含有CO,则装置C中可观察到的现象是___________ ;装置F的作用为___________ 。
(4)当反应结束后,装置D处试管中固体全部变为红色。
①设计简单实验证明红色固体中含有 :
:___________ 。
②若红色固体为单质,且产物中含碳氧化物的物质的量之比为 ,则D处发生的反应化学方程式是
,则D处发生的反应化学方程式是___________ 。

查阅资料:①CO能与银氨溶液反应:

②Cu2O为红色,能发生反应:
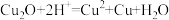
(1)仪器a的名称是
(2)按气流方向各装置从左到右的连接顺序为A→F→D→___________→___________→___________→G(填字母编号)。
(3)已知气体产物中含有CO,则装置C中可观察到的现象是
(4)当反应结束后,装置D处试管中固体全部变为红色。
①设计简单实验证明红色固体中含有
 :
:②若红色固体为单质,且产物中含碳氧化物的物质的量之比为
 ,则D处发生的反应化学方程式是
,则D处发生的反应化学方程式是
您最近一年使用:0次
8 . CuCl2是常见的化学试剂,学习小组开展了与CuCl2相关的系列实验。回答下列问题:
I.利用废铜屑制备CuCl2(实验装置如下图所示)
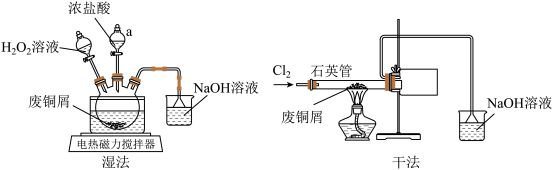
(1)仪器a的名称为_______ 。
(2)“湿法”制备CuCl2的化学方程式为_______ 。
(3)①石英管内可能观察到的现象为_______ 。
②石英管直接伸入收集装置,该管较粗,其优点是_______ 。
(4)除上述两种方法外,实验室中还可先将铜粉_______ (填试剂及操作),再加入适量稀盐酸反应得到CuCl2溶液。
II.探究Al与CuCl2溶液的反应
将铝片放入盛有0.1mol·L-1CuCl2溶液的试管中,观察到现象为:铝片表面析出疏松的紫红色固体,产生无色无味气体,溶液颜色变浅。
(5)紫红色固体为_______ (填化学式)。
(6)经检验产生的气体为H2.在CuCl2溶液中存在Cu2++2H2O=Cu(OH)2+2H+、2A1+6H+=2A13++3H2↑,小组成员认为应产生Cu(OH)2,但实际实验中并未观察到蓝色沉淀。于是他们提出了以下两种猜测并进行相关验证。完成下列表格:
③在猜测ii成立的基础上,该小组成员查阅文献发现体系中可能存在反应:2A13++3Cu(OH)2=2Al(OH)3+3Cu2+,列式计算平衡常数分析该反应进行的趋势___________________ 。(已知:Ksp[Cu(OH)2]=2.2×10-20;Ksp[A1(OH)3]=1.3×10-33。一般认为,K>105时反应进行较完全,K<10-5时反应难以进行)文献显示生成的Al(OH)3可能以胶体形式存在,这是未观察到白色沉淀的可能原因,但仍需进一步深入研究。
I.利用废铜屑制备CuCl2(实验装置如下图所示)

(1)仪器a的名称为
(2)“湿法”制备CuCl2的化学方程式为
(3)①石英管内可能观察到的现象为
②石英管直接伸入收集装置,该管较粗,其优点是
(4)除上述两种方法外,实验室中还可先将铜粉
II.探究Al与CuCl2溶液的反应
将铝片放入盛有0.1mol·L-1CuCl2溶液的试管中,观察到现象为:铝片表面析出疏松的紫红色固体,产生无色无味气体,溶液颜色变浅。
(5)紫红色固体为
(6)经检验产生的气体为H2.在CuCl2溶液中存在Cu2++2H2O=Cu(OH)2+2H+、2A1+6H+=2A13++3H2↑,小组成员认为应产生Cu(OH)2,但实际实验中并未观察到蓝色沉淀。于是他们提出了以下两种猜测并进行相关验证。完成下列表格:
| 猜测 | 实验 | 现象 | 结论 |
| i.① | 取少量Cu(OH)2悬浊液,加入打磨过的铝片,振荡 | 无明显现象 | 猜想i不成立 |
| ii.Cu(OH)2与Al3+发生了反应 | ② | 固体立即溶解,溶液呈浅绿色 | 猜想ii成立 |
您最近一年使用:0次
名校
解题方法
9 . 阅读相关信息,结合所学知识,回答下列问题:
(1)铝和锌都是两性金属元素。其氢氧化物都是白色沉淀,既能溶于强酸,又能溶于强碱(生成 或ZnO
或ZnO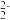 )。但氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成[Zn(NH3)4]2+。
)。但氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成[Zn(NH3)4]2+。
①写出锌和氢氧化钠溶液反应的化学方程式___________ 。
②用氨水除去Al(OH)3中的Zn(OH)2的离子方程式为___________ 。
③写出向AlCl3溶液中滴入过量氨水的离子方程式___________ ;
④下列各组中的两种溶液,只用胶头滴管和试管即可鉴别的是___________ 。
A.硫酸铝和氢氧化钠 B.硫酸铝和氨水
C.硫酸锌和氢氧化钠 D.硫酸锌和氨水
(2)Cu2O是一种红色难溶于水的固体,在空气中灼烧Cu2O会生成CuO;Cu2O溶于稀硫酸可生成Cu和Cu2+;Cu2O和Cu都能溶于稀硝酸。
研究性学习小组为检测Cu样品中是否含有Cu2O设计以下实验方案:
方案Ⅰ:取该红色样品溶于足量的稀硝酸中,观察是否有残渣剩余
方案Ⅱ:取该红色样品溶于足量的稀硫酸中,观察溶液颜色变化
方案Ⅲ:称量a g红色样品,在空气中充分灼烧至恒重,得到bg黑色固体。
①比较方案Ⅰ和方案Ⅱ,你认为合理的是方案___________ (填“Ⅰ”或“Ⅱ”),合理方案的反应原理为___________ (用离子方程式表示)。
②方案Ⅲ中,如果___________ <b<___________ (用含a的代数式表示),可确认红色粉末含有Cu2O。
(1)铝和锌都是两性金属元素。其氢氧化物都是白色沉淀,既能溶于强酸,又能溶于强碱(生成
 或ZnO
或ZnO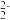 )。但氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成[Zn(NH3)4]2+。
)。但氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成[Zn(NH3)4]2+。①写出锌和氢氧化钠溶液反应的化学方程式
②用氨水除去Al(OH)3中的Zn(OH)2的离子方程式为
③写出向AlCl3溶液中滴入过量氨水的离子方程式
④下列各组中的两种溶液,只用胶头滴管和试管即可鉴别的是
A.硫酸铝和氢氧化钠 B.硫酸铝和氨水
C.硫酸锌和氢氧化钠 D.硫酸锌和氨水
(2)Cu2O是一种红色难溶于水的固体,在空气中灼烧Cu2O会生成CuO;Cu2O溶于稀硫酸可生成Cu和Cu2+;Cu2O和Cu都能溶于稀硝酸。
研究性学习小组为检测Cu样品中是否含有Cu2O设计以下实验方案:
方案Ⅰ:取该红色样品溶于足量的稀硝酸中,观察是否有残渣剩余
方案Ⅱ:取该红色样品溶于足量的稀硫酸中,观察溶液颜色变化
方案Ⅲ:称量a g红色样品,在空气中充分灼烧至恒重,得到bg黑色固体。
①比较方案Ⅰ和方案Ⅱ,你认为合理的是方案
②方案Ⅲ中,如果
您最近一年使用:0次
10 . 某兴趣小组将过量Cu与FeCl3溶液充分反应,静置后取上层清液于试管中,将KSCN溶液滴加到清液中,瞬间产生白色沉淀,局部出现红色,振荡试管,红色又迅速褪去。
已知:①CuCl2+Cu=2CuCl↓(白色)速率很慢
②2CuCl2+4KSCN=2CuSCN↓(白色)+(SCN)2+4KCl速率很快
③(SCN)2是拟卤素,化学性质和氯气相似
下列说法正确的是
已知:①CuCl2+Cu=2CuCl↓(白色)速率很慢
②2CuCl2+4KSCN=2CuSCN↓(白色)+(SCN)2+4KCl速率很快
③(SCN)2是拟卤素,化学性质和氯气相似
下列说法正确的是
| A.用KSCN溶液检验Fe3+时,Cu2+的存在会对检验产生干扰 |
| B.局部出现红色的主要原因是溶液中Fe2+被空气中O2氧化成Fe3+ |
| C.白色沉淀为CuCl,是溶液中CuCl2与Cu反应生成的 |
D.红色迅速褪去是因为Cu2+与SCN-发生反应②,使Fe3++3SCN- Fe(SCN)3平衡逆向移动 Fe(SCN)3平衡逆向移动 |
您最近一年使用:0次
2021-04-07更新
|
1109次组卷
|
7卷引用:湖南省常德市2021届高三第一次(3月)模拟考试化学试题
湖南省常德市2021届高三第一次(3月)模拟考试化学试题(已下线)2021年高考化学押题预测卷(山东卷)(01)(含考试版、答题卡、参考答案、全解全析)(已下线)专题06 金属及其化合物-2022年高考化学二轮复习重点专题常考点突破练湖南省怀化市沅陵县第一中学2022-2023学年高三上学期第一次阶段性考试化学试题浙江省杭州市2022-2023学年高三上学期第一次适应性考试化学试题湖南省株洲市第一中学2022-2023学年高一上学期第三次月考化学试题湖南省株洲市九方中学2022-2023学年高一上学期第三次月考化学试题



