解题方法
1 . 为探索某工厂的废金属屑(主要成分为Fe、Cu、Al、Al2O3、Fe2O3等)的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、胆矾晶体(CuSO4·5H2O,M=250g/mol)和水处理剂高铁酸钾(K2FeO4)
(1)试剂X是___________ ;试剂Y是___________ 。
(2)分离溶液A和固体B的操作中,所需要的玻璃仪器除了烧杯外还需要___________ 。
(3)写出溶液A转化为固体C的离子方程式___________ 。
(4)在步骤Ⅱ时,小组成员小明用下图装置进行试验,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,你的建议是___________ 。___________ 。___________ 。
(7)该小组同学取用100.0g该废金属屑,经过实验,最终得到胆矾晶体25.0g,该废料中铜的质量分数约为___________ 。

(1)试剂X是
(2)分离溶液A和固体B的操作中,所需要的玻璃仪器除了烧杯外还需要
(3)写出溶液A转化为固体C的离子方程式
(4)在步骤Ⅱ时,小组成员小明用下图装置进行试验,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,你的建议是
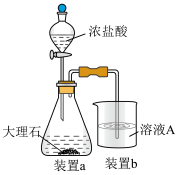
(7)该小组同学取用100.0g该废金属屑,经过实验,最终得到胆矾晶体25.0g,该废料中铜的质量分数约为
您最近半年使用:0次
2 . 氯化铜晶体(CuCl2·2H2O)常用作玻璃、陶瓷着色剂和饲料添加剂等。工业上用粗制氧化铜粉(含杂质FeO和SiO2)制备无水氯化铜,制取流程如下:

已知:氯化亚砜( 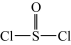 )熔点-101℃,沸点76℃,易水解。回答下列问题:
)熔点-101℃,沸点76℃,易水解。回答下列问题:
(1)为避免引入杂质,试剂x可选用___________ (填字母)
a.KMnO4溶液 b.Cl2水 c.Br2水 d.H2O2溶液
(2)溶液C中加入试剂y可以调节溶液pH,控制pH的取值范围为______~________________ ,从而除去Fe3+而不引入杂质。试剂y可选用下列物质中的___________ (填字母)
a.Cu b.CuO c.Cu2(OH)2CO3 d.NaOH
(3)SOCl2与水反应的化学方程式为___________ 。
(4)SOCl2与CuCl2·2H2O混合并加热,可得到无水CuCl2的原因是__________________ 。

| Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | |
| 开始沉淀的pH | 1.9 | 7.0 | 4.7 |
| 沉淀完全的pH | 3.2 | 9.0 | 6.7 |
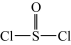 )熔点-101℃,沸点76℃,易水解。回答下列问题:
)熔点-101℃,沸点76℃,易水解。回答下列问题:(1)为避免引入杂质,试剂x可选用
a.KMnO4溶液 b.Cl2水 c.Br2水 d.H2O2溶液
(2)溶液C中加入试剂y可以调节溶液pH,控制pH的取值范围为______~_____
a.Cu b.CuO c.Cu2(OH)2CO3 d.NaOH
(3)SOCl2与水反应的化学方程式为
(4)SOCl2与CuCl2·2H2O混合并加热,可得到无水CuCl2的原因是
您最近半年使用:0次
解题方法
3 . 已知: ,氢氧化铜悬浊液受热易分解生成
,氢氧化铜悬浊液受热易分解生成 。蚀刻含铜电路板有多种方法,用蚀刻废液可制备
。蚀刻含铜电路板有多种方法,用蚀刻废液可制备 。
。
(1)酸性蚀刻液法(过氧化氢-盐酸法)。
①用过氧化氢和盐酸蚀刻含铜电路板时发生的离子反应方程式为_______ 。
②反应后有气泡产生,且反应一段时间后,随着溶液变蓝,产生气泡的速率加快,可能的原因是_______ 。
(2)碱性蚀刻液法。碱性含铜蚀刻液主要成分为 、氨水、氯化铵等。蚀刻过程中,
、氨水、氯化铵等。蚀刻过程中, 与电路板上的铜发生反应生成
与电路板上的铜发生反应生成 ,失去蚀刻能力,通入空气可恢复蚀刻能力。
,失去蚀刻能力,通入空气可恢复蚀刻能力。
①
 中
中 键的数目为
键的数目为_______ 。
②蚀刻能力恢复的化学方程式为_______ 。
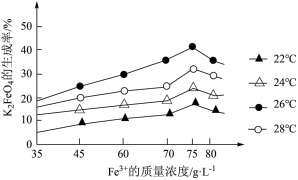
(3)酸性蚀刻废液与碱性蚀刻废液混和可析出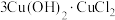 沉淀,pH在4~5之间易生成氢氧化铜胶体。酸性蚀刻废液与碱性蚀刻废液混和反应装置如图1所示。不同pH时,铜元素回收率如图2所示。
沉淀,pH在4~5之间易生成氢氧化铜胶体。酸性蚀刻废液与碱性蚀刻废液混和反应装置如图1所示。不同pH时,铜元素回收率如图2所示。
①为减少 胶体形成而影响后续操作,溶液A为
胶体形成而影响后续操作,溶液A为_______ (选填“酸性”或“碱性”)蚀刻废液。
② 时,铜元素回收率下降的原因为
时,铜元素回收率下降的原因为_______ 。
(4)设计从酸性蚀刻废液中制备氧化铜的实验方案。向一定质量的酸性蚀刻废液中_______ 。(实验中必须 使用的试剂:20% 溶液、硝酸银溶液、稀硝酸、蒸馏水)
溶液、硝酸银溶液、稀硝酸、蒸馏水)
 ,氢氧化铜悬浊液受热易分解生成
,氢氧化铜悬浊液受热易分解生成 。蚀刻含铜电路板有多种方法,用蚀刻废液可制备
。蚀刻含铜电路板有多种方法,用蚀刻废液可制备 。
。(1)酸性蚀刻液法(过氧化氢-盐酸法)。
①用过氧化氢和盐酸蚀刻含铜电路板时发生的离子反应方程式为
②反应后有气泡产生,且反应一段时间后,随着溶液变蓝,产生气泡的速率加快,可能的原因是
(2)碱性蚀刻液法。碱性含铜蚀刻液主要成分为
 、氨水、氯化铵等。蚀刻过程中,
、氨水、氯化铵等。蚀刻过程中, 与电路板上的铜发生反应生成
与电路板上的铜发生反应生成 ,失去蚀刻能力,通入空气可恢复蚀刻能力。
,失去蚀刻能力,通入空气可恢复蚀刻能力。①

 中
中 键的数目为
键的数目为②蚀刻能力恢复的化学方程式为
(3)酸性蚀刻废液与碱性蚀刻废液混和可析出
 沉淀,pH在4~5之间易生成氢氧化铜胶体。酸性蚀刻废液与碱性蚀刻废液混和反应装置如图1所示。不同pH时,铜元素回收率如图2所示。
沉淀,pH在4~5之间易生成氢氧化铜胶体。酸性蚀刻废液与碱性蚀刻废液混和反应装置如图1所示。不同pH时,铜元素回收率如图2所示。
①为减少
 胶体形成而影响后续操作,溶液A为
胶体形成而影响后续操作,溶液A为②
 时,铜元素回收率下降的原因为
时,铜元素回收率下降的原因为(4)设计从酸性蚀刻废液中制备氧化铜的实验方案。向一定质量的酸性蚀刻废液中
 溶液、硝酸银溶液、稀硝酸、蒸馏水)
溶液、硝酸银溶液、稀硝酸、蒸馏水)
您最近半年使用:0次
4 . 下图是利用废铜屑(含杂质铁)制备胆矾(硫酸铜晶体)的流程。
部分正离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)铜原子的价电子排布式为___________ 。
(2)若恰好完全沉淀时, 的浓度为
的浓度为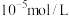 ,则常温下氢氧化铜的
,则常温下氢氧化铜的
___________ (用科学计数法表示)。
(3)溶液B中含有的金属离子有___________ (填离子符号)。
(4)下列物质中可以做氧化剂X的是___________(不定项)。
(5)试剂①可通过调节pH除去 。沉淀D的化学式为
。沉淀D的化学式为___________ ,试剂①可以选择___________ (填化学式),操作时需控制pH值的范围为___________ 。
(6)写出实验室配制 溶液的方法:
溶液的方法:___________ 。
(7)溶液E经过操作①可得到胆矾,操作①为___________ 、___________ 、过滤、洗涤、干燥。

部分正离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |  |  |  |
| 开始沉淀 | 2.7 | 7.5 | 4.4 |
| 完全沉淀 | 3.7 | 9.7 | 6.7 |
(1)铜原子的价电子排布式为
(2)若恰好完全沉淀时,
 的浓度为
的浓度为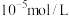 ,则常温下氢氧化铜的
,则常温下氢氧化铜的
(3)溶液B中含有的金属离子有
(4)下列物质中可以做氧化剂X的是___________(不定项)。
A. | B. | C. | D.氧气 |
(5)试剂①可通过调节pH除去
 。沉淀D的化学式为
。沉淀D的化学式为(6)写出实验室配制
 溶液的方法:
溶液的方法:(7)溶液E经过操作①可得到胆矾,操作①为
您最近半年使用:0次
5 . 某铜矿石的主要成分为Cu2O,还含有少量Al2O3、Fe2O3、SiO2。工业上用该矿石获取铜和胆矾的操作流程如下:
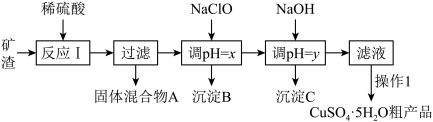
已知:①Cu2O+2H+=Cu+Cu2++H2O
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
请回答下列问题:
(1)实际生产中将矿石粉碎为矿渣的目的是___________ 。
(2)固体混合物A中含有较多的铜,加入某试剂可以提纯铜。该反应的离子方程式为___________ 。
(3)反应Ⅰ完成后的滤液中铁元素的存在形式为___________ (填离子符号),检验该离子常用的试剂为___________ ,生成该离子的离子方程式为___________ 。
(4)加入NaClO调节溶液pH可生成沉淀B,利用题中所给信息,沉淀B为___________ ,该反应中氧化剂与还原剂物质的量之比为___________ 。
(5)加入NaOH调节pH,得到沉淀C,利用题中所给信息分析y的范围___________ 。
(6)操作1主要包括:蒸发浓缩、冷却结晶、过滤、 冷水洗涤得到CuSO4·5H2O。如何洗涤CuSO4·5H2O粗品___________ 。

已知:①Cu2O+2H+=Cu+Cu2++H2O
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 5.4 | 4.0 | 2.7 | 5.8 |
| 沉淀完全的pH | 6.7 | 5.2 | 3.7 | 8.8 |
(1)实际生产中将矿石粉碎为矿渣的目的是
(2)固体混合物A中含有较多的铜,加入某试剂可以提纯铜。该反应的离子方程式为
(3)反应Ⅰ完成后的滤液中铁元素的存在形式为
(4)加入NaClO调节溶液pH可生成沉淀B,利用题中所给信息,沉淀B为
(5)加入NaOH调节pH,得到沉淀C,利用题中所给信息分析y的范围
(6)操作1主要包括:蒸发浓缩、冷却结晶、过滤、 冷水洗涤得到CuSO4·5H2O。如何洗涤CuSO4·5H2O粗品
您最近半年使用:0次
2023-04-17更新
|
260次组卷
|
2卷引用:河南省驻马店高级中学2022-2023学年高一下学期期中考试化学试题
解题方法
6 . CuCl2是常见的化学试剂,某学习小组利用废铜屑“湿法”制备CuCl2·2H2O。
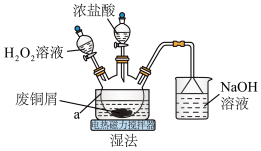
氯化铜在不同温度下结晶形成的结晶水合物,回答下列问题:
(1)仪器a的名称为___________ ,NaOH溶液的作用是___________ 。
(2)“湿法”制备CuCl2的离子方程式为___________ ,实验中,H2O2的实际用量要大于理论用量,原因是___________ 。
(3)为得到纯净的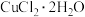 晶体,反应完全后要进行的操作是:除去其他可能的金属离子后,过滤,向滤液中持续通入HCl气体,加热蒸发浓缩,
晶体,反应完全后要进行的操作是:除去其他可能的金属离子后,过滤,向滤液中持续通入HCl气体,加热蒸发浓缩,___________ ,过滤,洗涤,低温干燥。其中,持续通入HCl的作用是___________ 。

氯化铜在不同温度下结晶形成的结晶水合物,回答下列问题:
| 温度 | 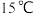 以下 以下 | 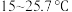 | 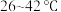 | 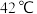 以上 以上 |
| 结晶水合物 | 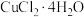 |  | 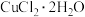 | 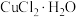 |
(2)“湿法”制备CuCl2的离子方程式为
(3)为得到纯净的
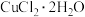 晶体,反应完全后要进行的操作是:除去其他可能的金属离子后,过滤,向滤液中持续通入HCl气体,加热蒸发浓缩,
晶体,反应完全后要进行的操作是:除去其他可能的金属离子后,过滤,向滤液中持续通入HCl气体,加热蒸发浓缩,
您最近半年使用:0次
解题方法
7 . 某科学研究小组设计以辉钼矿(MoS2、CuFeS2、Cu2S及SiO2等)为原料制备少量钼酸铵的工艺流程如下:

已知:①“焙砂”中有MoO3、CuSO4、CuMoO4、Fe2O3、Fe2(SO4)3、SiO2。
②“氨浸”时,铜元素转化为[Cu(NH3)4](OH)2(深蓝色),钼元素转化为(NH4)2MoO4。
③[Cu(NH3)4](OH)2=[Cu(NH3)4]2++2OH—。
回答下列问题:
(1)为了使辉钼矿充分焙烧,需要采取的措施是_______ (写出一种)。
(2)焙烧过程中MoS2转化成MoO3的化学方程式为_______ 。
(3)反应CuFeS2+O2=CuSO4+Fe2O3+Fe2(SO4)3(未配平)氧化剂与还原剂物质的量比为_______
(4)“氨浸”时发生多个反应,其中CuMoO4被浸取的化学方程式为_______ 。
(5)“滤渣1”的成分有SiO2、_______ (填化学式)。
(6)“沉铜”是在80℃时进行的,发生反应的离子方程式为_______
(7)已知a克辉钼矿中含铜质量分数为8%,若“沉铜”工序得到b克沉淀物,则沉铜率为_______ (用含a、b的代数式表示)。

已知:①“焙砂”中有MoO3、CuSO4、CuMoO4、Fe2O3、Fe2(SO4)3、SiO2。
②“氨浸”时,铜元素转化为[Cu(NH3)4](OH)2(深蓝色),钼元素转化为(NH4)2MoO4。
③[Cu(NH3)4](OH)2=[Cu(NH3)4]2++2OH—。
回答下列问题:
(1)为了使辉钼矿充分焙烧,需要采取的措施是
(2)焙烧过程中MoS2转化成MoO3的化学方程式为
(3)反应CuFeS2+O2=CuSO4+Fe2O3+Fe2(SO4)3(未配平)氧化剂与还原剂物质的量比为
(4)“氨浸”时发生多个反应,其中CuMoO4被浸取的化学方程式为
(5)“滤渣1”的成分有SiO2、
(6)“沉铜”是在80℃时进行的,发生反应的离子方程式为
(7)已知a克辉钼矿中含铜质量分数为8%,若“沉铜”工序得到b克沉淀物,则沉铜率为
您最近半年使用:0次
名校
解题方法
8 . 某小组同学通过实验研究 溶液与Cu粉发生的氧化还原反应。实验记录如下:
溶液与Cu粉发生的氧化还原反应。实验记录如下:
下列说法不正确 的是
 溶液与Cu粉发生的氧化还原反应。实验记录如下:
溶液与Cu粉发生的氧化还原反应。实验记录如下:| 序号 | Ⅰ | Ⅱ | Ⅲ |
| 实验步骤 | 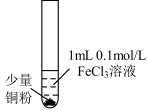 充分振荡,加2mL蒸馏水 | 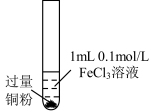 充分振荡,加入2mL蒸馏水 |  充分振荡,加入2mL蒸馏水 |
| 实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀 |
A.实验Ⅰ、Ⅱ、Ⅲ中均涉及 被还原 被还原 |
| B.对比实验Ⅰ、Ⅱ说明白色沉淀的产生与铜粉的量有关 |
C.实验Ⅱ、Ⅲ中加入蒸馏水后 不相同 不相同 |
| D.向实验Ⅲ反应后的溶液中加入饱和NaCl溶液不可能出现白色沉淀 |
您最近半年使用:0次
2021-10-12更新
|
339次组卷
|
3卷引用:黑龙江省佳木斯市第八中学2021-2022学年高三上学期第二次调研(期中)考试化学试题
名校
解题方法
9 . 10℃时,分别向4支小试管中滴加8滴1mol/LCuSO4溶液,再分别向其中滴加2mol/LNaOH溶液,边滴加边振荡,实验数据及现象如下表:
取浅绿色沉淀用蒸馏水反复洗涤,加入稀盐酸完全溶解,再加入适量BaCl2溶液,产生大量白色沉淀。取蓝色沉淀重复上述实验,无白色沉淀。经检验,试管3、4中黑色沉淀中含有CuO。
下列说法不正确 的是
| 试管编号 | 1 | 2 | 3 | 4 |
| 滴加NaOH溶液的量 | 2滴 | 6滴 | 12滴 | 16滴 |
| 立即观察沉淀的颜色 | 浅绿色 | 浅绿色 | 蓝色 | 蓝色 |
| 酒精灯加热浊液后沉淀的颜色 | 浅绿色 | 浅绿色 | 黑色 | 黑色 |
下列说法
| A.由实验现象可知浅绿色沉淀中可能含有碱式硫酸铜 |
| B.CuSO4溶液与NaOH溶液反应时,其相对量不同可以得到不同的产物 |
C.试管3、4中的固体在加热过程中发生了反应:Cu(OH)2 CuO+H2O CuO+H2O |
| D.取浅绿色沉淀再滴加适量NaOH溶液后加热仍不会变黑 |
您最近半年使用:0次
2021-05-10更新
|
958次组卷
|
6卷引用:北京市第二十二中学2021-2022学年高三上学期期中考试化学试题
北京市第二十二中学2021-2022学年高三上学期期中考试化学试题北京市西城区2021届高三化学第二次模拟考试(已下线)第三章能力提升检测卷-2022年高考化学一轮复习讲练测2020年北京高考化学真题变式题11-19北京市房山区2022-2023学年高三上学期期末考试化学试题(已下线)北京市第四中学2022-2023学年高三下学期零模化学试题
名校
解题方法
10 . 某含结晶水的盐A是制备负载型活性铁催化剂的主要原料,由五种常见元素组成,M(A)<500 g·mol−1。某兴趣小组对盐A进行了实验探究,流程如下:
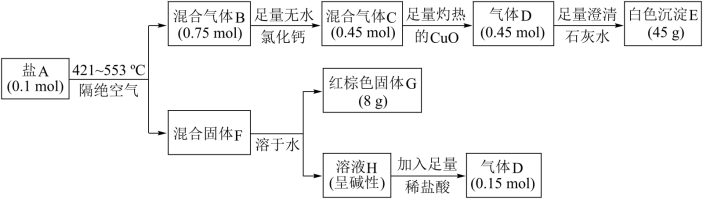
已知:①混合气体C转化为气体D时,质量增加了4.8 g;②溶液H为单一溶质,且不与氢氧化钾反应,焰色反应呈紫色。请回答:
(1)盐A除Fe、H、O以外的两种元素是_____ 。(填元素符号)
(2)混合气体C的组成成分_____ (填化学式)
(3)盐A在421~553℃下分解生成混合气体B和混合固体F的化学方程式:_____ 。
(4)盐A中加入足量稀硫酸,可得到一种二元弱酸,且该弱酸可以被酸性高锰酸钾溶液氧化生成气体D,试写出该弱酸被氧化的离子方程式:_______ 。
(5)某兴趣小组用混合气体C还原少量CuO粉末,使CuO完全反应得到红色产物。为确定红色产物的成分,请设计实验方案:_______ 。(已知:Cu2O+2H+=Cu2++Cu+H2O)

已知:①混合气体C转化为气体D时,质量增加了4.8 g;②溶液H为单一溶质,且不与氢氧化钾反应,焰色反应呈紫色。请回答:
(1)盐A除Fe、H、O以外的两种元素是
(2)混合气体C的组成成分
(3)盐A在421~553℃下分解生成混合气体B和混合固体F的化学方程式:
(4)盐A中加入足量稀硫酸,可得到一种二元弱酸,且该弱酸可以被酸性高锰酸钾溶液氧化生成气体D,试写出该弱酸被氧化的离子方程式:
(5)某兴趣小组用混合气体C还原少量CuO粉末,使CuO完全反应得到红色产物。为确定红色产物的成分,请设计实验方案:
您最近半年使用:0次
2021-05-08更新
|
316次组卷
|
3卷引用:江西省景德镇市第一中学2021-2022学年高一上学期期中18班化学试题
江西省景德镇市第一中学2021-2022学年高一上学期期中18班化学试题浙江省温州市2021届普通高中高考5月适应性测试(三模)化学试题(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)



