1 . 工业上常以黄铜矿(主要成分是CuFeS2)为原料制备铜以及副产物铁红(Fe2O3),两种方法均能实现铜的冶炼,其工艺流程如图:

回答下列问题:
(1)为使“焙烧”反应充分进行,工业上可采取的措施是____ (写一条),写出“焙烧”时反应的化学方程式:___ 。
(2)“灼烧1”工序中起氧化作用的物质是____ 。
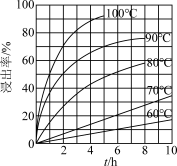
(3)FeCl3溶液“浸取”时,铜的浸出率结果如图所示。由图可知,当铜的浸出率为90%时,所采用的实验条件为____ ,写出该工序发生反应的离子方程式:______ 。
(4)“调节pH”所用试剂X是_____ ,该工序的目的是除去溶液中的Fe3+。当调节溶液的pH=3.5时,Fe3+______ (填“是”或“不是”)沉淀完全[c(Fe3+)≤1×10-5mol•L-1时可认为Fe3+沉淀完全],若滤液中c(Cu2+)=0.2mol•L-1,此时是否有Cu(OH)2析出?_______ (列式计算)。{已知:25℃时,Ksp[Fe(OH)3]=1.0×10-39、Ksp[Cu(OH)2]=2.2×10-20}
(5)方法乙比方法甲更好,其原因是_____ (写一点)。

回答下列问题:
(1)为使“焙烧”反应充分进行,工业上可采取的措施是
(2)“灼烧1”工序中起氧化作用的物质是
(3)FeCl3溶液“浸取”时,铜的浸出率结果如图所示。由图可知,当铜的浸出率为90%时,所采用的实验条件为

(4)“调节pH”所用试剂X是
(5)方法乙比方法甲更好,其原因是
您最近一年使用:0次
名校
2 . 氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料、防腐等工业,它不溶于H2SO4、HNO3和醇,微溶于水,可溶于浓盐酸和氨水,在潮湿空气中易水解氧化成绿色的碱式氯化铜[Cu2(OH)3Cl]。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:

(1)写出溶解过程中发生的氧化还原反应的离子方程式:_________
(2)还原过程中发生的主要反应的离子方程式:_________ 。
(3)析出的CuCl晶体水洗后要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2h,冷却密封包装。70℃真空干燥、密封包装的原因是__________ 。
(4)写出氯化亚铜在空气中被氧化的化学方程式________
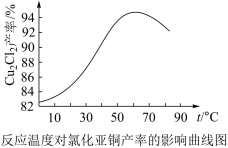
(5)如图是各反应物在最佳配比条件下,反应温度对CuCl产率影响.由图可知,溶液温度控制在60℃时,CuCl产率能达到94%,当温度高于65℃时,CuCl产率会下降,其原因可能是___ 。
(6)以碳棒为电极电解CuCl2溶液也可得到CuCl,写出电解时阴极上发生的电极反应式:____

(1)写出溶解过程中发生的氧化还原反应的离子方程式:
(2)还原过程中发生的主要反应的离子方程式:
(3)析出的CuCl晶体水洗后要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2h,冷却密封包装。70℃真空干燥、密封包装的原因是
(4)写出氯化亚铜在空气中被氧化的化学方程式
(5)如图是各反应物在最佳配比条件下,反应温度对CuCl产率影响.由图可知,溶液温度控制在60℃时,CuCl产率能达到94%,当温度高于65℃时,CuCl产率会下降,其原因可能是

(6)以碳棒为电极电解CuCl2溶液也可得到CuCl,写出电解时阴极上发生的电极反应式:
您最近一年使用:0次
2019-06-12更新
|
1147次组卷
|
2卷引用:湖北省黄冈中学2019届高三6月适应性考试(最后一卷)理综化学试题
2019·全国·三模
3 . CuCl广泛用于颜料、电镀和有机合成等方面。已知:CuCl在干燥空气中稳定,受潮则易变蓝到棕色,露置在空气中迅速氧化成碱式盐,呈绿色,化学反应为:4CuCl+O2+2H2O=4Cu(OH)Cl。CuCl在水中水解:CuCl+H2O CuOH+HCl,2CuOH=Cu2O+H2O。工业上,常以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化法制备CuCl,其工艺流程如下:
CuOH+HCl,2CuOH=Cu2O+H2O。工业上,常以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化法制备CuCl,其工艺流程如下:
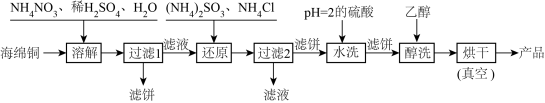
请回答下列问题:
(1)为了提高“溶解”速率,工业生产中宜采用的措施有____________ (答两条即可)。
(2)写出“溶解”过程中属于氧化还原反应的离子方程式:_________ 。
(3)“过滤2”所得滤液经蒸发浓缩、降温结晶、过滤等操作获得一种化学肥料,它的主要成分是________ (填化学式)。写出“还原”过程中的化学方程式:_________ 。
(4)工业生产中,用pH=2的硫酸洗涤“产品”,其目的是_________ ;用乙醇洗涤的优点是________________ 。
(5)探究(NH4)2SO3、NH4Cl与Cu2+的相对用量和Cu2+沉淀率的关系如图1和图2所示。
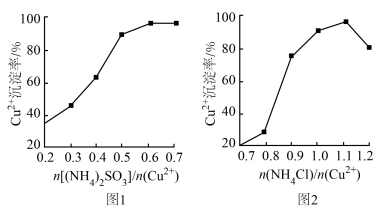
由实验表明,投料比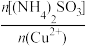 、
、 的最佳值分为
的最佳值分为______ 、_____ 。
(6)已知:现有x t工业海绵铜(铜元素的质量分数为w)经上述流程,最终得到y t CuCl产品。则CuCl的产率为____________ (用代数式表示)。
 CuOH+HCl,2CuOH=Cu2O+H2O。工业上,常以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化法制备CuCl,其工艺流程如下:
CuOH+HCl,2CuOH=Cu2O+H2O。工业上,常以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化法制备CuCl,其工艺流程如下:
请回答下列问题:
(1)为了提高“溶解”速率,工业生产中宜采用的措施有
(2)写出“溶解”过程中属于氧化还原反应的离子方程式:
(3)“过滤2”所得滤液经蒸发浓缩、降温结晶、过滤等操作获得一种化学肥料,它的主要成分是
(4)工业生产中,用pH=2的硫酸洗涤“产品”,其目的是
(5)探究(NH4)2SO3、NH4Cl与Cu2+的相对用量和Cu2+沉淀率的关系如图1和图2所示。

由实验表明,投料比
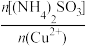 、
、 的最佳值分为
的最佳值分为(6)已知:现有x t工业海绵铜(铜元素的质量分数为w)经上述流程,最终得到y t CuCl产品。则CuCl的产率为
您最近一年使用:0次
4 . 2018年第十二届中国国际航空航天博览会于11月6日至11日在珠海举行。银铜合金广泛用于航空工业,从银铜合金的切割废料中回收银并制备铜化工产品的工艺如下:
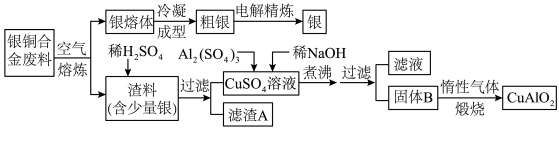
注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃。
(1)电解精炼银时,粗银作______ 极,另一电极上的电极反应式为____________ 。
(2)加快渣料(含少量银)溶于稀H2SO4的速率的措施有________ 、________ (写出两种)。
(3)滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,滤渣A与稀HNO3反应的离子方程式为__________ 。
(4)煮沸CuSO4混合溶液的过程中,得到固体B,则固体B的组成为______ ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为___________ 。
(5)硫酸铜溶液可用于浸取硫铁矿中的铁元素,浸取时发生复杂的氧化还原反应。反应体系中除CuSO4和FeS2外,还有H2SO4、Cu2S、FeSO4和H2O,下列对该反应的分析正确的是______ (填字母代号)。
A.氧化剂为CuSO4和FeS2
B.反应后溶液的pH降低
C.被氧化的FeS2只占总量的30%
D.每转移2 mol电子消耗3 mol CuSO4

注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃。
(1)电解精炼银时,粗银作
(2)加快渣料(含少量银)溶于稀H2SO4的速率的措施有
(3)滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,滤渣A与稀HNO3反应的离子方程式为
(4)煮沸CuSO4混合溶液的过程中,得到固体B,则固体B的组成为
(5)硫酸铜溶液可用于浸取硫铁矿中的铁元素,浸取时发生复杂的氧化还原反应。反应体系中除CuSO4和FeS2外,还有H2SO4、Cu2S、FeSO4和H2O,下列对该反应的分析正确的是
A.氧化剂为CuSO4和FeS2
B.反应后溶液的pH降低
C.被氧化的FeS2只占总量的30%
D.每转移2 mol电子消耗3 mol CuSO4
您最近一年使用:0次
名校
解题方法
5 . 中国航空航天事业飞速发展,银铜合金广泛用于航空工业。从银铜合金切割废料中回收银并制备铜化工产品的工艺如下:

注:A1(OH)3和Cu(OH)2分解温度分别为450℃和80℃
(1)在电解精炼银时,阳极材料为___________ 。
(2)加快渣料(含少量银)溶于稀H2SO4速率的措施为___________ (写出两种)。
(3)滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,滤渣A与稀HNO3反应的离子方程式为______________________ 。
(4)过滤操作需要的玻璃仪器除烧杯外还有___________ 。
(5)固体混合物B的组成为___________ ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为___________ 。
(6)煅烧阶段通入惰性气体的原因___________ 。

注:A1(OH)3和Cu(OH)2分解温度分别为450℃和80℃
(1)在电解精炼银时,阳极材料为
(2)加快渣料(含少量银)溶于稀H2SO4速率的措施为
(3)滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,滤渣A与稀HNO3反应的离子方程式为
(4)过滤操作需要的玻璃仪器除烧杯外还有
(5)固体混合物B的组成为
(6)煅烧阶段通入惰性气体的原因
您最近一年使用:0次
2019-04-08更新
|
524次组卷
|
9卷引用:【市级联考】宁夏回族自治区银川市2019届高三质量检测理科综合化学试题
名校
6 . 信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含 70%Cu、25%Al、4%Fe 及少量 Au、Pt 的合金,并设计出由合金制备硫酸铜和硫酸铝晶体的路线:
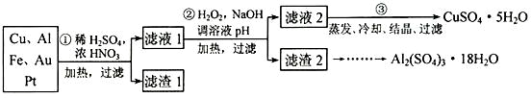
请回答下列问题:
(1)第①步 Cu与酸反应的离子方程式为__________________ ,得到滤渣 1的主要成分为_______________ 。
(2)第②步加 H2O2的作用是做氧化剂,将溶液中的 Fe2+氧化为 Fe3+,用 H2O2做氧化剂的优点是____________________ 。
(3)滤渣 2的主要成分是 Al(OH)3和 Fe(OH)3,在生产中如何分离两种沉淀,写出反应的离子方程式______________ 。
(4)第③步蒸发所需玻璃仪器为__________________ 。

请回答下列问题:
(1)第①步 Cu与酸反应的离子方程式为
(2)第②步加 H2O2的作用是做氧化剂,将溶液中的 Fe2+氧化为 Fe3+,用 H2O2做氧化剂的优点是
(3)滤渣 2的主要成分是 Al(OH)3和 Fe(OH)3,在生产中如何分离两种沉淀,写出反应的离子方程式
(4)第③步蒸发所需玻璃仪器为
您最近一年使用:0次
2019-03-04更新
|
349次组卷
|
2卷引用:步步为赢 高一化学寒假作业:作业十八 综合评估(二)
2019高三上·全国·专题练习
7 . 以黄铜矿(主要成分为CuFeS2)为原料冶炼铜的工艺流程如下:

(1)已知CuFeS2和CuCl2之间发生反应CuFeS2+3CuCl2=4CuCl+FeCl2+2S,其中被氧化的元素为________ 。
(2)若“过滤1”所得滤液中只含FeCl2,则将其在空气中加热蒸干、灼烧后,所得固体的化学式为__________ 。
(3)“除硫”时加入浓盐酸发生反应的离子方程式为____________________ 。
(4)“过滤3”所得滤液中可以循环使用的物质为____________ 。
(5)冶炼工艺还可以将精选后的黄铜矿砂于空气中在高温下煅烧,使其转变为铜,发生的反应为6CuFeS2+13O2 3Cu2S+2Fe3O4+9SO2、Cu2S+O2
3Cu2S+2Fe3O4+9SO2、Cu2S+O2 2Cu+SO2。
2Cu+SO2。
此工艺与前一工艺相比主要缺点有____________ (任答一点)。
(6)铜溶解于H2O2和H2SO4的混合溶液中可制备CuSO4。测定CuSO4溶液中Cu2+浓度的方法为:准确量取V1 mL溶液于锥形瓶中,调节pH至3~4,加入过量KI溶液,充分反应后,滴加2滴淀粉溶液,再慢慢滴加c mol/L的Na2S2O3标准溶液至恰好完全反应,消耗Na2S2O3标准溶液V2 mL。上述过程中发生的反应为2Cu2++4I-=2CuI↓+I2、2S2O32-+I2=S4O62-+2I-。
①“恰好完全反应”时溶液的颜色变化为_______________ 。
②CuSO4溶液中Cu2+的物质的量浓度为____ mol/L(用含c、V1、V2的代数式表示)。

(1)已知CuFeS2和CuCl2之间发生反应CuFeS2+3CuCl2=4CuCl+FeCl2+2S,其中被氧化的元素为
(2)若“过滤1”所得滤液中只含FeCl2,则将其在空气中加热蒸干、灼烧后,所得固体的化学式为
(3)“除硫”时加入浓盐酸发生反应的离子方程式为
(4)“过滤3”所得滤液中可以循环使用的物质为
(5)冶炼工艺还可以将精选后的黄铜矿砂于空气中在高温下煅烧,使其转变为铜,发生的反应为6CuFeS2+13O2
 3Cu2S+2Fe3O4+9SO2、Cu2S+O2
3Cu2S+2Fe3O4+9SO2、Cu2S+O2 2Cu+SO2。
2Cu+SO2。此工艺与前一工艺相比主要缺点有
(6)铜溶解于H2O2和H2SO4的混合溶液中可制备CuSO4。测定CuSO4溶液中Cu2+浓度的方法为:准确量取V1 mL溶液于锥形瓶中,调节pH至3~4,加入过量KI溶液,充分反应后,滴加2滴淀粉溶液,再慢慢滴加c mol/L的Na2S2O3标准溶液至恰好完全反应,消耗Na2S2O3标准溶液V2 mL。上述过程中发生的反应为2Cu2++4I-=2CuI↓+I2、2S2O32-+I2=S4O62-+2I-。
①“恰好完全反应”时溶液的颜色变化为
②CuSO4溶液中Cu2+的物质的量浓度为
您最近一年使用:0次
2019高三·全国·专题练习
解题方法
8 . 孔雀石的主要成分为Cu2(OH)2CO3。某同学设计的从孔雀石中冶炼铜的方案如下(假设孔雀石中杂质不溶于水和稀硫酸):

(1)反应①能观察到的现象是__________ ,有关反应的化学方程式为________ 。
(2)反应②加入的金属可能是______ ,有关反应的离子方程式为________ 。

(1)反应①能观察到的现象是
(2)反应②加入的金属可能是
您最近一年使用:0次
解题方法
9 . 某实验室模拟以工业用菱铁矿(FeCO3)含碱式碳酸铜[Cu2(OH)2CO3]为原料制取纯净的FeCO3和氯化铜晶体(CuCl2·2H2O)的生产流程如下:
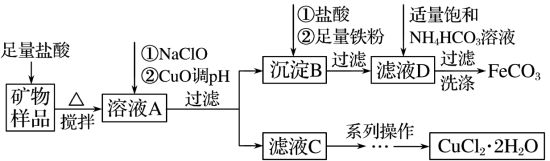
(1)盐酸溶解矿物样品时可能发生的离子方程式______ 。
(2)写出向溶液A中加入NaClO的离子方程式_________ 。
(3)向沉淀B中依次加入盐酸和铁粉时可能发生的离子方程式_________ 。
(4)处理滤液D时,除产生沉淀外,还产生无色气体,写出该反应的离子方程式_________ 。

(1)盐酸溶解矿物样品时可能发生的离子方程式
(2)写出向溶液A中加入NaClO的离子方程式
(3)向沉淀B中依次加入盐酸和铁粉时可能发生的离子方程式
(4)处理滤液D时,除产生沉淀外,还产生无色气体,写出该反应的离子方程式
您最近一年使用:0次
名校
解题方法
10 . 氯化亚铜(CuCl,白色、易被氧化,Ksp=1.2×10-6)广泛用作催化剂、脱臭剂、脱色剂等。工业上用初级铜矿粉(主要含Cu2S、CuS、Fe2O3、FeO等)制备活性CuCl的流程如下:
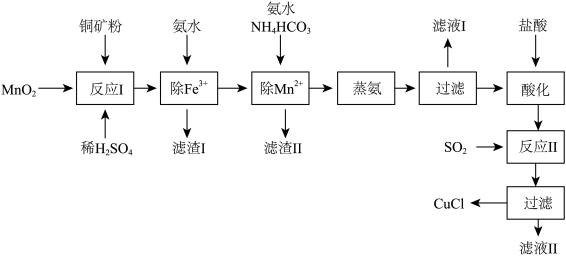
(1)滤渣Ⅰ是Fe(OH)3和单质硫的混合物,反应Ⅰ中Cu2S参与反应的化学方程式为:Cu2S+MnO2 + H2SO4→CuSO4 +S+MnSO4 + H2O(未配平);氧化产物为:__________ 。
(2)除Mn2+时得MnCO3沉淀,该反应的离子方程式为_________________________ 。
(3)已知:Cu(OH)2可溶于氨水形成深蓝色溶液。Cu(OH)2+4NH3 [Cu(NH3)4]2++2OH-。蒸氨条件及蒸氨效果见下表:
[Cu(NH3)4]2++2OH-。蒸氨条件及蒸氨效果见下表:
由表中信息可知蒸氨的条件应选_______ (填序号),请用平衡移动原理解释选择该条件的原因是_________________________ 。
(4)反应Ⅱ的离子方程式___________________________ 。
(5)实验证明通过如图装置也可获得CuCl,现象为
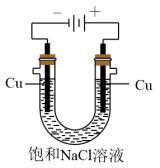
阴极:产生无色气体;
阳极:有白色胶状沉淀生成且逐渐增多;
U形管底部:靠近阴极区白色胶状沉淀逐渐转化为淡黄色沉淀。
①生成CuCl的电极反应式为________________________________ 。
②有同学提出:淡黄色沉淀可能是CuOH,以下是从资料中查阅到CuOH的有关信息,哪些可以支持该同学的说法________ 。(填序号)
a.容易脱水变成红色的Cu2O b.CuOH是黄色或淡黄色固体,不溶于水
c.CuOH的Ksp=2×10-15 d.易被氧化成Cu(OH)2

(1)滤渣Ⅰ是Fe(OH)3和单质硫的混合物,反应Ⅰ中Cu2S参与反应的化学方程式为:Cu2S+MnO2 + H2SO4→CuSO4 +S+MnSO4 + H2O(未配平);氧化产物为:
(2)除Mn2+时得MnCO3沉淀,该反应的离子方程式为
(3)已知:Cu(OH)2可溶于氨水形成深蓝色溶液。Cu(OH)2+4NH3
 [Cu(NH3)4]2++2OH-。蒸氨条件及蒸氨效果见下表:
[Cu(NH3)4]2++2OH-。蒸氨条件及蒸氨效果见下表:| 序号 | 温度/℃ | 时间/min | 压强/KPa | 残液颜色 |
| a | 100 | 60 | 101.3 | 浅蓝色 |
| b | 100 | 40 | 74.6 | 几乎很浅 |
| c | 100 | 30 | 60.0 | 无色透明 |
(4)反应Ⅱ的离子方程式
(5)实验证明通过如图装置也可获得CuCl,现象为

阴极:产生无色气体;
阳极:有白色胶状沉淀生成且逐渐增多;
U形管底部:靠近阴极区白色胶状沉淀逐渐转化为淡黄色沉淀。
①生成CuCl的电极反应式为
②有同学提出:淡黄色沉淀可能是CuOH,以下是从资料中查阅到CuOH的有关信息,哪些可以支持该同学的说法
a.容易脱水变成红色的Cu2O b.CuOH是黄色或淡黄色固体,不溶于水
c.CuOH的Ksp=2×10-15 d.易被氧化成Cu(OH)2
您最近一年使用:0次
2018-05-29更新
|
1024次组卷
|
4卷引用:【全国百强校】广西南宁市第三中学2018届高三第二次模拟考试理综化学试题



