名校
解题方法
1 . A、B、C、D 四种可溶性盐,其阳离子分别是 Na+、Ba2+、Cu2+、Ag+中的某一种, 阴离子分别是 Cl-、 、
、 、
、 中的某一种。现做以下实验:
中的某一种。现做以下实验:
①将四种盐各取少量,分别溶于盛有 5mL 蒸馏水的四支试管中,只有 B 盐溶液呈蓝色。
②分别向 4 支试管中加入 2mL 稀盐酸,发现 A 盐溶液中产生白色沉淀,C 盐溶液中有较多气泡产生,而 D 盐溶液无明显现象。
(1)根据上述事实,推断这四种盐的化学式分别为:A_____ 、B_____ 、C_____ 、D_____ 。
(2)写出下列反应的离子方程式:
①C+D_____ ;
②B+D_____ ;
③C+HCl→气体_____ 。
 、
、 、
、 中的某一种。现做以下实验:
中的某一种。现做以下实验:①将四种盐各取少量,分别溶于盛有 5mL 蒸馏水的四支试管中,只有 B 盐溶液呈蓝色。
②分别向 4 支试管中加入 2mL 稀盐酸,发现 A 盐溶液中产生白色沉淀,C 盐溶液中有较多气泡产生,而 D 盐溶液无明显现象。
(1)根据上述事实,推断这四种盐的化学式分别为:A
(2)写出下列反应的离子方程式:
①C+D
②B+D
③C+HCl→气体
您最近一年使用:0次
2020-11-22更新
|
197次组卷
|
7卷引用:成都龙泉第二中学2019-2020学年高二上学期入学考试化学试题
2 . A~L为中学常见物质,A为绿色矿石,C为无色常见液体,D为金属氧化物,E为光合作用原料之一,F为硫酸,K、H分别为黑色固体单质C、Fe,J为红色金属单质,I的水溶液呈绿色,它们之间的转化关系如图所示。
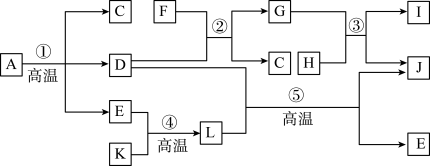
回答下列问题:
(1)A所含主要物质的化学式为__________ ,D 的化学式为__________ 。
(2)反应②的离子方程式为____________ 。
(3)写出反应③离子方程式并用单线桥法标明电子的转移:__________ 。
(4)反应⑤的现象为_______________ ,写出该反应的化学方程式并用双线桥法标明电子的转移且指出氧化剂、还原剂_________ 。

回答下列问题:
(1)A所含主要物质的化学式为
(2)反应②的离子方程式为
(3)写出反应③离子方程式并用单线桥法标明电子的转移:
(4)反应⑤的现象为
您最近一年使用:0次
名校
解题方法
3 . 为探索工业上含铝、铁、铜的合金废料的再利用情况,某同学设计的回收利用方案如图所示:

(1)写出步骤①中涉及反应的离子方程式:___________ 。
(2)步骤②中通入过量 生成沉淀C的离子方程式为
生成沉淀C的离子方程式为___________ 。
(3)由滤渣 滤液
滤液 滤渣E,需加入的试剂的化学式为
滤渣E,需加入的试剂的化学式为_______ 反应的离子方程式为_____________ 。
(4)检验滤液D中是否含有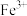 的最佳试剂为
的最佳试剂为___________ (填字母)。
A. 溶液 B.
溶液 B. 溶液 C.氯水 D.KSCN溶液
溶液 C.氯水 D.KSCN溶液
(5)试剂Y应是一种______ (填“氧化剂”或“还原剂”),它不可能是________ (填字母)。
A. B.铁单质 C.
B.铁单质 C.

(1)写出步骤①中涉及反应的离子方程式:
(2)步骤②中通入过量
 生成沉淀C的离子方程式为
生成沉淀C的离子方程式为(3)由滤渣
 滤液
滤液 滤渣E,需加入的试剂的化学式为
滤渣E,需加入的试剂的化学式为(4)检验滤液D中是否含有
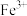 的最佳试剂为
的最佳试剂为A.
 溶液 B.
溶液 B. 溶液 C.氯水 D.KSCN溶液
溶液 C.氯水 D.KSCN溶液(5)试剂Y应是一种
A.
 B.铁单质 C.
B.铁单质 C.
您最近一年使用:0次
2020-10-02更新
|
590次组卷
|
4卷引用:人教版(2019)高一必修第一册 第三章 铁 金属材料 第二节 金属材料
10-11高三上·山西·期中
名校
解题方法
4 . 三氧化二铁和氧化亚铜( )都是红色粉末,常用作颜料。某校一化学实验小组通过实验探究一红色粉末的成分。探究过程如下:
)都是红色粉末,常用作颜料。某校一化学实验小组通过实验探究一红色粉末的成分。探究过程如下:
【查阅资料】 溶于稀硫酸生成Cu、
溶于稀硫酸生成Cu、 和
和 ,在空气中加热生成
,在空气中加热生成 。
。
【提出假设】假设1:红色粉末是 ;
;
假设2:红色粉末是 ;
;
假设3:红色粉末是 和
和 的混合物。
的混合物。
【设计实验】取少量该红色粉末加入足量稀硫酸中,再向所得溶液中滴加KSCN溶液。
(1)若假设1成立,则实验现象是____________________________________________________________ 。
(2)若滴加KSCN溶液,溶液不变红,则证明原红色粉末中一定不含 。你认为这种说法
。你认为这种说法_________ (填“合理”或“不合理”),理由是______________________________________________________ 。
(3)若红色粉末完全溶解,滴加KSCN溶液,溶液不变红,则证明原红色粉末是_____________________ ,写出发生反应的离子方程式:_________________________________________________________ 。
【探究延伸】
(4)经实验分析,确定该红色粉末为 和
和 的混合物。某实验小组欲用加热法测定该红色粉末中
的混合物。某实验小组欲用加热法测定该红色粉末中 的质量分数。取
的质量分数。取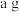 红色粉末在空气中充分加热,待质量不再变化时,称其质量为
红色粉末在空气中充分加热,待质量不再变化时,称其质量为 ,则该红色粉末中
,则该红色粉末中 的质量分数为
的质量分数为_____________________ 。
 )都是红色粉末,常用作颜料。某校一化学实验小组通过实验探究一红色粉末的成分。探究过程如下:
)都是红色粉末,常用作颜料。某校一化学实验小组通过实验探究一红色粉末的成分。探究过程如下:【查阅资料】
 溶于稀硫酸生成Cu、
溶于稀硫酸生成Cu、 和
和 ,在空气中加热生成
,在空气中加热生成 。
。【提出假设】假设1:红色粉末是
 ;
;假设2:红色粉末是
 ;
;假设3:红色粉末是
 和
和 的混合物。
的混合物。【设计实验】取少量该红色粉末加入足量稀硫酸中,再向所得溶液中滴加KSCN溶液。
(1)若假设1成立,则实验现象是
(2)若滴加KSCN溶液,溶液不变红,则证明原红色粉末中一定不含
 。你认为这种说法
。你认为这种说法(3)若红色粉末完全溶解,滴加KSCN溶液,溶液不变红,则证明原红色粉末是
【探究延伸】
(4)经实验分析,确定该红色粉末为
 和
和 的混合物。某实验小组欲用加热法测定该红色粉末中
的混合物。某实验小组欲用加热法测定该红色粉末中 的质量分数。取
的质量分数。取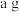 红色粉末在空气中充分加热,待质量不再变化时,称其质量为
红色粉末在空气中充分加热,待质量不再变化时,称其质量为 ,则该红色粉末中
,则该红色粉末中 的质量分数为
的质量分数为
您最近一年使用:0次
2020-10-02更新
|
499次组卷
|
7卷引用:2010年山西省山大附中高三上学期期中考试化学卷
(已下线)2010年山西省山大附中高三上学期期中考试化学卷【全国百强校】河北省张家口市第一中学2018-2019学年高一(衔接班)下学期开学考试化学试题高一必修第一册(鲁科2019)第3章 第1节 铁的多样性 方法帮人教版(2019)高一必修第一册 第三章 铁 金属材料 第一节 铁及其化合物 方法帮(已下线)第3章 章末检测-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)(已下线)2011届福建省泉州外国语中学高三上学期期中考试(理综)化学部分(已下线)2011-2012学年甘肃省天水一中高二第二学段测试化学试卷
5 . 有A、B、C、D、E、F六种化合物,它们之间的反应关系如下所示:
①A+B→C+E ②C + NaOH→蓝色沉淀D + F
③ D→A+E ④F + Ba(NO3)2 → 白色沉淀 + NaNO3
回答下列问题:
(1)写出它们的化学式:
A____________ ;B____________ ;C____________ ;
D____________ ;E____________ ;F____________ 。
(2)写出①④反应的离子方程式:
①_______ ;④_________ 。
①A+B→C+E ②C + NaOH→蓝色沉淀D + F
③ D→A+E ④F + Ba(NO3)2 → 白色沉淀 + NaNO3
回答下列问题:
(1)写出它们的化学式:
A
D
(2)写出①④反应的离子方程式:
①
您最近一年使用:0次
2020-09-23更新
|
1878次组卷
|
8卷引用:2012年鲁科版高中化学必修1 2.2电解质练习卷
解题方法
6 . 铝、铁、铜是生活中常见的金属。
(1)铝、铁、铜三种金属都能作导线,是因为它们都具有________ 。
(2)铝在空气中不易被锈蚀,是因为_____________ (用化学方程式表示)。
(3)铜锈的主要成分为碱式碳酸铜[Cu2(OH)2CO3],由此我们可以得到铜生锈是铜和氧气、水、____ 共同作用的结果。
(4)某同学用如图所示装置,设计实验验证铝、铁、铜三种金属活动性强弱。(每步反应金属均有剩余)
若甲试管中无明显现象,乙试管中的金属b为______ 时可以验证三种金属活动性强弱,丙试管中反应的化学方程式为________________ 若金属a、b、c依次为铁、铝、铜时,则无法比较___ 和___ 的活动性强弱。

(1)铝、铁、铜三种金属都能作导线,是因为它们都具有
(2)铝在空气中不易被锈蚀,是因为
(3)铜锈的主要成分为碱式碳酸铜[Cu2(OH)2CO3],由此我们可以得到铜生锈是铜和氧气、水、
(4)某同学用如图所示装置,设计实验验证铝、铁、铜三种金属活动性强弱。(每步反应金属均有剩余)
若甲试管中无明显现象,乙试管中的金属b为
您最近一年使用:0次
2020-08-06更新
|
76次组卷
|
2卷引用:开学考试化学试卷03——2020年秋季高一新生入学分班考试化学试卷(全国通用)
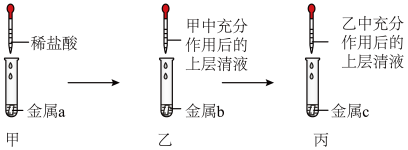
7 . 加强废旧金属的回收和再利用,是合理开发和利用金属资源的主要途径之一。下图是从镀铜废电路板中回收金属铜的一种工艺流程(各过程需控制适宜条件)。
(1)上述流程中,为加快化学反应速率而采取的措施是______ 。
(2)过程Ⅰ中,Cu溶解,过氧化氢的作用是______ 。
(3)过程Ⅱ中,获得Cu的反应的离子方程式为______ 。
(4)过程Ⅲ的目的是______ 。

(1)上述流程中,为加快化学反应速率而采取的措施是
(2)过程Ⅰ中,Cu溶解,过氧化氢的作用是
(3)过程Ⅱ中,获得Cu的反应的离子方程式为
(4)过程Ⅲ的目的是
您最近一年使用:0次
2020-08-04更新
|
300次组卷
|
5卷引用:2020年北京市第一次普通高中学业水平合格性考试化学试题
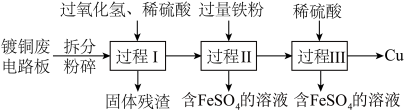
8 . 某化学小组设计实验,探究“NO2是否能与炽热的铜反应生成氧化铜和氮气”。
已知:①NO和FeSO4溶液反应:NO+FeSO4=FeSO4·NO(棕色)
②酸性KMnO4溶液吸收NO生成NO 和Mn2+
和Mn2+
③Cu2O在酸性条件下能发生反应:Cu2O+2H+=Cu2++Cu+H2O
设计实验所需装置如图所示(每个装置中液态试剂均足量,且不考虑A装置挥发出的硝酸对后续装置的影响)。
回答下列问题:
(1)该实验装置较复杂,检查气密性时采用分段检查的方法,请写出A装置气密性的检验方法___ 。
(2)该实验装置的连接顺序为:___ (填装置字母代号),C装置中盛装试剂是___ (填名称)。
(3)开始实验先引发A中反应,一段时间后再点燃D处酒精灯,这样操作的目的是___ 。
(4)实验过程中观察到下列现象,请回答:
①B中浅绿色溶液变棕色得出实验结论是___
a.二氧化氮与铜反应的还原产物一定有NO
b.二氧化氮与铜反应的还原产物一定无NO
c.二氧化氮与铜反应的还原产物可能有NO
②E中有明显现象,该现象是___ ,写出发生反应的离子方程式___ 。
(5)当D中铜粉完全反应时冷却至室温,停止A中反应,测得反应后D中固体粉末质量为ag,
①当a=___ (用含m的代数式表示)时,铜被氧化的产物全部是CuO;
②设计最简单的实验方案,验证反应后D中固体是否含有Cu2O___ (试剂选任)
已知:①NO和FeSO4溶液反应:NO+FeSO4=FeSO4·NO(棕色)
②酸性KMnO4溶液吸收NO生成NO
 和Mn2+
和Mn2+③Cu2O在酸性条件下能发生反应:Cu2O+2H+=Cu2++Cu+H2O
设计实验所需装置如图所示(每个装置中液态试剂均足量,且不考虑A装置挥发出的硝酸对后续装置的影响)。

回答下列问题:
(1)该实验装置较复杂,检查气密性时采用分段检查的方法,请写出A装置气密性的检验方法
(2)该实验装置的连接顺序为:
(3)开始实验先引发A中反应,一段时间后再点燃D处酒精灯,这样操作的目的是
(4)实验过程中观察到下列现象,请回答:
①B中浅绿色溶液变棕色得出实验结论是
a.二氧化氮与铜反应的还原产物一定有NO
b.二氧化氮与铜反应的还原产物一定无NO
c.二氧化氮与铜反应的还原产物可能有NO
②E中有明显现象,该现象是
(5)当D中铜粉完全反应时冷却至室温,停止A中反应,测得反应后D中固体粉末质量为ag,
①当a=
②设计最简单的实验方案,验证反应后D中固体是否含有Cu2O
您最近一年使用:0次
名校
9 . Fe2O3、Cu2O都是红色粉末,常用作颜料。某校化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O 溶于稀硫酸生成Cu和CuSO4;在空气中加热生成CuO.
提出假设:
假设1:红色粉末是Fe2O3
假设2:______ .
假设3:红色粉末是Cu2O和Fe2O3
(1)设计探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 溶液。
(2)若假设1成立,则实验现象是______ .
(3)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?______ .简述你的理由______ .
(4)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明假设______ 成立
(5)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为______ .
查阅资料:Cu2O 溶于稀硫酸生成Cu和CuSO4;在空气中加热生成CuO.
提出假设:
假设1:红色粉末是Fe2O3
假设2:
假设3:红色粉末是Cu2O和Fe2O3
(1)设计探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 溶液。
(2)若假设1成立,则实验现象是
(3)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?
(4)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明假设
(5)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为
您最近一年使用:0次
2020-06-06更新
|
246次组卷
|
2卷引用:甘肃省西北师范大学附属中学2019-2020学年高一上学期期末考试化学试题
10 . 某化学研究性学习小组探究与铜有关的物质的性质,过程设计如下:
提出猜想:
问题1:在元素周期表中,铜与铝的位置很接近,氢氧化铝具有两性,氢氧化铜有两性吗?
问题2:铁和铜都有变价,一般情况下,Fe2+的稳定性弱于的Fe3+,Cu+的稳定性也弱于Cu2+吗?
问题3:硫酸铜溶液呈蓝色,铜与浓硝酸常温下反应生成的溶液也是蓝色吗?
实验探究:
Ⅰ.解决问题1:
(1)实验需配制100mL0.50mol•L-1CuSO4溶液,必需的玻璃仪器有胶头滴管、烧杯、___ 、___ 。
(2)为达到目的,某同学认为只要进行两次实验即可得出结论。请写出实验②的具体内容。
①向盛有CuSO4溶液的试管中滴加NaOH溶液至过量,观察生成的Cu(OH)2沉淀是否溶解;
②___ 。
Ⅱ.解决问题2的实验和现象如下:
①取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃时得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;
②取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸,得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验及现象回答下列问题:
(3)写出氧化亚铜与稀硫酸反应的离子方程式:___ 。
(4)从实验中可得出的结论:当温度在1000℃以上时___ (填Cu2+或Cu+,下同)稳定,在酸性溶液中___ 稳定。
Ⅲ.解决问题3,某同学设计的实验如下:
取一铜片装入试管,加入适量的浓硝酸,观察溶液的颜色变化。
(5)另一同学认为此同学设计的实验有缺陷,原因是___ 。
(6)铜与浓硝酸反应溶液呈绿色,有同学认为这是生成的NO2溶于其中的原因。请设计实验说明此解释是否正确(只需要写出一种方法即可)。___
提出猜想:
问题1:在元素周期表中,铜与铝的位置很接近,氢氧化铝具有两性,氢氧化铜有两性吗?
问题2:铁和铜都有变价,一般情况下,Fe2+的稳定性弱于的Fe3+,Cu+的稳定性也弱于Cu2+吗?
问题3:硫酸铜溶液呈蓝色,铜与浓硝酸常温下反应生成的溶液也是蓝色吗?
实验探究:
Ⅰ.解决问题1:
(1)实验需配制100mL0.50mol•L-1CuSO4溶液,必需的玻璃仪器有胶头滴管、烧杯、
(2)为达到目的,某同学认为只要进行两次实验即可得出结论。请写出实验②的具体内容。
①向盛有CuSO4溶液的试管中滴加NaOH溶液至过量,观察生成的Cu(OH)2沉淀是否溶解;
②
Ⅱ.解决问题2的实验和现象如下:
①取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃时得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;
②取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸,得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验及现象回答下列问题:
(3)写出氧化亚铜与稀硫酸反应的离子方程式:
(4)从实验中可得出的结论:当温度在1000℃以上时
Ⅲ.解决问题3,某同学设计的实验如下:
取一铜片装入试管,加入适量的浓硝酸,观察溶液的颜色变化。
(5)另一同学认为此同学设计的实验有缺陷,原因是
(6)铜与浓硝酸反应溶液呈绿色,有同学认为这是生成的NO2溶于其中的原因。请设计实验说明此解释是否正确(只需要写出一种方法即可)。
| 实验步骤 | 实验结论 |
您最近一年使用:0次
2020-02-03更新
|
148次组卷
|
5卷引用:2020届高考化学二轮复习大题精准训练 ——物质性质的探究实验题



