1 . Cu2O是一种鲜红色粉末状固体,几乎不溶于水,在酸性溶液中歧化为二价铜和铜单质。可用于制造船底防污漆等。某校合作学习小组的同学设计实验验证其某些性质及其胶体的制法。回答下列问题:
(1)甲组同学检验H2还原CuO所得的红色粉末中是否有Cu2O。取反应产物少许加入试管中,加入足量的试剂X并搅拌,若发现溶液变蓝且仍有剩余固体,则试剂X可选用_____ (填序号)。
A.FeCl3溶液 B.硝酸 C.稀硫酸 d.H2O2酸性溶液
(2)乙组同学在两支试管中分别加入少量Cu2O,一支中加入稀硝酸,固体溶解同时产生NO气体,Cu2O表现_______________ 性;另一支加入硫酸酸化的KMnO4溶液,溶液紫色褪去得蓝色溶液,反应的离子方程式为______________ 。
(3)丙组同学取少量Cu2O与黑色的Cu2S混合加强热,产生大量的气体同时得到红色固体粉末,该反应的化学方程式为____________________ 。
(4)丁组同学向0.1mol·L-1 的(CH3COO)2Cu溶液中加入0.02mol·L-1的N2H4的水溶液,控制pH=7~8,得到红色透明液体,能说明该分散系属于胶体的简单方法是____________ 。已知制备过程中有N2放出,制备反应的化学方程式为________________ 。
(1)甲组同学检验H2还原CuO所得的红色粉末中是否有Cu2O。取反应产物少许加入试管中,加入足量的试剂X并搅拌,若发现溶液变蓝且仍有剩余固体,则试剂X可选用
A.FeCl3溶液 B.硝酸 C.稀硫酸 d.H2O2酸性溶液
(2)乙组同学在两支试管中分别加入少量Cu2O,一支中加入稀硝酸,固体溶解同时产生NO气体,Cu2O表现
(3)丙组同学取少量Cu2O与黑色的Cu2S混合加强热,产生大量的气体同时得到红色固体粉末,该反应的化学方程式为
(4)丁组同学向0.1mol·L-1 的(CH3COO)2Cu溶液中加入0.02mol·L-1的N2H4的水溶液,控制pH=7~8,得到红色透明液体,能说明该分散系属于胶体的简单方法是
您最近一年使用:0次
2017-11-04更新
|
417次组卷
|
4卷引用:学科网2019年高考化学一轮复习讲练测2.1 物质的组成、性质及分类 测
(已下线)学科网2019年高考化学一轮复习讲练测2.1 物质的组成、性质及分类 测江西省上饶中学2019届高三上学期开学检测化学试题山东省、安徽省名校2018届高三10月大联考化学试题江西省赣州市会昌中学2019届高三上学期第一次月考(10月)化学试题
2 . 工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:

(1)气体A中的大气污染物可选用下列试剂中的_____ 吸收.
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在______ (填离子符号),检验溶液中还存在Fe2+的方法是 __________
(3)由泡铜冶炼粗铜的化学反应方程式为____________________ .
(4)取一定量的泡铜,加入1L0.6mol/LHNO3溶液恰好完全溶解,同时放出2240mLNO气体(标准状况),另取等量的泡铜,用足量的H2还原,得到的铜的质量为_____ g。

(1)气体A中的大气污染物可选用下列试剂中的
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在
(3)由泡铜冶炼粗铜的化学反应方程式为
(4)取一定量的泡铜,加入1L0.6mol/LHNO3溶液恰好完全溶解,同时放出2240mLNO气体(标准状况),另取等量的泡铜,用足量的H2还原,得到的铜的质量为
您最近一年使用:0次
2016-12-09更新
|
624次组卷
|
3卷引用:2015-2016学年四川省成都树德中学高一下期末化学试卷
2015-2016学年四川省成都树德中学高一下期末化学试卷2017届湖南长沙一中高二上第一次月考(开学考试)化学卷(已下线)考点12 金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
名校
3 . 某学生研究小组欲探究CuSO4溶液与Na2CO3溶液混合产生的蓝绿色沉淀组成,小组进行下列实验探究。
【提出假设】
假设1:沉淀为Cu(OH)2
假设2:沉淀为________
假设3:沉淀为碱式碳酸铜[化学式可表示为nCuCO3•mCu(OH)2]
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
【物质成分探究】
步骤1:将所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤。
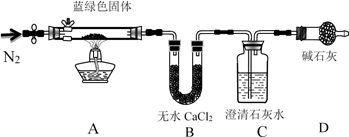
步骤2:甲同学取一定量固体,用气密性良好的下图装置(夹持仪器未画出)进行定性实验。请回答下列问题:
(1)假设2中的沉淀为________________ 。
(2)假设1中沉淀为Cu(OH)2的理论依据是____________________________________ 。
(3)无水乙醇洗涤的目的_________________________ 。
(4)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设__ (填写序号)成立。
(5)乙同学认为只要将上图中B装置的试剂改用____________ 试剂后,便可验证上述所有假设。
(6)乙同学更换B试剂后验证假设3成立的实验现象是_________________ 。
(7)在假设3成立的前提下,某同学考虑用Ba(OH)2代替Ca(OH)2,测定蓝绿色固体的化学式,若所取蓝绿色固体质量为27.1g,实验结束后装置B的质量增加2.7g,C中的产生沉淀的质量为19.7g。则该蓝绿色固体的化学式为____________________ 。
【提出假设】
假设1:沉淀为Cu(OH)2
假设2:沉淀为________
假设3:沉淀为碱式碳酸铜[化学式可表示为nCuCO3•mCu(OH)2]
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
【物质成分探究】
步骤1:将所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤。

步骤2:甲同学取一定量固体,用气密性良好的下图装置(夹持仪器未画出)进行定性实验。请回答下列问题:
(1)假设2中的沉淀为
(2)假设1中沉淀为Cu(OH)2的理论依据是
(3)无水乙醇洗涤的目的
(4)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设
(5)乙同学认为只要将上图中B装置的试剂改用
(6)乙同学更换B试剂后验证假设3成立的实验现象是
(7)在假设3成立的前提下,某同学考虑用Ba(OH)2代替Ca(OH)2,测定蓝绿色固体的化学式,若所取蓝绿色固体质量为27.1g,实验结束后装置B的质量增加2.7g,C中的产生沉淀的质量为19.7g。则该蓝绿色固体的化学式为
您最近一年使用:0次
2016-12-09更新
|
232次组卷
|
7卷引用:2016届四川省雅安市三诊理综化学试卷
名校
解题方法
4 . CuCl晶体呈白色,熔点为430℃,沸点为1490℃,见光分解,露置于潮湿空气中易被氧化,难溶于水、稀盐酸、乙醇,易溶于浓盐酸生成H3CuCl4,反应的化学方程式为CuCl(s)+3HCl(aq)⇌H3CuCl4(aq).
(1)实验室用如图1所示装置制取CuCl,反应原理为:
2Cu2++SO2+8Cl﹣+2H2O═2CuCl43﹣+SO42-+4H+
CuCl43﹣(aq)⇌CuCl(s)+3Cl﹣(aq)
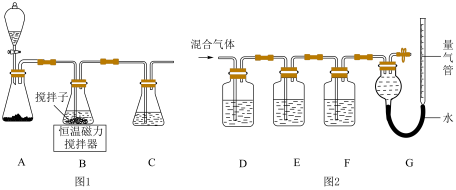
①装置C的作用是_____ .
②装置B中反应结束后,取出混合物进行如图所示操作,得到CuCl晶体.
混合物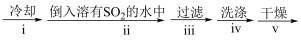 CuCl晶体
CuCl晶体
操作ⅱ的主要目的是_____
操作ⅳ中最好选用的试剂是_____ .
③实验室保存新制CuCl晶体的方法是_____ .
④欲提纯某混有铜粉的CuCl晶体,请简述实验方案:_____ .
(2)某同学利用如图2所示装置,测定高炉煤气中CO、CO2、N2和O2的百分组成.
已知:
i.CuCl的盐酸溶液能吸收CO形成Cu(CO)Cl•H2O.
ii.保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气.
①D、F洗气瓶中宜盛放的试剂分别是_____ 、_____ .
②写出保险粉和KOH的混合溶液吸收O2的离子方程式:_____ .
(1)实验室用如图1所示装置制取CuCl,反应原理为:
2Cu2++SO2+8Cl﹣+2H2O═2CuCl43﹣+SO42-+4H+
CuCl43﹣(aq)⇌CuCl(s)+3Cl﹣(aq)

①装置C的作用是
②装置B中反应结束后,取出混合物进行如图所示操作,得到CuCl晶体.
混合物
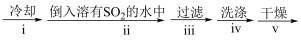 CuCl晶体
CuCl晶体操作ⅱ的主要目的是
操作ⅳ中最好选用的试剂是
③实验室保存新制CuCl晶体的方法是
④欲提纯某混有铜粉的CuCl晶体,请简述实验方案:
(2)某同学利用如图2所示装置,测定高炉煤气中CO、CO2、N2和O2的百分组成.
已知:
i.CuCl的盐酸溶液能吸收CO形成Cu(CO)Cl•H2O.
ii.保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气.
①D、F洗气瓶中宜盛放的试剂分别是
②写出保险粉和KOH的混合溶液吸收O2的离子方程式:
您最近一年使用:0次
2016-12-09更新
|
712次组卷
|
9卷引用:安徽省六安市第一中学2017届高三下学期第九次月考理综化学试题
12-13高三上·福建泉州·期中
真题
5 . 现拟用图所示装置(尾气处理部分略)来制取一氧化碳,并用以测定某铜粉样品(混有CuO粉末)中金属铜的含量

(1)制备一氧化碳的化学方程式是______ ;
(2)试验中,观察到反应管中发生的现象是______ ;尾气的主要成分是______ ;
(3)反应完成后,正确的操作顺序为______ (填字母)
a.关闭漏斗开关 b.熄灭酒精1 c.熄灭酒精灯2
(4)若试验中称取铜粉样品5.0g,充分反应后,反应管中剩余固体的质量为4.8g,则原样品中单质铜的质量分数为______ ;
(5)从浓硫酸、浓硝酸、蒸馏水、双氧水中选用合适的试剂,设计一个测定样品中金属铜质量分数的方案;
①设计方案的主要步骤是(不必描述操作过程的细节)______ ;
②写出有关反应的化学方程式______ 。

(1)制备一氧化碳的化学方程式是
(2)试验中,观察到反应管中发生的现象是
(3)反应完成后,正确的操作顺序为
a.关闭漏斗开关 b.熄灭酒精1 c.熄灭酒精灯2
(4)若试验中称取铜粉样品5.0g,充分反应后,反应管中剩余固体的质量为4.8g,则原样品中单质铜的质量分数为
(5)从浓硫酸、浓硝酸、蒸馏水、双氧水中选用合适的试剂,设计一个测定样品中金属铜质量分数的方案;
①设计方案的主要步骤是(不必描述操作过程的细节)
②写出有关反应的化学方程式
您最近一年使用:0次
11-12高一上·浙江宁波·期中
解题方法
6 . 根据下图物质之间的转化关系,回答下列问题:
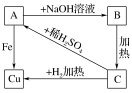
(1)写出A、B、C的化学式:
A________ 、B________ 、C________ 。
(2)写出有关的化学方程式:
A―→B__________________________ ;
A―→Cu_________________________ 。

(1)写出A、B、C的化学式:
A
(2)写出有关的化学方程式:
A―→B
A―→Cu
您最近一年使用:0次
10-11高三上·湖南长沙·阶段练习
名校
7 . 某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为沉淀可能是CuCO3;乙同学认为沉淀可能是Cu(OH)2;丙同学认为沉淀可能是CuCO3和Cu(OH)2的混合物。(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ.按照甲同学的观点,发生反应的离子反应方程式为_______________________ ;
在探究沉淀成分前,须将沉淀从溶液中分离并净化。其具体操作依次为____________________ 。
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。
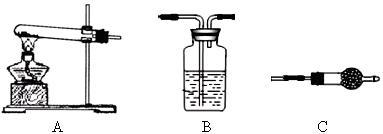
(1)各装置连接顺序为__________________________ 。
(2)能证明生成物中有CuCO3的实验现象是__________________ 。
Ⅲ.若CuCO3和Cu(OH)2两者都有,可利用下列装置通过实验测定其组成。
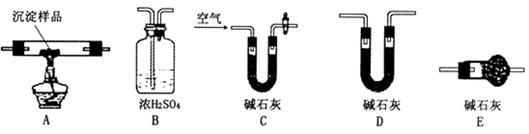

(1)装置C中碱石灰的作用是__________________ ,实验开始和结束时都要通入过量的空气,请说明结束时通入过量空气的作用是____________________________
(2)若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为___________ 。
甲同学认为沉淀可能是CuCO3;乙同学认为沉淀可能是Cu(OH)2;丙同学认为沉淀可能是CuCO3和Cu(OH)2的混合物。(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ.按照甲同学的观点,发生反应的离子反应方程式为
在探究沉淀成分前,须将沉淀从溶液中分离并净化。其具体操作依次为
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。

(1)各装置连接顺序为
(2)能证明生成物中有CuCO3的实验现象是
Ⅲ.若CuCO3和Cu(OH)2两者都有,可利用下列装置通过实验测定其组成。


(1)装置C中碱石灰的作用是
(2)若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为
您最近一年使用:0次
2016-12-09更新
|
532次组卷
|
4卷引用:2010年湖南省长沙一中高三上学期第三次月考化学试题
(已下线)2010年湖南省长沙一中高三上学期第三次月考化学试题(已下线)2011届广西河池高级中学高三第六次月考理综化学部分2020届高考化学二轮复习大题精准训练 ——定性分析探究实验题河南省商丘市第一高级中学2020届高三上学期期中考试化学试题
8 . 已知A、B、C为常见的单质,在一定条件下相互转化的关系如图:
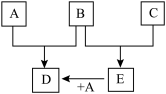
(1)若常温下,A、B均为气体,C为红色固体,E为黑色固体,则E的化学式为___________ ,写出A+E→D的化学反应方程式___________ 。
(2)若常温下B、C均为气体,A为金属单质,D为黑色晶体,则E的电子式为___________ ,写出A+E→D的化学反应方程式___________ 。
(3)若常温下B为气体,C为黑色固体,则构成金属A的原子结构示意图为___________ ,写出A+E→D的化学反应方程式___________ 。

(1)若常温下,A、B均为气体,C为红色固体,E为黑色固体,则E的化学式为
(2)若常温下B、C均为气体,A为金属单质,D为黑色晶体,则E的电子式为
(3)若常温下B为气体,C为黑色固体,则构成金属A的原子结构示意图为
您最近一年使用:0次
14-15高三上·陕西西安·阶段练习
名校
9 . 铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题。
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后溶液中大量存在的阳离子是______________ ;Y与过量浓硝酸反应后溶液中含有的盐的化学式为___________ 。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧,并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是___ 。
A.Mg2+B.Fe2+C.Al3+D.Cu2+
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下:
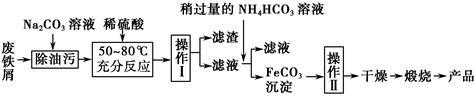
回答下列问题:
①操作Ⅰ的名称是________ ;操作Ⅱ的名称是________ ;操作Ⅱ的方法为_____________________ 。
②请写出生成FeCO3沉淀的离子方程式:____________________________ 。
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后溶液中大量存在的阳离子是
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧,并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是
A.Mg2+B.Fe2+C.Al3+D.Cu2+
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下:

回答下列问题:
①操作Ⅰ的名称是
②请写出生成FeCO3沉淀的离子方程式:
您最近一年使用:0次
2016-12-08更新
|
541次组卷
|
5卷引用:2015届陕西省西安一中高三上学期第二次模考试化学试卷
12-13高三上·江苏南京·阶段练习
10 . 氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇及稀硫酸,熔点422℃,沸点1366℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗盐水(含Ca2+、Mg2+、SO42-等杂质)、Cu、稀硫酸、SO2等为原料合成CuCl的工艺如下:
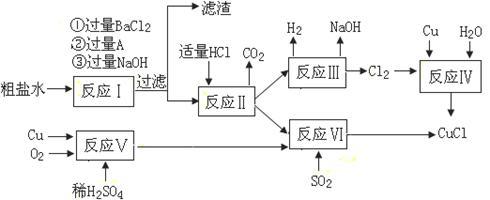
(1)A的化学式为__________________ 。
(2)写出反应V的化学方程式__________________________________________ 。
(3)写出反应VI的离子方程式为________________________________________ 。
(4)本工艺中可以循环利用的物质是(用化学式表示)______________ 。
(5)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是_______ 、____________ 。

(1)A的化学式为
(2)写出反应V的化学方程式
(3)写出反应VI的离子方程式为
(4)本工艺中可以循环利用的物质是(用化学式表示)
(5)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是
您最近一年使用:0次



