1 .  是一种常用的杀菌剂和催化剂。工业上制取
是一种常用的杀菌剂和催化剂。工业上制取 的工艺如图所示(制取
的工艺如图所示(制取 时需补加
时需补加 以保持反应在弱酸性条件下进行)。
以保持反应在弱酸性条件下进行)。

已知:溶液A的主要溶质M为酸式盐;化合物C为正盐;当溶液酸性减弱到一定程度时, 部分转化为
部分转化为 沉淀且满足
沉淀且满足 。
。
回答下列问题:
(1)M的化学式为___________ ;“真空蒸发”的原因是___________ 。
(2)溶液 发生反应的离子方程式为
发生反应的离子方程式为___________ ;若 产量不变,参与反应的化合物
产量不变,参与反应的化合物 与
与 物质的量之比减小时,需补加
物质的量之比减小时,需补加 的量
的量___________ (填“增大”、“减小”或“不变”)。
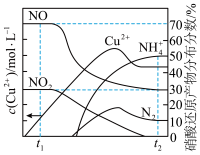
(3)为探究 的还原性,将一定量
的还原性,将一定量 与某浓度的硝酸反应,溶液的体积为
与某浓度的硝酸反应,溶液的体积为 ,溶液中
,溶液中 与硝酸还原产物的分布分数随时间的变化如图所示。则
与硝酸还原产物的分布分数随时间的变化如图所示。则 时刻,溶液中发生反应的化学方程式为
时刻,溶液中发生反应的化学方程式为___________ ; 时刻,测得溶液中
时刻,测得溶液中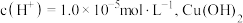 沉淀的质量为
沉淀的质量为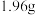 ,则此时溶液中
,则此时溶液中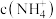 为
为___________  (忽略溶液体积变化)。
(忽略溶液体积变化)。
 是一种常用的杀菌剂和催化剂。工业上制取
是一种常用的杀菌剂和催化剂。工业上制取 的工艺如图所示(制取
的工艺如图所示(制取 时需补加
时需补加 以保持反应在弱酸性条件下进行)。
以保持反应在弱酸性条件下进行)。
已知:溶液A的主要溶质M为酸式盐;化合物C为正盐;当溶液酸性减弱到一定程度时,
 部分转化为
部分转化为 沉淀且满足
沉淀且满足 。
。回答下列问题:
(1)M的化学式为
(2)溶液
 发生反应的离子方程式为
发生反应的离子方程式为 产量不变,参与反应的化合物
产量不变,参与反应的化合物 与
与 物质的量之比减小时,需补加
物质的量之比减小时,需补加 的量
的量(3)为探究
 的还原性,将一定量
的还原性,将一定量 与某浓度的硝酸反应,溶液的体积为
与某浓度的硝酸反应,溶液的体积为 ,溶液中
,溶液中 与硝酸还原产物的分布分数随时间的变化如图所示。则
与硝酸还原产物的分布分数随时间的变化如图所示。则 时刻,溶液中发生反应的化学方程式为
时刻,溶液中发生反应的化学方程式为 时刻,测得溶液中
时刻,测得溶液中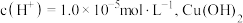 沉淀的质量为
沉淀的质量为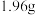 ,则此时溶液中
,则此时溶液中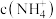 为
为 (忽略溶液体积变化)。
(忽略溶液体积变化)。
您最近一年使用:0次
名校
2 . 学习小组探究了铜的氧化过程及铜的氧化物的组成。回答下列问题:
(1)铜与浓硝酸反应的装置如图,A中反应的离子方程式为______ ,装置B的作用为______ 。
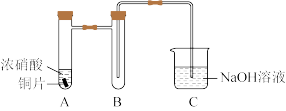
(2)铜与过量 反应的探究如下:
反应的探究如下:

实验②中Cu溶解的离子方程式为______ ;产生的气体为______ 。比较实验①和②,从氧化还原角度说明H⁺的作用是______ 。
(3)用足量NaOH处理实验②新制的溶液得到沉淀X,元素分析表明X为铜的氧化物,提纯干燥后的X在惰性氛围下加热,m g X完全分解为n g黑色氧化物Y,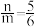 。X的化学式为
。X的化学式为______ 。
(4)取含X粗品0.0500 g(杂质不参加反应)与过量的酸性KI完全反应后,调节溶液至弱酸性。以淀粉为指示剂,用0.1000 mol⋅L
 标准溶液滴定,滴定终点时消耗
标准溶液滴定,滴定终点时消耗 标准溶液15.00 mL。(已知:
标准溶液15.00 mL。(已知: ,
, )粗品中X的百分含量
)粗品中X的百分含量______ %。
(1)铜与浓硝酸反应的装置如图,A中反应的离子方程式为

(2)铜与过量
 反应的探究如下:
反应的探究如下:
实验②中Cu溶解的离子方程式为
(3)用足量NaOH处理实验②新制的溶液得到沉淀X,元素分析表明X为铜的氧化物,提纯干燥后的X在惰性氛围下加热,m g X完全分解为n g黑色氧化物Y,
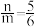 。X的化学式为
。X的化学式为(4)取含X粗品0.0500 g(杂质不参加反应)与过量的酸性KI完全反应后,调节溶液至弱酸性。以淀粉为指示剂,用0.1000 mol⋅L

 标准溶液滴定,滴定终点时消耗
标准溶液滴定,滴定终点时消耗 标准溶液15.00 mL。(已知:
标准溶液15.00 mL。(已知: ,
, )粗品中X的百分含量
)粗品中X的百分含量
您最近一年使用:0次
名校
解题方法
3 . 某绿色溶液A含有H+、Na+、Mg2+、Fe2+、Cu2+、 、Cl-、
、Cl-、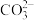 、
、 离子中的种若干种。取该溶液进行如下实验:
离子中的种若干种。取该溶液进行如下实验:
①向溶液中滴加Ba(OH)2溶液,过滤,得到不溶于酸的白色沉淀和绿色滤液B;
②取滤液B,先用硝酸酸化,再滴加AgNO3溶液,有白色沉淀生成。
已知:①CuCl2·2H2O是绿色固体,溶于水浓溶液呈绿色,稀溶液呈蓝色;
②Ag2SO4微溶于水,可溶于硝酸;
③Fe2+(aq)呈浅绿色;Fe(OH)2是白色沉淀,在空气中与氧气和水反应迅速变成灰绿色,最终变成红褐色的Fe(OH)3沉淀。
根据上述信息,回答下列问题:
(1)导致溶液A呈现绿色的原因是_______ ;
(2)通过实验①可以得出_______ 离子存在、_______ 离子不存在的结论;
(3)通过实验②可以得出的结论是_______ ;
(4)结合实验①和②和题干信息,仍不能判断A溶液中是否存在的离子是_______ ;
(5)在绿色滤液B中加入_______ 溶液,依据不同的现象,可以推断出导致溶液呈现绿色的离子的具体存在情况。写出Fe(OH)2在空气中与氧气和水反应生成红褐色的Fe(OH)3的化学方程式_______ 。
 、Cl-、
、Cl-、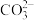 、
、 离子中的种若干种。取该溶液进行如下实验:
离子中的种若干种。取该溶液进行如下实验:①向溶液中滴加Ba(OH)2溶液,过滤,得到不溶于酸的白色沉淀和绿色滤液B;
②取滤液B,先用硝酸酸化,再滴加AgNO3溶液,有白色沉淀生成。
已知:①CuCl2·2H2O是绿色固体,溶于水浓溶液呈绿色,稀溶液呈蓝色;
②Ag2SO4微溶于水,可溶于硝酸;
③Fe2+(aq)呈浅绿色;Fe(OH)2是白色沉淀,在空气中与氧气和水反应迅速变成灰绿色,最终变成红褐色的Fe(OH)3沉淀。
根据上述信息,回答下列问题:
(1)导致溶液A呈现绿色的原因是
(2)通过实验①可以得出
(3)通过实验②可以得出的结论是
(4)结合实验①和②和题干信息,仍不能判断A溶液中是否存在的离子是
(5)在绿色滤液B中加入
您最近一年使用:0次
2022-12-07更新
|
187次组卷
|
2卷引用:山东省沂水县第一中学2022-2023学年高一上学期期末考试化学试题
解题方法
4 . 以黄铜矿(主要成分是CuFeS2,含少量SiO2)为主要原料生产铜、铁红,原料的综合利用率较高,其主要流程如图。
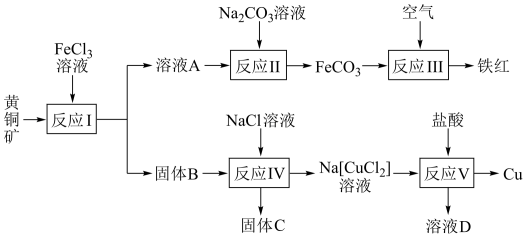
已知:①CuCl为白色晶体,难溶于水和乙醇,在空气中易被氧化;可与NaCl溶液反应,生成易溶于水的Na[CuCl2]
②Cu+酸性条件发生自身氧化还原反应生成Cu2+和Cu。
(1)固体C中含有硫单质,则反应Ⅰ的离子方程式为___________ 。从固体C中分离出硫单质的方法是溶解、过滤、蒸馏。最适宜的溶剂为___________ 。
A.水B.氢氧化钠溶液 C.CS2D.酒精
(2)从反应Ⅰ的混合液中获得固体B后,需要快速将B投入到NaCl溶液中,原因是___________ 。
(3)过滤后得到的FeCO3固体应进行洗涤,检验沉淀洗涤干净的方法是___________ 。
(4)反应Ⅲ在高温下进行,该反应的化学方程式为___________ 。

已知:①CuCl为白色晶体,难溶于水和乙醇,在空气中易被氧化;可与NaCl溶液反应,生成易溶于水的Na[CuCl2]
②Cu+酸性条件发生自身氧化还原反应生成Cu2+和Cu。
(1)固体C中含有硫单质,则反应Ⅰ的离子方程式为
A.水B.氢氧化钠溶液 C.CS2D.酒精
(2)从反应Ⅰ的混合液中获得固体B后,需要快速将B投入到NaCl溶液中,原因是
(3)过滤后得到的FeCO3固体应进行洗涤,检验沉淀洗涤干净的方法是
(4)反应Ⅲ在高温下进行,该反应的化学方程式为
您最近一年使用:0次
名校
解题方法
5 . 硫酸四氨合铜晶体([Cu(NH3)4]SO4·H2O)常用作杀虫剂,媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。常温下该物质溶于水,不溶于乙醇、乙醚,在空气中不稳定,受热时易发生分解。某化学兴趣小组以Cu粉、3mol·L-1的硫酸、浓氨水、10%NaOH溶液、95%的乙醇溶液、0.500mol·L-1稀盐酸、0.500mol·L-1的NaOH溶液来合成硫酸四氨合铜晶体并测定其纯度。
I.CuSO4溶液的制备
①称取4g铜粉,在坩埚中灼烧10分钟并不断搅拌,放置冷却。
②在蒸发皿中加入30mL 3mol·L-1的硫酸,将坩埚中固体慢慢放入其中,加热并不断搅拌。
③趁热过滤得蓝色溶液。
(1)某同学在实验中有1.5g的铜粉剩余,该同学将制得的CuSO4溶液倒入另一蒸发皿中加热浓缩至有晶膜出现,冷却析出的晶体中含有白色粉末,试解释其原因___________ 。
Ⅱ.晶体的制备
将上述制备的CuSO4溶液按如图所示进行操作:
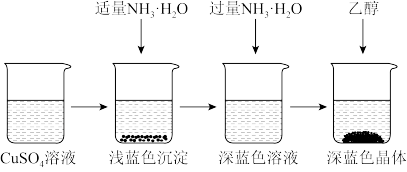
(2)已知浅蓝色沉淀的成分为Cu2(OH)2SO4,试写出生成此沉淀的离子反应方程式___________ 。
(3)析出晶体时采用加入乙醇的方法,而不是浓缩结晶的原因是___________ 。
Ⅲ.氨含量的测定
精确称取mg晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入VmL 10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用V1mL C1mol·L-1的盐酸标准溶液完全吸收。取下接收瓶,用C2mol·L-1NaOH标准溶液滴定过剩的HCl(选用甲基橙作指示剂),到终点时消耗V2mL NaOH溶液。
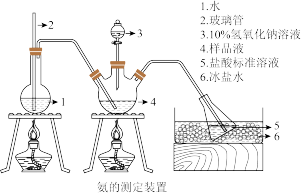
(4)玻璃管2的作用是___________ ,样品中氨的质量分数的表达式___________ 。
(5)下列实验操作可能使氨含量测定结果偏低的原因是___________ (填序号)。
A.滴定时未用NaOH标准溶液润洗滴定管
B.读数时,滴定前平视,滴定后俯视
C.滴定过程中选用酚酞作指示剂
D.取下接收瓶前,未用蒸馏水冲洗插入接收瓶中的导管外壁。
I.CuSO4溶液的制备
①称取4g铜粉,在坩埚中灼烧10分钟并不断搅拌,放置冷却。
②在蒸发皿中加入30mL 3mol·L-1的硫酸,将坩埚中固体慢慢放入其中,加热并不断搅拌。
③趁热过滤得蓝色溶液。
(1)某同学在实验中有1.5g的铜粉剩余,该同学将制得的CuSO4溶液倒入另一蒸发皿中加热浓缩至有晶膜出现,冷却析出的晶体中含有白色粉末,试解释其原因
Ⅱ.晶体的制备
将上述制备的CuSO4溶液按如图所示进行操作:

(2)已知浅蓝色沉淀的成分为Cu2(OH)2SO4,试写出生成此沉淀的离子反应方程式
(3)析出晶体时采用加入乙醇的方法,而不是浓缩结晶的原因是
Ⅲ.氨含量的测定
精确称取mg晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入VmL 10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用V1mL C1mol·L-1的盐酸标准溶液完全吸收。取下接收瓶,用C2mol·L-1NaOH标准溶液滴定过剩的HCl(选用甲基橙作指示剂),到终点时消耗V2mL NaOH溶液。

(4)玻璃管2的作用是
(5)下列实验操作可能使氨含量测定结果偏低的原因是
A.滴定时未用NaOH标准溶液润洗滴定管
B.读数时,滴定前平视,滴定后俯视
C.滴定过程中选用酚酞作指示剂
D.取下接收瓶前,未用蒸馏水冲洗插入接收瓶中的导管外壁。
您最近一年使用:0次
名校
解题方法
6 . 黄铜矿( )是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。冶炼侗的反应为
)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。冶炼侗的反应为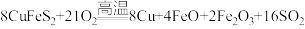 。
。
(1)若 中
中 的化合价为+2,反应中被还原的元素是
的化合价为+2,反应中被还原的元素是_______ (填元素符号)。
(2)上述冶炼过程产生大量 。下列处理方案中合理的是
。下列处理方案中合理的是_______ (填代号)
a. 高空排放 b. 用于制备硫酸
c. 用纯碱溶液吸收制 d. 用浓硫酸吸收
d. 用浓硫酸吸收
(3)实验室制备、收集干燥的 ,并探究
,并探究 与
与 溶液的反应,所需仪器如下。
溶液的反应,所需仪器如下。
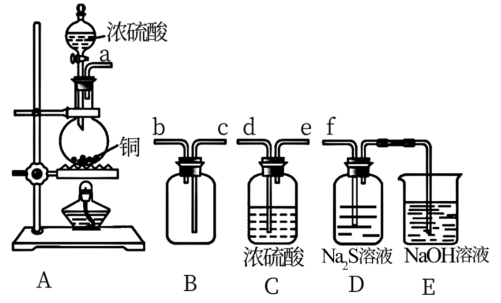
①其中装置A产生SO2,反应的化学方程式为_______ 。
②请按气流方向连接各仪器接口,顺序为a→_______ →_______ →_______ →_______ →f,装置D中观察到的现象是_______ 。装置E中发生的反应离子方程式为_______ 。
 )是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。冶炼侗的反应为
)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。冶炼侗的反应为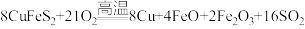 。
。(1)若
 中
中 的化合价为+2,反应中被还原的元素是
的化合价为+2,反应中被还原的元素是(2)上述冶炼过程产生大量
 。下列处理方案中合理的是
。下列处理方案中合理的是a. 高空排放 b. 用于制备硫酸
c. 用纯碱溶液吸收制
 d. 用浓硫酸吸收
d. 用浓硫酸吸收(3)实验室制备、收集干燥的
 ,并探究
,并探究 与
与 溶液的反应,所需仪器如下。
溶液的反应,所需仪器如下。
①其中装置A产生SO2,反应的化学方程式为
②请按气流方向连接各仪器接口,顺序为a→
您最近一年使用:0次
2021-01-27更新
|
224次组卷
|
3卷引用:山东省菏泽地区2020-2021学年高一上学期期末联考化学试题
解题方法
7 . 物质A~D均含同种元素,都是中学化学中常见的物质,它们之间可发生如图所示的反应(除A~D外的其他物质均已略去)。
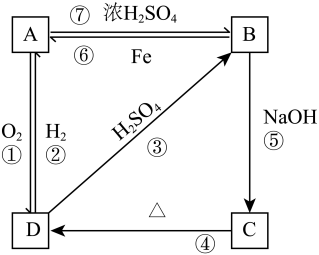
(1)写出相应物质的类别。
(2)上述反应①到⑥中,属于离子反应的有___ 个。
(3)①D→A转化的化学方程式:__ 。
②B→C转化的离子方程式:__ 。

(1)写出相应物质的类别。
| 物质 | B | C | D |
| 类别 |
(3)①D→A转化的化学方程式:
②B→C转化的离子方程式:
您最近一年使用:0次
8 . 氧化亚铜是大型水面舰艇防护涂层的重要原料.某小组通过查阅资料,进行如图研究.

I.Cu2O的制取
(1)葡萄糖还原法制Cu2O的化学方程式为____________
(2)实验室用此方法制取并获得少量Cu2O固体,需要的玻璃仪器除试管、酒精灯、烧杯外,还需要____________
Ⅱ.检验样品中是否含有CuO
方案1:将制得的Cu2O样品溶于足量稀硫酸.
(3)甲同学认为若溶液变为蓝色,则说明样品中含有CuO杂质.乙同学认为此推论不合理,用化学用语解释原因_____________
(4)甲同学通过反思,认为将定性检验改为定量测定便能确定样品中是否含有CuO杂质,应测量的数据是________________
方案2:丙同学认为采用如下装置(所加药品均足量)进行实验,通过测定c装置反应后固体的质量以及d装置反应前后增重的质量,可计算,从而确定样品中是否含有氧化铜.
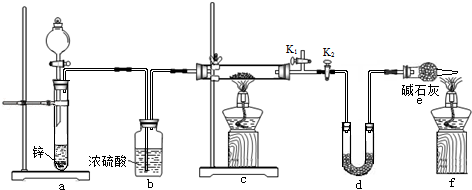
(5)装置a中所加的酸是__________
(填化学式),装置e中碱石灰的作用是_______________
(6)点燃装置c中酒精灯之前需进行的操作是_________________
(7)熄灭酒精灯之后,仍需通一段时间H2至试管冷却,原因是_______________ .

I.Cu2O的制取
(1)葡萄糖还原法制Cu2O的化学方程式为
(2)实验室用此方法制取并获得少量Cu2O固体,需要的玻璃仪器除试管、酒精灯、烧杯外,还需要
Ⅱ.检验样品中是否含有CuO
方案1:将制得的Cu2O样品溶于足量稀硫酸.
(3)甲同学认为若溶液变为蓝色,则说明样品中含有CuO杂质.乙同学认为此推论不合理,用化学用语解释原因
(4)甲同学通过反思,认为将定性检验改为定量测定便能确定样品中是否含有CuO杂质,应测量的数据是
方案2:丙同学认为采用如下装置(所加药品均足量)进行实验,通过测定c装置反应后固体的质量以及d装置反应前后增重的质量,可计算,从而确定样品中是否含有氧化铜.

(5)装置a中所加的酸是
(填化学式),装置e中碱石灰的作用是
(6)点燃装置c中酒精灯之前需进行的操作是
(7)熄灭酒精灯之后,仍需通一段时间H2至试管冷却,原因是
您最近一年使用:0次
2016-12-09更新
|
382次组卷
|
2卷引用:2016届山东省枣庄市滕州五中高三上学期期末化学试卷



