名校
1 . 铜及其化合物在生产、生活中有广泛的应用。某研究性学习小组的同学对铜常见化合物的性质和制备进行实验探究,研究的问题和过程如下:
I.探究不同价态铜的稳定性
进行如下实验:
(1)向 中加适量稀硫酸,得到蓝色溶液和一种红色固体,该反应的离子化学方程式为:
中加适量稀硫酸,得到蓝色溶液和一种红色固体,该反应的离子化学方程式为:__________ 。由此可知,在酸性溶液中,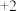 价Cu比+1价Cu更
价Cu比+1价Cu更_______ (填“稳定”或“不稳定”)。
(2)将 粉末加热至
粉末加热至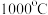 以上完全分解成红色的
以上完全分解成红色的 粉末,该反应说明:在高温条件下,+1价的Cu比+2价Cu更
粉末,该反应说明:在高温条件下,+1价的Cu比+2价Cu更_______ (填“稳定”或“不稳定”)。
II.探究通过不同途径制取硫酸铜
(1)途径A:如下图
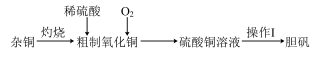
①杂铜(含少量有机物)灼烧后的产物除氧化铜还含少量铜,原因可能是___________ (填字母代号)
a.该条件下铜无法被氧气氧化 b.灼烧不充分,铜未被完全氧化
c.氧化铜在加热过程中分解生成铜 d.灼烧过程中部分氧化铜被还原
②测定硫酸铜晶体的纯度:
某小组同学准确称取4.0g样品溶于水配成100mL溶液,取10mL溶液于锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用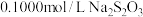 标准溶液滴定至终点,共消耗
标准溶液滴定至终点,共消耗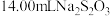 标准溶液。上述过程中反应的离子方程式如下:
标准溶液。上述过程中反应的离子方程式如下: 。则样品中硫酸铜晶体的质量分数为
。则样品中硫酸铜晶体的质量分数为_________________
(2)途径B:如下图
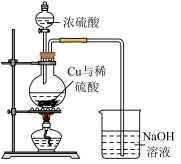
①烧瓶内可能发生反应的化学方程式为_______________ (已知烧杯中反应: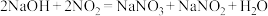 )
)
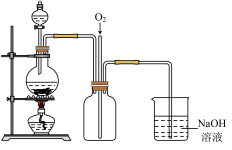
②下图是上图的改进装置,其中直玻璃管通入氧气的作用是_____________________ 。
Ⅲ.探究用粗铜(含杂质Fe)按下述流程制备氯化铜晶体 。
。
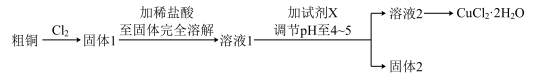
(1)实验室采用如下图所示的装置,可将粗铜与 反应转化为固体l(部分仪器和夹持装置已略去),
反应转化为固体l(部分仪器和夹持装置已略去),
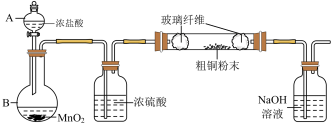
有同学认为应在浓硫酸洗气瓶前增加吸收 的装置,你认为是否必要
的装置,你认为是否必要________ (填“是”或“否”)
(2)将溶液2转化为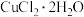 的操作过程中,发现溶液颜色由蓝色变为绿色。
的操作过程中,发现溶液颜色由蓝色变为绿色。
已知:在氯化铜溶液中有如下转化关系:[Cu(H2O)4]2+(aq,蓝色)+4Cl-(aq) CuCl42-(aq,黄色)+4H2O(l),该小组同学取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明
CuCl42-(aq,黄色)+4H2O(l),该小组同学取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明 溶液中有上述转化关系的是
溶液中有上述转化关系的是_____________ (填序号)(已知:较高浓度的 溶液呈绿色)。
溶液呈绿色)。
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入 晶体,溶液变为绿色
晶体,溶液变为绿色
c.在Y中加入 固体,溶液变为绿色
固体,溶液变为绿色
d.取Y进行电解,溶液颜色最终消失
Ⅳ.探究测定铜与浓硫酸反应
取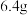 铜片和12mL18mol/L浓硫酸放在圆底烧瓶中共热,一段时间后停止反应,为定量测定余酸的物质的量浓度,某同学设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL至锥形瓶中,滴入2~3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),通过测出消耗氢氧化钠溶液的体积来求余酸的物质的量浓度。假定反应前后烧瓶中溶液的体积不变,你认为该学生设计的实验方案能否求得余酸的物质的量浓度
铜片和12mL18mol/L浓硫酸放在圆底烧瓶中共热,一段时间后停止反应,为定量测定余酸的物质的量浓度,某同学设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL至锥形瓶中,滴入2~3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),通过测出消耗氢氧化钠溶液的体积来求余酸的物质的量浓度。假定反应前后烧瓶中溶液的体积不变,你认为该学生设计的实验方案能否求得余酸的物质的量浓度____________ (填“能”或“不能”),其理由是_____________ 。
I.探究不同价态铜的稳定性
进行如下实验:
(1)向
 中加适量稀硫酸,得到蓝色溶液和一种红色固体,该反应的离子化学方程式为:
中加适量稀硫酸,得到蓝色溶液和一种红色固体,该反应的离子化学方程式为: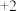 价Cu比+1价Cu更
价Cu比+1价Cu更(2)将
 粉末加热至
粉末加热至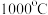 以上完全分解成红色的
以上完全分解成红色的 粉末,该反应说明:在高温条件下,+1价的Cu比+2价Cu更
粉末,该反应说明:在高温条件下,+1价的Cu比+2价Cu更II.探究通过不同途径制取硫酸铜
(1)途径A:如下图

①杂铜(含少量有机物)灼烧后的产物除氧化铜还含少量铜,原因可能是
a.该条件下铜无法被氧气氧化 b.灼烧不充分,铜未被完全氧化
c.氧化铜在加热过程中分解生成铜 d.灼烧过程中部分氧化铜被还原
②测定硫酸铜晶体的纯度:
某小组同学准确称取4.0g样品溶于水配成100mL溶液,取10mL溶液于锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用
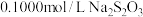 标准溶液滴定至终点,共消耗
标准溶液滴定至终点,共消耗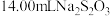 标准溶液。上述过程中反应的离子方程式如下:
标准溶液。上述过程中反应的离子方程式如下: 。则样品中硫酸铜晶体的质量分数为
。则样品中硫酸铜晶体的质量分数为(2)途径B:如下图

①烧瓶内可能发生反应的化学方程式为
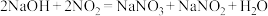 )
)②下图是上图的改进装置,其中直玻璃管通入氧气的作用是

Ⅲ.探究用粗铜(含杂质Fe)按下述流程制备氯化铜晶体
 。
。
(1)实验室采用如下图所示的装置,可将粗铜与
 反应转化为固体l(部分仪器和夹持装置已略去),
反应转化为固体l(部分仪器和夹持装置已略去),
有同学认为应在浓硫酸洗气瓶前增加吸收
 的装置,你认为是否必要
的装置,你认为是否必要(2)将溶液2转化为
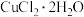 的操作过程中,发现溶液颜色由蓝色变为绿色。
的操作过程中,发现溶液颜色由蓝色变为绿色。已知:在氯化铜溶液中有如下转化关系:[Cu(H2O)4]2+(aq,蓝色)+4Cl-(aq)
 CuCl42-(aq,黄色)+4H2O(l),该小组同学取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明
CuCl42-(aq,黄色)+4H2O(l),该小组同学取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明 溶液中有上述转化关系的是
溶液中有上述转化关系的是 溶液呈绿色)。
溶液呈绿色)。a.将Y稀释,发现溶液呈蓝色
b.在Y中加入
 晶体,溶液变为绿色
晶体,溶液变为绿色c.在Y中加入
 固体,溶液变为绿色
固体,溶液变为绿色d.取Y进行电解,溶液颜色最终消失
Ⅳ.探究测定铜与浓硫酸反应
取
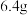 铜片和12mL18mol/L浓硫酸放在圆底烧瓶中共热,一段时间后停止反应,为定量测定余酸的物质的量浓度,某同学设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL至锥形瓶中,滴入2~3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),通过测出消耗氢氧化钠溶液的体积来求余酸的物质的量浓度。假定反应前后烧瓶中溶液的体积不变,你认为该学生设计的实验方案能否求得余酸的物质的量浓度
铜片和12mL18mol/L浓硫酸放在圆底烧瓶中共热,一段时间后停止反应,为定量测定余酸的物质的量浓度,某同学设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL至锥形瓶中,滴入2~3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),通过测出消耗氢氧化钠溶液的体积来求余酸的物质的量浓度。假定反应前后烧瓶中溶液的体积不变,你认为该学生设计的实验方案能否求得余酸的物质的量浓度
您最近一年使用:0次
名校
解题方法
2 . 已知下述三个实验均能发生化学反应
①将铁钉放入硫酸铜溶液中 ②向硫酸亚铁溶液中滴入几滴双氧水
③将铜丝放入氯化铁溶液中
下列判断正确的是( )
①将铁钉放入硫酸铜溶液中 ②向硫酸亚铁溶液中滴入几滴双氧水
③将铜丝放入氯化铁溶液中
下列判断正确的是( )
| A.实验①中铁钉做氧化剂 |
| B.实验②中Fe2+具有还原性 |
| C.实验③中发生的是置换反应 |
| D.上述实验证明氧化性Fe3+>Fe2+>Cu2+ |
您最近一年使用:0次
2016-10-21更新
|
327次组卷
|
10卷引用:2017届天津市静海一中高三上学期9月调研化学试卷
2017届天津市静海一中高三上学期9月调研化学试卷(已下线)2011-2012学年广东省实验中学高一上学期期末考试化学试卷2014-2015辽宁省大连市第二十高中高一上学期期末化学试卷2014-2015吉林省松原市扶余县一中高一上学期期末化学试卷山东省寿光现代中学2016-2017学年高一下学期第三学段质量监测(期中)化学试题湖南省郴州市2017-2018学年高一上学期期末考试化学试题湖南省长沙市雨花区2018-2019学年高一上学期期末考试化学试题河北省元氏县第四中学2020-2021学年高一10月月考化学试题云南省玉溪第三中学2021-2022学年高一上学期期末考试化学试题云南省开远市第一中学校2023-2024学年高一上学期期中考试化学试题
名校
解题方法
3 . 周杰伦在歌曲《青花瓷》中唱到“帘外芭蕉惹骤雨,门环惹铜绿”,其中的“铜绿”即是铜锈,它的化学成分是Cu2(OH)2CO3(碱式碳酸铜)。铜在潮湿的空气中生锈的化学反应为:2Cu+O2+CO2+H2O=Cu2(OH)2CO3。下列有关该反应的说法正确的是( )
| A.该反应不是氧化还原反应 |
| B.该反应中氧元素和碳元素化合价发生变化,所以是氧化还原反应 |
| C.该反应中铜得电子,O2失电子,所以是氧化还原反应 |
| D.该反应是氧化还原反应,变价的只有两种元素 |
您最近一年使用:0次
2020-11-10更新
|
1946次组卷
|
37卷引用:天津市四合庄中学2019-2020学年高一上学期第一次月考化学试题
天津市四合庄中学2019-2020学年高一上学期第一次月考化学试题(已下线)2012-2013学年山西省忻州一中高一上学期期末联考化学试卷(A)(已下线)2014-2015河北保定某重点中学同步作业(必修1苏教版)2.1氧化还原反应2015-2016学年广西柳州铁路第一中学高一上段考化学试卷湖北省华中师范大学第一附属中学2016-2017学年高一下学期期中考试(文)化学试题黑龙江省伊春市第二中学2017-2018学年高二下学期期末考试化学试题【全国百强校】内蒙古自治区集宁一中2018-2019学年高一上学期12月月考化学试题山东省莒县第一中学2018-2019学年高一上学期12月月考化学试题步步为赢 高二化学暑假作业:作业三 氧化还原反应黑龙江省伊春市第二中学2018届高三上学期期中考试化学试题山东省淄博市淄川区般阳中学2019-2020学年高一10月月考化学试题吉林省延边朝鲜族自治州汪清县第四中学2019-2020学年高一上学期第二次阶段考试化学试题内蒙古集宁一中(西校区)2019-2020学年高一上学期期末考试化学试题人教版(2019)高一必修第一册第一章 物质及其变化 素养拓展区广东东莞松山湖学校2019-2020学年度高一上学期期中考试化学试题陕西省西安市高陵区第一中学、田家炳中学2020-2021学年高一上学期第一次月考化学试题吉林省梅河口市朝鲜族中学2019-2020学年高一上学期期末考试化学试题吉林省梅河口市三校2019-2020学年高一上学期期末联考化学试题黑龙江省哈尔滨市第六中学2020-2021学年高一上学期期中考试化学试题吉林省汪清县第六中学2021届高三第三次月考模拟化学试题吉林省大安市第六中学2020-2021学年高一上学期第一次月考化学试题吉林省通化市职教中心高中部2020-2021学年高一12月月考化学试题辽宁省盘锦市第二高级中学2020-2021学年高一上学期第二次阶段考试化学试题黑龙江省哈尔滨市呼兰区第一中学校等三校2020-2021学年高一上学期期末联考化学试题甘肃省张掖市2020-2021学年高一上学期期末学业水平质量检测化学试题湖南省长沙市周南中学2020-2021学年高一下学期开学考化学试题甘肃省天水市田家炳中学2021-2022学年高一上学期第一阶段考试化学试卷河南省温县第一高级中学2021-2022学年高一上学期9月月考化学试题云南省开远市第一中学校2021-2022学年高一下学期开学考试化学试题新疆喀什第二中学2021-2022学年高一下学期开学考试化学试题广东省惠州市第一中学2022-2023学年高一上学期第一次阶段考试化学试题广东省化州市第一中学2020-2021学年高一上学期10月月考化学试题吉林省乾安县第七中学2021-2022学年高一上学期第一次质量检测化学试题宁夏银川市第三十一中学2021-2022学年高一上学期期末学业检测化学试题湖北省武汉中学2021-2022高一上学期10月月考化学试题上海市格致中学2022-2023学年高一下学期第一次测试化学试题湖南省株洲市第二中学2021-2022学年高一上学期期中化学试题
名校
解题方法
4 . 向CuSO4溶液中加入H2O2溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊(Cu2O),继续加入H2O2溶液,红色浑浊又变为蓝色溶液,这个反应可以反复多次。下列关于上述过程的说法不正确的是
| A.Cu2+是H2O2分解反应的催化剂 |
| B.Cu2+将H2O2还原为O2 |
| C.H2O2既表现氧化性又表现还原性 |
| D.发生了反应:Cu2O+H2O2+4H+=2Cu2++3H2O |
您最近一年使用:0次
2021-06-23更新
|
3172次组卷
|
39卷引用:【区级联考】天津市河东区2019届高三高考一模考试化学试题
【区级联考】天津市河东区2019届高三高考一模考试化学试题天津市静海区第一中学2020-2021学年高一12月考化学试题北京市西城区2018届高三4月一模理综化学试题黑龙江省哈尔滨师范大学附属中学2019届高三上学期第一次月考化学试题福建省尤溪县第一中学2019届高三第一学期第一次月考化学试题河南省洛阳市第一高级中学2019-2020学年高一9月月考化学试题河北省辛集中学2020届高三9月月考化学试题(已下线)【新东方】2020-18安徽省淮南市寿县一中2020 届高三素质测试化学试题湖南省长沙市雅礼中学2020届高三上学期第2次月考化学试题(已下线)第三节 氧化还原反应(二)-2020-2021学年高一化学必修第一册课时同步练(新人教)湖南省常德市第二中学2021届高三上学期开学考试化学试题(已下线)第1章 章末检测-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)北京市北京师范大学附属中学2020—2021学年高一上学期期中考试化学试题江西省上饶市万年中学2020-2021学年高一上学期期中考试化学试题河北省保定市定州市第二中学2020-2021学年高一上学期11月月考化学试题天津市第四十七中学2021-2022学年高一上学期第二次月考化学试题天津市北辰区四十七中学2022-2023高一上学期期末考试化学试题天津市滨海新区塘沽第一中学2022届高三毕业班第三次月考化学试题 上海市普陀区2021届高三二模化学试题河北省石家庄二中2020-2021学年高一第二学期6月月考化学试题(已下线)专题1.3.1 氧化还原反应(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)(已下线)考点16 铜及其金属材料-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点16 铜及其金属材料-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题卷二 氧化还原反应(A卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)甘肃省天水市第一中学2021-2022高三上学期第三次考试化学试题江西省高安中学2021-2022学年高一上学期期中考试化学试题北京师范大学附属中学2021-2022学年高一上学期期中考试化学试题河南省名校联盟2021-2022学年高三上学期第三次诊断考试化学试题(已下线)一轮巩固卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(上海卷)吉林省吉林市第一中学2021-2022学年高二下学期(平行班)期中考试化学试题(已下线)微专题15 铜及其化合物的性质、制备与实验探究-备战2023年高考化学一轮复习考点微专题陕西省西安高新第一中学2022-2023学年高一上学期期中考试化学试题山东省菏泽第一中学2022-2023学年高一上学期期末考试化学试题(已下线)题型49 臭氧和过氧化氢 环境保护(已下线)【2023】【高一下】【其他】【杭二中-期中复习卷】【高中化学】【邵威宏收集】安徽省安庆市第一中学2023-2024学年高一上学期第一次阶段测化学试题四川省眉山市彭山区第一中学2023-2024学年高一上学期10月月考化学试题北京市第三十五中学2021-2022学年高一上学期期中考试化学试题
真题
名校
5 . 向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
| A.Cu与Cu2O的物质的量之比为2∶1 | B.硝酸的物质的量浓度为2.6mol/L |
| C.产生的NO在标准状况下的体积为4.48L | D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol |
您最近一年使用:0次
2019-01-30更新
|
2778次组卷
|
33卷引用:天津市静海区第一中学2020届高三3月统练化学试题
天津市静海区第一中学2020届高三3月统练化学试题2012年普通高等学校招生全国统一考试理综化学部分(四川卷)(已下线)2013届江西省赣州市十一县(市)高三上学期期中联考化学试卷(已下线)2013届江西省赣州市十一县(市)高三上学期期中联考化学试卷2015-2016学年吉林省吉林一中高一下期末化学试卷安徽省肥东县高级中学2019届高三上学期12月调研化学试题江西省上饶市横峰中学2018-2019学年高一下学期开学考试化学试题(已下线)2019年7月22日《每日一题》 2020届一轮复习 利用得失电子守恒巧解氧化还原反应计算题湖南省衡阳县第四中学2020届高三366班(实验班)8月月考化学试题宁夏青铜峡市高级中学2020届高三上学期第一次月考化学试题黑龙江省宾县一中2020届高三上学期第一次月考化学试题山西大学附中2020届高三上学期第二次模块诊断化学试题甘肃省兰州市第一中学2020届高三9月月考化学试题2020届高三化学总复习考点强化练习:物质及其变化2020届高三化学无机化学二轮专题复习——铜及其化合物专练【精编精炼】江西省景德镇一中2019-2020学年高一上学期期末考试(2班)化学试题(已下线)上海市奉贤区2014届高三1月调研(期末)测试化学试题(已下线)上海市奉贤区2013年高考二模化学试题(已下线)【南昌新东方】2018-2019 莲塘一中 高三9月 013云南省昆明市寻甸县民族中学2019-2020学年高一下学期第一次月考化学试题江苏省南通市白蒲高级中学2019-2020学年高一下学期期末复习化学试题(已下线)第09讲 氧化还原反应的计算及方程式的配平(精练)——2021年高考化学一轮复习讲练测第29届(2015年)全国高中化学奥林匹克竞赛山东省预赛试题四川省遂宁市射洪中学2020—2021学年高一下学期期中考试化学试题湖南省邵阳邵东市第一中学2022届高三上学期第二次月考化学试题河北深州市长江中学2021-2022学年高二上学期10月月考化学(文)试题云南省宁蒗县第一中学2021-2022学年高三下学期3月考试化学试题河南省洛阳市六校联考2022-2023学年高三上学期月考化学试题湖南省邵阳市第二中学2022-2023学年高一下学期期末考试化学试题湖南省益阳市南县第一中学2023-2024学年高三上学期8月月考化学试题上海市复兴高级中学2022-2023学年高二上学期期中考试化学(等级考)试题福建省福清第一中学2023-2024学年高三上学期10月月考化学试题江苏省无锡市江阴市两校联考2023-2024学年高一下学期3月月考化学试题
6 . 向CuSO4溶液中加入H2O2溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊(Cu2O),继续加入H2O2溶液,红色浑浊又变为蓝色溶液,这个反应可以反复多次。下列关于上述过程的说法不正确 的是
| A.Cu2+是H2O2分解反应的催化剂 | B.H2O2只表现了氧化性 |
C.H2O2的电子式为: 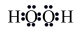 | D.发生了反应Cu2O + H2O2+4H+=2Cu2++3H2O |
您最近一年使用:0次
2018-05-04更新
|
1537次组卷
|
13卷引用:天津市武清区杨村第三中学2019届高三上学期第一次月考化学试题
天津市武清区杨村第三中学2019届高三上学期第一次月考化学试题【全国百强校】四川省成都市第七中学2018届高三下学期三诊模拟考试理综化学试题(已下线)2018年高考题及模拟题汇编 专题04 氧化还原反应(已下线)学科网2019年高考化学一轮复习讲练测 2.3 氧化还原反应的基本概念 测河北省隆化县存瑞中学2019届高三上学期期中考试化学试题安徽省蚌埠市第一中学2019届高三上学期期中考试化学试题福建省漳州市华安一中、龙海二中2020届高三上学期第一次联考化学试题河南省郑州市第一中学2020届高三12月联考化学试题广东省东莞高级中学2019-2020学年高一下学期期中教学质量检测化学试题福建省福州市福清西山学校高中部2020届高三上学期期中考试化学试题河南省濮阳市南乐县第一高级中学2022-2023学年高三上学期7月月考化学试题第四章 非金属及其化合物 热点强化7 臭氧和过氧化氢(已下线)第4讲 浓硫酸 不同价态含硫物质的转化
7 . 盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。现就硫酸、硝酸与金属铜反应的情况,回答下列问题:
(1)工业上制备硫酸铜是利用废铜屑经灼烧后,在加热情况下跟稀硫酸反应,有关的化学方程式是: 。
不采用铜跟浓硫酸反应来制取硫酸铜的原因:
从环境角度来讲: 。
从原料角度来讲: 。
(2)在一定体积的10 mol·L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9 mol。则浓硫酸的实际体积 (填“大于”、“等于”或“小于”)180 mL。
(3)若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为 。
(4)碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是
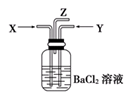
A.洗气瓶中产生的沉淀是碳酸钡
B.从Z导管出来的气体中无二氧化碳
C.洗气瓶中产生的沉淀是亚硫酸钡
D.在Z导管口有红棕色气体出现
(5)为了测定某铜银合金的成分,将30.0 g 合金溶于80 mL13.5 mol·L-1的浓HNO3中,待合金完全溶解后,收集到气体6.72 L (标准状况),并测得溶液中c(H+)=1mol·L-1。假设反应后溶液的体积仍为80 mL,试计算:
①被还原的HNO3的物质的量是____________;(只写结果)
②合金中铜的质量分数为____________。(写出计算过程)
(1)工业上制备硫酸铜是利用废铜屑经灼烧后,在加热情况下跟稀硫酸反应,有关的化学方程式是: 。
不采用铜跟浓硫酸反应来制取硫酸铜的原因:
从环境角度来讲: 。
从原料角度来讲: 。
(2)在一定体积的10 mol·L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9 mol。则浓硫酸的实际体积 (填“大于”、“等于”或“小于”)180 mL。
(3)若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为 。
(4)碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是

A.洗气瓶中产生的沉淀是碳酸钡
B.从Z导管出来的气体中无二氧化碳
C.洗气瓶中产生的沉淀是亚硫酸钡
D.在Z导管口有红棕色气体出现
(5)为了测定某铜银合金的成分,将30.0 g 合金溶于80 mL13.5 mol·L-1的浓HNO3中,待合金完全溶解后,收集到气体6.72 L (标准状况),并测得溶液中c(H+)=1mol·L-1。假设反应后溶液的体积仍为80 mL,试计算:
①被还原的HNO3的物质的量是____________;(只写结果)
②合金中铜的质量分数为____________。(写出计算过程)
您最近一年使用:0次
8 . 下列关于物质应用的说法正确的是
| A.铜盐可作净水剂 |
| B.氧化铁可作颜料 |
| C.过氧化钠用来制取金属钠 |
| D.铝制餐具可用来蒸煮咸的食物 |
您最近一年使用:0次



