1 . 下列实验方案设计不能达到实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 检验FeCl2溶液中的FeCl2是否被氧化 | 向该溶液中滴加硫氰化钾溶液 |
| B | 比较Cl与S非金属性强弱 | 比较HCl与H2SO4酸性强弱 |
| C | 除去Cu粉中混有的CuO | 向混合物中滴加适量稀硫酸 |
| D | 证明CH2=CHCHO中含有醛基 | 向新制银氨溶液中滴少量丙烯醛并用水浴加热 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
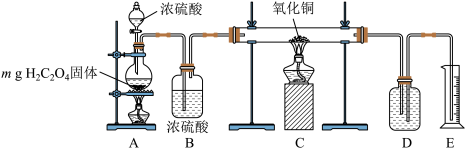
2 . 实验室用下图所示装置制备CO并用其还原CuO。制备CO的原理为H2C2O4 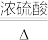 CO2↑+CO↑十H2O;CO还原CuO的反应机理为CO+ 2CuO
CO2↑+CO↑十H2O;CO还原CuO的反应机理为CO+ 2CuO  Cu2O+ CO2,CO +Cu2O
Cu2O+ CO2,CO +Cu2O  2Cu+CO2。下列说法正确的是
2Cu+CO2。下列说法正确的是
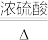 CO2↑+CO↑十H2O;CO还原CuO的反应机理为CO+ 2CuO
CO2↑+CO↑十H2O;CO还原CuO的反应机理为CO+ 2CuO  Cu2O+ CO2,CO +Cu2O
Cu2O+ CO2,CO +Cu2O  2Cu+CO2。下列说法正确的是
2Cu+CO2。下列说法正确的是
| A.装置C中黑色固体变为红色,证明氧化铜已经全部被还原为铜 |
| B.若装置A中固体完全反应,装置D中盛装浓NaOH溶液,根据装置E中溶液的体积可以计算CO在还原实验中的利用率 |
| C.取反应后的装置C中的固体于试管中,加入硝酸,可检验CuO是否被还原完全 |
| D.根据上述反应原理,推测CaC2O4经长时间加强热,产物为CaCO3、CO2、CO |
您最近一年使用:0次
3 . Ⅰ.绿色粉末状固体化合物X由三种元素组成,取50.4gX,用蒸馏水完全溶解得绿色溶液A,将溶液A分成A1和A2两等份,完成如下实验:
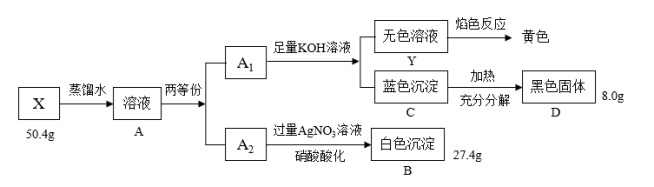
请回答
(1)X的化学式是____ 。
(2)沉淀C分解生成固体D的过程若温度过高可能得到砖红色固体,请写出由D固体生成砖红色固体的化学方程式:____ 。
(3)蓝色沉淀中加入足量浓NaOH会生成一种绛蓝色溶液,原因是生成了一种和X类似的物质,请写出该反应的离子方程式____ 。
Ⅱ.为检验三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O的热分解产物,按如图所示装置进行实验:

请回答
(1)该套实验装置的明显缺陷是____ 。
(2)实验过程中观察到B中白色无水硫酸铜变成蓝色,C、F中澄清石灰水变浑浊,E中____ (填实验现象),则可证明三草酸合铁酸钾热分解的气体产物是H2O、CO、CO2。
(3)样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验FeO存在的方法是:____ 。

请回答
(1)X的化学式是
(2)沉淀C分解生成固体D的过程若温度过高可能得到砖红色固体,请写出由D固体生成砖红色固体的化学方程式:
(3)蓝色沉淀中加入足量浓NaOH会生成一种绛蓝色溶液,原因是生成了一种和X类似的物质,请写出该反应的离子方程式
Ⅱ.为检验三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O的热分解产物,按如图所示装置进行实验:

请回答
(1)该套实验装置的明显缺陷是
(2)实验过程中观察到B中白色无水硫酸铜变成蓝色,C、F中澄清石灰水变浑浊,E中
(3)样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验FeO存在的方法是:
您最近一年使用:0次
2020-11-30更新
|
329次组卷
|
2卷引用:浙江省十校联盟2021届高三10月联考化学试题
19-20高三·浙江·阶段练习
4 . I.无机矿物盐X含五种元素,某学习小组进行了如下实验:
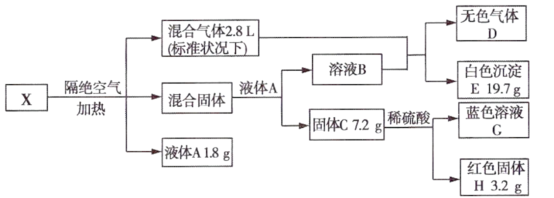
已知:混合固体由两种物质组成,物质的量之比为2:1,总质量为22.5g;通入混合气体后溶液B中溶质恰好反应完全,白色沉淀E可溶于稀盐酸;无色气体D为单一气体,可使带火星木条复燃;固体C为砖红色。
请回答:.
(1)X中5种元素是____________ (用元素符号表示)。
(2)无机矿物盐X的化学式为____________ 。
(3)固体C与稀硫酸反应的离子方程式为____________ 。
II.某学习小组在研究CH4还原Fe2O3的实验中,发现生成的黑色粉末能被磁铁吸引。查阅资料得知:在温度不同、受热不均匀时会生成具有磁性的Fe3O4。为进一步探究黑色粉末的组成,他们进行了如下实验。
(1)往黑色粉末中滴加盐酸,观察到有气泡产生,则黑色粉末中一定有____________ 。
(2)用以下装置可以说明产物中有Fe3O4存在,检查装置的气密性。往装置中添加相应的药品,接下来的一步操作为____________ 。

(3)为进一步证明黑色粉末中是否含有Fe3O4,某同学设计的实验方案为:取少量黑色粉末于试管中,加足量盐酸,充分振荡使黑色粉末完全溶解,滴入KSCN溶液,观察现象。请分析此方案是否可行,并解释原因____________ 。

已知:混合固体由两种物质组成,物质的量之比为2:1,总质量为22.5g;通入混合气体后溶液B中溶质恰好反应完全,白色沉淀E可溶于稀盐酸;无色气体D为单一气体,可使带火星木条复燃;固体C为砖红色。
请回答:.
(1)X中5种元素是
(2)无机矿物盐X的化学式为
(3)固体C与稀硫酸反应的离子方程式为
II.某学习小组在研究CH4还原Fe2O3的实验中,发现生成的黑色粉末能被磁铁吸引。查阅资料得知:在温度不同、受热不均匀时会生成具有磁性的Fe3O4。为进一步探究黑色粉末的组成,他们进行了如下实验。
(1)往黑色粉末中滴加盐酸,观察到有气泡产生,则黑色粉末中一定有
(2)用以下装置可以说明产物中有Fe3O4存在,检查装置的气密性。往装置中添加相应的药品,接下来的一步操作为

(3)为进一步证明黑色粉末中是否含有Fe3O4,某同学设计的实验方案为:取少量黑色粉末于试管中,加足量盐酸,充分振荡使黑色粉末完全溶解,滴入KSCN溶液,观察现象。请分析此方案是否可行,并解释原因
您最近一年使用:0次
名校
解题方法
5 . 某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为沉淀可能是CuCO3;乙同学认为沉淀可能是Cu(OH)2;
丙同学认为沉淀可能是CuCO3和Cu(OH)2的混合物。[查阅资料知:CuCO3和Cu(OH)2均不带结晶水,受热均易分解,各生成对应的两种氧化物]
Ⅰ.(1)乙同学的观点,你认为其原理是(用离子方程式表示):_______ 。
(2)在探究沉淀成分前,须将沉淀从溶液中过滤、洗涤、低温干燥,检验沉淀是否洗涤干净的方法是________________ 。
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。
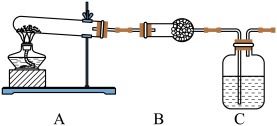
(3)B装置中试剂的化学式是_____ ,C装置中试剂的名称是______ 。
(4)能证明乙同学观点正确的预期实验现象是___________ 。
Ⅲ.若丙同学的观点正确,可利用下列装置通过实验测定其组成。
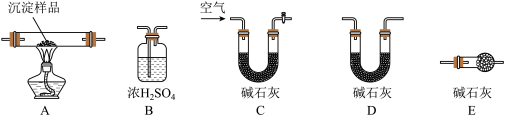
(5)实验装置的连接顺序为___________ 。
(6)装置C中碱石灰的作用是_______ ,实验开始和结束时都要通过量的空气,请说明结束时通入过量空气的作用是_________________ 。
(7)若沉淀样品的质量为m g,装置B质量增加了n g,则沉淀中CuCO3的质量分数为____ 。
甲同学认为沉淀可能是CuCO3;乙同学认为沉淀可能是Cu(OH)2;
丙同学认为沉淀可能是CuCO3和Cu(OH)2的混合物。[查阅资料知:CuCO3和Cu(OH)2均不带结晶水,受热均易分解,各生成对应的两种氧化物]
Ⅰ.(1)乙同学的观点,你认为其原理是(用离子方程式表示):
(2)在探究沉淀成分前,须将沉淀从溶液中过滤、洗涤、低温干燥,检验沉淀是否洗涤干净的方法是
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。

(3)B装置中试剂的化学式是
(4)能证明乙同学观点正确的预期实验现象是
Ⅲ.若丙同学的观点正确,可利用下列装置通过实验测定其组成。

(5)实验装置的连接顺序为
(6)装置C中碱石灰的作用是
(7)若沉淀样品的质量为m g,装置B质量增加了n g,则沉淀中CuCO3的质量分数为
您最近一年使用:0次
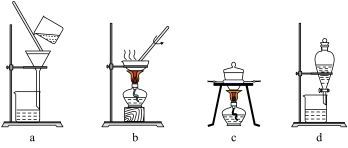
6 . 某矿样中含有大量的CuS及少量其他不含铜不溶于酸的杂质。实验室中以该矿样为原料制备CuCl2·2H2O晶体,流程如下:
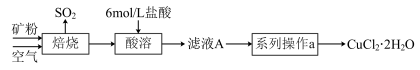
(1)①若在实验室中完成系列操作a。则下列实验操作中,不需要的是____________ (填字母)。
②CuCl2溶液中存在平衡:Cu(H2O)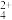 (蓝色)+4Cl-
(蓝色)+4Cl- CuCl
CuCl (黄色)+4H2O。欲用实验证明滤液A(绿色)中存在上述平衡,除滤液A外,下列试剂中还需要的是
(黄色)+4H2O。欲用实验证明滤液A(绿色)中存在上述平衡,除滤液A外,下列试剂中还需要的是_____ (填字母)。
a.FeCl3固体b.CuCl2固体c.蒸馏水
(2)某化学小组欲在实验室中研究CuS焙烧的反应过程,查阅资料得知在空气中焙烧CuS时,固体质量变化曲线及SO2生成曲线如图。
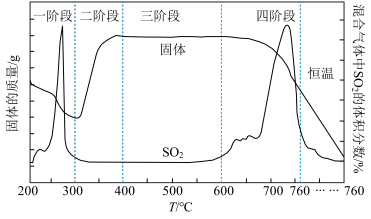
①CuS矿样在焙烧过程中,有Cu2S、CuO·CuSO4、CuSO4、CuO生成,转化顺序为CuS Cu2S
Cu2S CuO·CuSO4
CuO·CuSO4 CuSO4
CuSO4 CuO第①步转化主要在200~300℃内进行,该步转化的化学方程式
CuO第①步转化主要在200~300℃内进行,该步转化的化学方程式__________________ 。
②300~400℃内,固体质量明显增加的原因是_________________ .
③实验证明第四阶段所得混合气体所需试剂为________ 、________ 。
④若原CuS矿样的质量为10.0g,实验过程中,保持在760℃左右持续加热,待矿样充分反应后,所得固体的质量为8.4g,则原矿样中CuS的质量分数为_____ 。

(1)①若在实验室中完成系列操作a。则下列实验操作中,不需要的是

②CuCl2溶液中存在平衡:Cu(H2O)
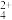 (蓝色)+4Cl-
(蓝色)+4Cl- CuCl
CuCl (黄色)+4H2O。欲用实验证明滤液A(绿色)中存在上述平衡,除滤液A外,下列试剂中还需要的是
(黄色)+4H2O。欲用实验证明滤液A(绿色)中存在上述平衡,除滤液A外,下列试剂中还需要的是a.FeCl3固体b.CuCl2固体c.蒸馏水
(2)某化学小组欲在实验室中研究CuS焙烧的反应过程,查阅资料得知在空气中焙烧CuS时,固体质量变化曲线及SO2生成曲线如图。

①CuS矿样在焙烧过程中,有Cu2S、CuO·CuSO4、CuSO4、CuO生成,转化顺序为CuS
 Cu2S
Cu2S CuO·CuSO4
CuO·CuSO4 CuSO4
CuSO4 CuO第①步转化主要在200~300℃内进行,该步转化的化学方程式
CuO第①步转化主要在200~300℃内进行,该步转化的化学方程式②300~400℃内,固体质量明显增加的原因是
③实验证明第四阶段所得混合气体所需试剂为
④若原CuS矿样的质量为10.0g,实验过程中,保持在760℃左右持续加热,待矿样充分反应后,所得固体的质量为8.4g,则原矿样中CuS的质量分数为
您最近一年使用:0次
2020-11-10更新
|
429次组卷
|
2卷引用:江西省南昌市第二中学2021届高三上学期第四次考试化学试题
7 . 某实验小组设计实验探究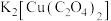 (二草酸合铜酸钾)的热分解产物,装置如下图所示:
(二草酸合铜酸钾)的热分解产物,装置如下图所示:
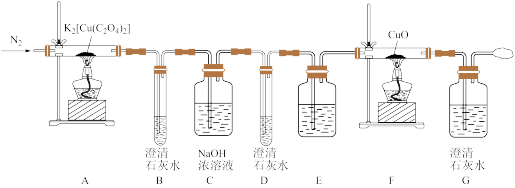
(1)E的广口瓶中盛放的药品是_______________ 。
(2)通过实验证明分解产物中有 、
、 生成,能说明分解产物中有
生成,能说明分解产物中有 的现象是
的现象是________ 。
(3)停止实验时先熄灭两个酒精灯,继续通入 至室温的目的是
至室温的目的是________ 。
(4)取A中的残留固体(已完全分解)溶于水过滤、洗涤,得砖红色滤渣和无色溶液,通过实验证明无色溶液中含 和
和 ,其中验证
,其中验证 的操作是
的操作是_______ ;取少量砖红色滤渣加入稀硫酸,产生蓝色溶液且有红色固体生成,则砖红色滤渣是____________ (一种氧化物)。
(5)依据上述实验,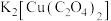 分解的化学方程式为
分解的化学方程式为_______ 。
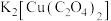 (二草酸合铜酸钾)的热分解产物,装置如下图所示:
(二草酸合铜酸钾)的热分解产物,装置如下图所示:
(1)E的广口瓶中盛放的药品是
(2)通过实验证明分解产物中有
 、
、 生成,能说明分解产物中有
生成,能说明分解产物中有 的现象是
的现象是(3)停止实验时先熄灭两个酒精灯,继续通入
 至室温的目的是
至室温的目的是(4)取A中的残留固体(已完全分解)溶于水过滤、洗涤,得砖红色滤渣和无色溶液,通过实验证明无色溶液中含
 和
和 ,其中验证
,其中验证 的操作是
的操作是(5)依据上述实验,
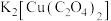 分解的化学方程式为
分解的化学方程式为
您最近一年使用:0次
名校
解题方法
8 . 实验小组探究KI与Cu(NO3)2的反应,进行实验一:
实验一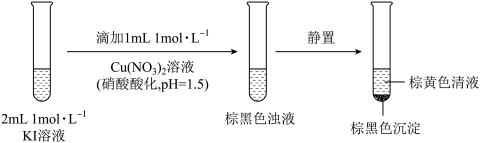
注:本实验忽略Cu2+在此条件下的水解。
(1)取棕黄色清液,加入少量______ 溶液(试剂a),清液变为______ 色,说明生成了I2。
(2)探究生成I2的原因。
①甲同学进行如下实验:向2mL1mol·L-1KI溶液中加入1mL______ 溶液(硝酸酸化,pH=1.5),再加入少量试剂a,观察到与(1)相同的现象。甲同学由此得出结论:实验一中生成I2的原因是酸性条件下,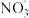 氧化了I-。
氧化了I-。
②乙同学认为仅由甲的实验还不能得出相应结论。他的理由是该实验没有排除____________ 氧化I-的可能性。
③若要确证实验一中是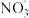 氧化了I-,应在实验一的基础上进行检验
氧化了I-,应在实验一的基础上进行检验______ 的实验。
(3)探究棕黑色沉淀的组成。
①查阅资料得知:CuI为难溶于水的白色固体。于是对棕黑色沉淀的组成提出两种假设:
a.CuI吸附I2b._________ 吸附I2。为证明上述假设是否成立,取棕黑色沉淀进行实验二:
实验二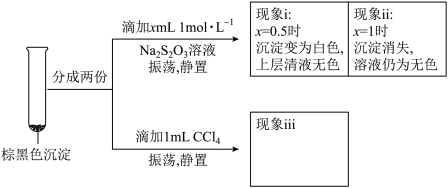
已知:CuI难溶于CCl4;I2+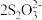 ==2I-+
==2I-+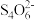 (无色);Cu++S2O32-==
(无色);Cu++S2O32-==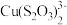 (无色)。由实验二得出结论:棕黑色沉淀是CuI吸附I2形成的。
(无色)。由实验二得出结论:棕黑色沉淀是CuI吸附I2形成的。
②现象iii为______________ 。
③用化学平衡移动原理解释产生现象ii的原因:________________ 。
实验一

注:本实验忽略Cu2+在此条件下的水解。
(1)取棕黄色清液,加入少量
(2)探究生成I2的原因。
①甲同学进行如下实验:向2mL1mol·L-1KI溶液中加入1mL
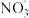 氧化了I-。
氧化了I-。②乙同学认为仅由甲的实验还不能得出相应结论。他的理由是该实验没有排除
③若要确证实验一中是
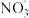 氧化了I-,应在实验一的基础上进行检验
氧化了I-,应在实验一的基础上进行检验(3)探究棕黑色沉淀的组成。
①查阅资料得知:CuI为难溶于水的白色固体。于是对棕黑色沉淀的组成提出两种假设:
a.CuI吸附I2b.
实验二

已知:CuI难溶于CCl4;I2+
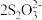 ==2I-+
==2I-+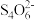 (无色);Cu++S2O32-==
(无色);Cu++S2O32-==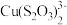 (无色)。由实验二得出结论:棕黑色沉淀是CuI吸附I2形成的。
(无色)。由实验二得出结论:棕黑色沉淀是CuI吸附I2形成的。②现象iii为
③用化学平衡移动原理解释产生现象ii的原因:
您最近一年使用:0次
2020-05-02更新
|
377次组卷
|
2卷引用:北京市101中学2019-2020学年高三化学统考三
10-11高三上·山西·期中
名校
解题方法
9 . 三氧化二铁和氧化亚铜( )都是红色粉末,常用作颜料。某校一化学实验小组通过实验探究一红色粉末的成分。探究过程如下:
)都是红色粉末,常用作颜料。某校一化学实验小组通过实验探究一红色粉末的成分。探究过程如下:
【查阅资料】 溶于稀硫酸生成Cu、
溶于稀硫酸生成Cu、 和
和 ,在空气中加热生成
,在空气中加热生成 。
。
【提出假设】假设1:红色粉末是 ;
;
假设2:红色粉末是 ;
;
假设3:红色粉末是 和
和 的混合物。
的混合物。
【设计实验】取少量该红色粉末加入足量稀硫酸中,再向所得溶液中滴加KSCN溶液。
(1)若假设1成立,则实验现象是____________________________________________________________ 。
(2)若滴加KSCN溶液,溶液不变红,则证明原红色粉末中一定不含 。你认为这种说法
。你认为这种说法_________ (填“合理”或“不合理”),理由是______________________________________________________ 。
(3)若红色粉末完全溶解,滴加KSCN溶液,溶液不变红,则证明原红色粉末是_____________________ ,写出发生反应的离子方程式:_________________________________________________________ 。
【探究延伸】
(4)经实验分析,确定该红色粉末为 和
和 的混合物。某实验小组欲用加热法测定该红色粉末中
的混合物。某实验小组欲用加热法测定该红色粉末中 的质量分数。取
的质量分数。取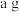 红色粉末在空气中充分加热,待质量不再变化时,称其质量为
红色粉末在空气中充分加热,待质量不再变化时,称其质量为 ,则该红色粉末中
,则该红色粉末中 的质量分数为
的质量分数为_____________________ 。
 )都是红色粉末,常用作颜料。某校一化学实验小组通过实验探究一红色粉末的成分。探究过程如下:
)都是红色粉末,常用作颜料。某校一化学实验小组通过实验探究一红色粉末的成分。探究过程如下:【查阅资料】
 溶于稀硫酸生成Cu、
溶于稀硫酸生成Cu、 和
和 ,在空气中加热生成
,在空气中加热生成 。
。【提出假设】假设1:红色粉末是
 ;
;假设2:红色粉末是
 ;
;假设3:红色粉末是
 和
和 的混合物。
的混合物。【设计实验】取少量该红色粉末加入足量稀硫酸中,再向所得溶液中滴加KSCN溶液。
(1)若假设1成立,则实验现象是
(2)若滴加KSCN溶液,溶液不变红,则证明原红色粉末中一定不含
 。你认为这种说法
。你认为这种说法(3)若红色粉末完全溶解,滴加KSCN溶液,溶液不变红,则证明原红色粉末是
【探究延伸】
(4)经实验分析,确定该红色粉末为
 和
和 的混合物。某实验小组欲用加热法测定该红色粉末中
的混合物。某实验小组欲用加热法测定该红色粉末中 的质量分数。取
的质量分数。取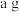 红色粉末在空气中充分加热,待质量不再变化时,称其质量为
红色粉末在空气中充分加热,待质量不再变化时,称其质量为 ,则该红色粉末中
,则该红色粉末中 的质量分数为
的质量分数为
您最近一年使用:0次
2020-10-02更新
|
499次组卷
|
7卷引用:2011-2012学年甘肃省天水一中高二第二学段测试化学试卷
(已下线)2011-2012学年甘肃省天水一中高二第二学段测试化学试卷(已下线)2010年山西省山大附中高三上学期期中考试化学卷(已下线)2011届福建省泉州外国语中学高三上学期期中考试(理综)化学部分【全国百强校】河北省张家口市第一中学2018-2019学年高一(衔接班)下学期开学考试化学试题高一必修第一册(鲁科2019)第3章 第1节 铁的多样性 方法帮人教版(2019)高一必修第一册 第三章 铁 金属材料 第一节 铁及其化合物 方法帮(已下线)第3章 章末检测-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)
10 . 已知:硝酸铜受热易分解。170℃时,2Cu(NO3)2 2CuO+4NO2↑+O2↑开始分解,至250℃分解完全。(其中2NO2
2CuO+4NO2↑+O2↑开始分解,至250℃分解完全。(其中2NO2 N2O4,2NO2
N2O4,2NO2 2NO+O2等反应忽略不计)。
2NO+O2等反应忽略不计)。
800℃时,4CuO 2Cu2O+O2↑ 开始分解,至1000℃以上分解完全。
2Cu2O+O2↑ 开始分解,至1000℃以上分解完全。
(1)取5.64 g无水硝酸铜,加热至1000℃以上,将生成的气体导入足量的NaOH溶液充分吸收后,还有逸出的气体是____ (填分子式),体积(标准状况)为______ ;将吸收液加水稀释到100 mL,此溶液中NO3-的物质的量浓度为_____________ 。
(2)取5.64 g无水硝酸铜加热至某温度分解后的残留固体中含有1.60 g CuO,则残留固体的质量可能是_________ 。
(3)实验证明,当温度达到1800℃时,Cu2O也会发生分解:2Cu2O 4Cu+O2↑。取8.00 g CuO,加热到1800℃左右,冷却后称得质量为6.88 g,通过计算求出反应后剩余固体中各成分的物质的量之比________________ 。
(4)取8.00 g CuO,通入一定量H2并加热,使其部分还原为Cu和Cu2O,且其中n(Cu2O):n(Cu)=x。将此混合物溶于足量的稀硫酸中(Cu2O+2H+=Cu+Cu2++H2O),充分反应后过滤得到Cu y g,试求未被还原的CuO的物质的量(用含x、y的代数式表示)。_________
 2CuO+4NO2↑+O2↑开始分解,至250℃分解完全。(其中2NO2
2CuO+4NO2↑+O2↑开始分解,至250℃分解完全。(其中2NO2 N2O4,2NO2
N2O4,2NO2 2NO+O2等反应忽略不计)。
2NO+O2等反应忽略不计)。800℃时,4CuO
 2Cu2O+O2↑ 开始分解,至1000℃以上分解完全。
2Cu2O+O2↑ 开始分解,至1000℃以上分解完全。(1)取5.64 g无水硝酸铜,加热至1000℃以上,将生成的气体导入足量的NaOH溶液充分吸收后,还有逸出的气体是
(2)取5.64 g无水硝酸铜加热至某温度分解后的残留固体中含有1.60 g CuO,则残留固体的质量可能是
(3)实验证明,当温度达到1800℃时,Cu2O也会发生分解:2Cu2O 4Cu+O2↑。取8.00 g CuO,加热到1800℃左右,冷却后称得质量为6.88 g,通过计算求出反应后剩余固体中各成分的物质的量之比
(4)取8.00 g CuO,通入一定量H2并加热,使其部分还原为Cu和Cu2O,且其中n(Cu2O):n(Cu)=x。将此混合物溶于足量的稀硫酸中(Cu2O+2H+=Cu+Cu2++H2O),充分反应后过滤得到Cu y g,试求未被还原的CuO的物质的量(用含x、y的代数式表示)。
您最近一年使用:0次



