名校
1 . 实验小组研究铜与硝酸的反应,实验如下(加持装置和尾气处理装置略)。
(1)实验I、II中的红棕色气体均是 。
。
①实验I产生 的化学方程式是
的化学方程式是_______ 。
②实验II产生 的化学方程式是
的化学方程式是_______ 。
(2)对实验I产生 ,实验II产生NO的原因提出解释。
,实验II产生NO的原因提出解释。
①硝酸浓度越稀,溶液中单位体积内的 数目越少。被还原时,每个
数目越少。被还原时,每个 从铜片处获得较多电子的机会越
从铜片处获得较多电子的机会越_______ (填“大”或“小”),因此越易被还原为较低价态的含氮物质。
②浓硝酸具有较强的_______ 性,可将NO转化为 。
。
(3)对实验I所得溶液呈绿色,而实验II所得溶液呈蓝色的原因提出猜想。查阅资料:
i. 溶于浓硝酸后呈黄色;
溶于浓硝酸后呈黄色;
ii.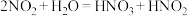 。
。 是弱酸,不稳定。
是弱酸,不稳定。
猜想一: 溶于浓硝酸,与蓝色
溶于浓硝酸,与蓝色 溶液混合而呈现绿色。
溶液混合而呈现绿色。
猜想二: 电离出的
电离出的 与
与 结合为
结合为 绿色)。
绿色)。
①向浓硝酸中通入 ,现象是
,现象是_______ ,滴加少量蓝色 溶液后呈绿色,证实猜想一合理。
溶液后呈绿色,证实猜想一合理。
②研究猜想二是否为实验I所得溶液呈绿色的主要原因,实验如下。
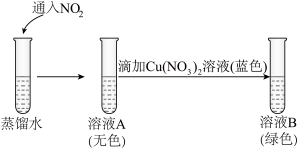
a.能说明溶液A中含有 的现象是
的现象是_______ 。
b.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想二不是实验I所得溶液呈绿色的主要原因,说明理由:_______ 。
(4) 因外观和食盐相似,又有咸味,容易使人误食中毒。已知
因外观和食盐相似,又有咸味,容易使人误食中毒。已知 能发生如下反应:
能发生如下反应: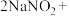
 ,根据上述反应,选择生活中常见的物质和有关试剂进行实验,以鉴别
,根据上述反应,选择生活中常见的物质和有关试剂进行实验,以鉴别 和NaCl固体。需选用的物质是
和NaCl固体。需选用的物质是_______ (填序号)。
①水 ②淀粉碘化钾试纸 ③淀粉 ④白酒 ⑤白醋
| 装置 | 编号 | 试剂a | 现象 |
 | I | 4mL浓硝酸(过量) | 铜片完全溶解,溶液变绿,出现大量红棕色气体 |
| II | 4mL稀硝酸(过量) | 铜片完全溶解,溶液变蓝,液面上方气体呈浅红棕色 |
 。
。①实验I产生
 的化学方程式是
的化学方程式是②实验II产生
 的化学方程式是
的化学方程式是(2)对实验I产生
 ,实验II产生NO的原因提出解释。
,实验II产生NO的原因提出解释。①硝酸浓度越稀,溶液中单位体积内的
 数目越少。被还原时,每个
数目越少。被还原时,每个 从铜片处获得较多电子的机会越
从铜片处获得较多电子的机会越②浓硝酸具有较强的
 。
。(3)对实验I所得溶液呈绿色,而实验II所得溶液呈蓝色的原因提出猜想。查阅资料:
i.
 溶于浓硝酸后呈黄色;
溶于浓硝酸后呈黄色;ii.
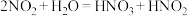 。
。 是弱酸,不稳定。
是弱酸,不稳定。猜想一:
 溶于浓硝酸,与蓝色
溶于浓硝酸,与蓝色 溶液混合而呈现绿色。
溶液混合而呈现绿色。猜想二:
 电离出的
电离出的 与
与 结合为
结合为 绿色)。
绿色)。①向浓硝酸中通入
 ,现象是
,现象是 溶液后呈绿色,证实猜想一合理。
溶液后呈绿色,证实猜想一合理。②研究猜想二是否为实验I所得溶液呈绿色的主要原因,实验如下。

a.能说明溶液A中含有
 的现象是
的现象是b.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想二不是实验I所得溶液呈绿色的主要原因,说明理由:
(4)
 因外观和食盐相似,又有咸味,容易使人误食中毒。已知
因外观和食盐相似,又有咸味,容易使人误食中毒。已知 能发生如下反应:
能发生如下反应: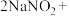
 ,根据上述反应,选择生活中常见的物质和有关试剂进行实验,以鉴别
,根据上述反应,选择生活中常见的物质和有关试剂进行实验,以鉴别 和NaCl固体。需选用的物质是
和NaCl固体。需选用的物质是①水 ②淀粉碘化钾试纸 ③淀粉 ④白酒 ⑤白醋
您最近一年使用:0次
名校
解题方法
2 . 在标准状况下将3.2g铜粉投入一定量浓 中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由
中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由 和NO组成的混合气体1.344L(已转化为标况下的体积),则混合气体中NO的体积为
和NO组成的混合气体1.344L(已转化为标况下的体积),则混合气体中NO的体积为
 中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由
中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由 和NO组成的混合气体1.344L(已转化为标况下的体积),则混合气体中NO的体积为
和NO组成的混合气体1.344L(已转化为标况下的体积),则混合气体中NO的体积为| A.112mL | B.224mL | C.448mL | D.1008mL |
您最近一年使用:0次
2023-03-21更新
|
437次组卷
|
8卷引用:江西省南昌市第十中学2022—2023学年高一下学期第一次月考化学试题
江西省南昌市第十中学2022—2023学年高一下学期第一次月考化学试题北京师范大学附属中学2020-2021学年高一下学期期中考试化学(选考班)试题北京师范大学附属中学2021-2022学年高一下学期期中考试化学试题(已下线)专题01 金属及其化合物(知识串讲+专题过关)-2022-2023学年高一化学下学期期中期末考点大串讲(沪科版2020必修第二册)(已下线)期中模拟题(一)-2022-2023学年高一化学下学期期中期末考点大串讲(沪科版2020必修第二册)北京师范大学附属中学2022-2023学年高一下学期期中考试化学试题天津市滨海新区塘沽第一中学2023-2024学年高一下学期第一次月考化学试卷 北京市东直门中学2023-2024学年高一下学期3月学情监测化学试题
名校
解题方法
3 . 向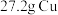 和
和 的混合物中加入某浓度的稀硝酸
的混合物中加入某浓度的稀硝酸 ,固体物质完全反应,得到标准状况下
,固体物质完全反应,得到标准状况下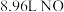 和
和 的混合气体及
的混合气体及 。在所得溶液中加入
。在所得溶液中加入 的NaOH溶液
的NaOH溶液 ,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为
,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为 。下列有关说法正确的是
。下列有关说法正确的是
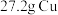 和
和 的混合物中加入某浓度的稀硝酸
的混合物中加入某浓度的稀硝酸 ,固体物质完全反应,得到标准状况下
,固体物质完全反应,得到标准状况下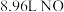 和
和 的混合气体及
的混合气体及 。在所得溶液中加入
。在所得溶液中加入 的NaOH溶液
的NaOH溶液 ,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为
,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为 。下列有关说法正确的是
。下列有关说法正确的是A. 与 与 的物质的量之比为 的物质的量之比为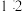 | B.硝酸的物质的量浓度为2.4mol/L |
C.产生的 的体积为 的体积为 (标况) (标况) | D. 、 、 与硝酸反应后剩余 与硝酸反应后剩余 为 为 |
您最近一年使用:0次
2023-03-19更新
|
885次组卷
|
5卷引用:江西省九江市德安县第一中学2022-2023学年高一下学期5月期中考试化学试题
名校
4 . 足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO、 的混合气体,这些气体与2.24 L
的混合气体,这些气体与2.24 L  (标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,若向所得硝酸铜溶液中加入8 mol/L NaOH溶液至
(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,若向所得硝酸铜溶液中加入8 mol/L NaOH溶液至 恰好完全沉淀,则消耗NaOH溶液的体积是
恰好完全沉淀,则消耗NaOH溶液的体积是
 的混合气体,这些气体与2.24 L
的混合气体,这些气体与2.24 L  (标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,若向所得硝酸铜溶液中加入8 mol/L NaOH溶液至
(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,若向所得硝酸铜溶液中加入8 mol/L NaOH溶液至 恰好完全沉淀,则消耗NaOH溶液的体积是
恰好完全沉淀,则消耗NaOH溶液的体积是| A.60mL | B.50mL | C.40mL | D.30mL |
您最近一年使用:0次
2023-03-07更新
|
1188次组卷
|
5卷引用:江西省南昌十九中2022-2023学年高一下学期3月第一次月考化学试卷
名校
解题方法
5 . 将6.4g铜片加入100mL一定浓度的硝酸溶液中,铜片完全溶解,产生2.24L气体(折算为标准状况),向反应后的溶液中加入200mL4mol/LNaOH溶液,溶液中的Cu2+恰好完全沉淀。下列说法正确的是
A.原硝酸溶液的浓度为 |
B.铜与硝酸反应产生的气体为 |
C.铜片溶解后,溶液中溶质为 |
D.若将产生的气体与足量 混合通入水中充分反应,消耗 混合通入水中充分反应,消耗 0.05mol 0.05mol |
您最近一年使用:0次
2023-02-10更新
|
908次组卷
|
5卷引用:江西省赣州市石城中学2022-2023学年高一下学期3月第二次月考化学试题
名校
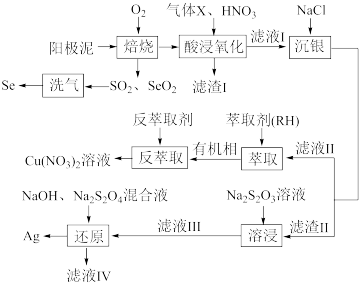
6 . 铜阳极泥含有 Cu、Ag、Pt、Au、Ag2Se和 Cu2S 等,下图是从中回收 Se 和贵重金属的工艺:已知:
该工艺中萃取与反萃取原理为:2RH+ Cu2+ R2 Cu+2H+;
R2 Cu+2H+;
②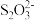 在碱性条件下很稳定,易与 Ag+络合:Ag++2
在碱性条件下很稳定,易与 Ag+络合:Ag++2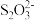
 [Ag(S2O3)2]3-,常温下该反应的平衡常数 K=2.80×1013。
[Ag(S2O3)2]3-,常温下该反应的平衡常数 K=2.80×1013。
回答下列问题:
(1)写出“焙烧”时 Ag2Se生成 Ag2O 的化学方程式___________
(2)写出“滤渣I”的一种用途___________
(3)在实验室进行萃取操作所需的玻璃仪器___________ 。“反萃取剂”最好选用 ___________ (填化学式)溶液。
(4)“溶浸”中发生的反应为 AgCl(s)+2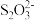 (aq)
(aq) [Ag(S2O3)2]3- (aq)+Cl- (aq) ,请通过计算说明该反应能否进行完全:
[Ag(S2O3)2]3- (aq)+Cl- (aq) ,请通过计算说明该反应能否进行完全:___________ [已知 Ksp(AgCl)=1.80×10- 10]
(5)“滤液IV”中含有 Na2SO3,则“还原”中发生反应的离子方程为___________ ; “滤液IV”可返回“溶浸”工序循环使用,但循环多次后,银的浸出率会降低,原因是________ (结合平衡原理进行解释)。

该工艺中萃取与反萃取原理为:2RH+ Cu2+
 R2 Cu+2H+;
R2 Cu+2H+;②
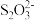 在碱性条件下很稳定,易与 Ag+络合:Ag++2
在碱性条件下很稳定,易与 Ag+络合:Ag++2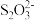
 [Ag(S2O3)2]3-,常温下该反应的平衡常数 K=2.80×1013。
[Ag(S2O3)2]3-,常温下该反应的平衡常数 K=2.80×1013。回答下列问题:
(1)写出“焙烧”时 Ag2Se生成 Ag2O 的化学方程式
(2)写出“滤渣I”的一种用途
(3)在实验室进行萃取操作所需的玻璃仪器
(4)“溶浸”中发生的反应为 AgCl(s)+2
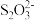 (aq)
(aq) [Ag(S2O3)2]3- (aq)+Cl- (aq) ,请通过计算说明该反应能否进行完全:
[Ag(S2O3)2]3- (aq)+Cl- (aq) ,请通过计算说明该反应能否进行完全:(5)“滤液IV”中含有 Na2SO3,则“还原”中发生反应的离子方程为
您最近一年使用:0次
名校
解题方法
7 . 甲同学在室温下探究铜片与稀硝酸反应的实验过程中发现:
i.将铜片与10Lamol•L-1的稀硝酸直接反应,短时间内无明显变化,一段时间后才有少量气泡产生。
ii.将铜片先与一定量的浓硝酸反应片刻后过滤,向所得绿色清液中加水稀释至c(HNO3)=amol•L-1,再取所得蓝色溶液10mL,加入铜片,立即产生气泡。
回答下列问题:
(1)甲同学为了探究ii中立即产生气泡的原因,查阅资料得知:NO2溶于水可以生成HNO2和____ 。
他猜想ii中可能生成了对铜和稀硝酸反应有催化作用的物质。
为了验证猜想,他进行了如下实验:
方案一:
①实验操作及现象:向10mLamol•L-1的稀硝酸中加入少量____ ,溶液呈浅蓝色,加入铜片,无明显变化。
②实验结论:Cu2+对该反应没有催化作用。
方案二:
①实验操作及现象:
a.向10mLamol•L-1的稀硝酸中加入少量HNO2溶液,再加入铜片,立即产生气泡。
b.向10mLamol•L-1的稀硝酸中通入少量NO2后加入铜片,立即产生气泡。
c.向10mLamol•L-1的稀硝酸中加入几滴浓度略大的硝酸后加入铜片,无明显变化。
d.向ii中10mL蓝色溶液中通入N2数分钟后加入铜片,产生气泡速率变慢。
②设计实验c的目的是____ 。
③实验结论:____ 。
(2)探究硝酸铜晶体[Cu(NO3)2•xH2O]的性质。
①铜与稀硝酸反应后的溶液经_____ ,过滤,洗涤,干燥后可制得硝酸铜晶体。
②取36.3g硝酸铜晶体溶于水,配制成100mL溶液,将其置于电解槽中用惰性电极进行电解,当有0.3mol电子通过电极时,溶液中的金属离子恰好在电极上完全析出,则x值为____ ;取相同质量的该晶体放在坩埚中加热,在不同温度阶段进行质量分析,当温度升至T℃时,剩余固体质量变为原来的29.75%,则剩余固体的化学式可能为_____ 。
i.将铜片与10Lamol•L-1的稀硝酸直接反应,短时间内无明显变化,一段时间后才有少量气泡产生。
ii.将铜片先与一定量的浓硝酸反应片刻后过滤,向所得绿色清液中加水稀释至c(HNO3)=amol•L-1,再取所得蓝色溶液10mL,加入铜片,立即产生气泡。
回答下列问题:
(1)甲同学为了探究ii中立即产生气泡的原因,查阅资料得知:NO2溶于水可以生成HNO2和
他猜想ii中可能生成了对铜和稀硝酸反应有催化作用的物质。
为了验证猜想,他进行了如下实验:
方案一:
①实验操作及现象:向10mLamol•L-1的稀硝酸中加入少量
②实验结论:Cu2+对该反应没有催化作用。
方案二:
①实验操作及现象:
a.向10mLamol•L-1的稀硝酸中加入少量HNO2溶液,再加入铜片,立即产生气泡。
b.向10mLamol•L-1的稀硝酸中通入少量NO2后加入铜片,立即产生气泡。
c.向10mLamol•L-1的稀硝酸中加入几滴浓度略大的硝酸后加入铜片,无明显变化。
d.向ii中10mL蓝色溶液中通入N2数分钟后加入铜片,产生气泡速率变慢。
②设计实验c的目的是
③实验结论:
(2)探究硝酸铜晶体[Cu(NO3)2•xH2O]的性质。
①铜与稀硝酸反应后的溶液经
②取36.3g硝酸铜晶体溶于水,配制成100mL溶液,将其置于电解槽中用惰性电极进行电解,当有0.3mol电子通过电极时,溶液中的金属离子恰好在电极上完全析出,则x值为
您最近一年使用:0次
8 . 下列反应的化学方程式或离子方程式书写正确的是
A.实验室制备 时需加入少量铁粉: 时需加入少量铁粉: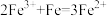 |
B.铜片与稀 反应生成气体: 反应生成气体: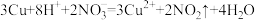 |
C.将铜丝插入浓硫酸中: |
D.切开的金属Na暴露在空气中表面逐渐变暗: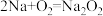 |
您最近一年使用:0次
名校
解题方法
9 . 下列说法不正确的是
A.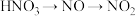 ,以上各步变化均能通过一步实验完成 ,以上各步变化均能通过一步实验完成 |
B.在稀硫酸中加入铜粉,铜粉不溶解,再加入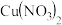 固体,铜粉溶解 固体,铜粉溶解 |
| C.某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性 |
D.铜与浓硝酸反应的离子方程式为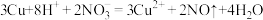 |
您最近一年使用:0次
2022-09-26更新
|
62次组卷
|
3卷引用:江西省宁冈中学2022-2023学年高一下学期6月期末化学试题
10 . 1.52g铜镁合金完全溶解于50mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法正确的是
| A.该浓硝酸中HNO3的物质的量浓度为14mol/L |
| B.该合金中铜与镁的物质的量之比为1:2 |
| C.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| D.得到2.54 g沉淀时,加入NaOH溶液的体积是600mL |
您最近一年使用:0次
2022-08-21更新
|
944次组卷
|
3卷引用:江西省景德镇一中2021-2022学年高一下学期期中质量检测(17)班化学试题



