名校
解题方法
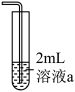
1 . 铜(过量)与浓硝酸反应,制备少量NaNO3,装置如下图所示。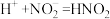 ,HNO2不稳定,易分解为硝酸和一氧化氮
,HNO2不稳定,易分解为硝酸和一氧化氮
(1)产生的红棕色气体是___________ 。
(2)一段时间后,试管中不再产生气体,静置。
①试管中溶液c(H+)___________ c( )(填“>”或“<”)。
)(填“>”或“<”)。
②滴加稀H2SO4,铜丝继续溶解,产生无色气体,反应的离子方程式是___________ 。
(3)NaOH溶液吸收NO2、NO。
①
___________
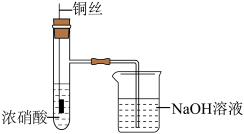
②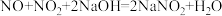
(4)向烧杯中加入稀HNO3,加热,搅拌,冷却结晶,过滤得NaNO3固体。稀HNO3的作用是 、
、___________ (用化学方程式表示)。
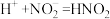 ,HNO2不稳定,易分解为硝酸和一氧化氮
,HNO2不稳定,易分解为硝酸和一氧化氮(1)产生的红棕色气体是
(2)一段时间后,试管中不再产生气体,静置。
①试管中溶液c(H+)
 )(填“>”或“<”)。
)(填“>”或“<”)。②滴加稀H2SO4,铜丝继续溶解,产生无色气体,反应的离子方程式是
(3)NaOH溶液吸收NO2、NO。
①

②
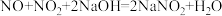
(4)向烧杯中加入稀HNO3,加热,搅拌,冷却结晶,过滤得NaNO3固体。稀HNO3的作用是
 、
、
您最近一年使用:0次
2023-07-13更新
|
191次组卷
|
3卷引用:北京市陈经纶中学2023-2024学年高一下学期3月月考化学试题
北京市陈经纶中学2023-2024学年高一下学期3月月考化学试题(已下线)专题01 硫、氮及其化合物-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(北京专用)北京朝阳区2022-2023学年高一下学期7月期末考试化学试题
2 . 化学小组同学用铜与过量浓硝酸反应制备 气体,实验后发现溶液呈绿色,对其原因进行如下探究。
气体,实验后发现溶液呈绿色,对其原因进行如下探究。
(1)甲同学提出猜想:浓硝酸中溶解了生成的 呈黄色,黄色与蓝色叠加显绿色。
呈黄色,黄色与蓝色叠加显绿色。
实验:向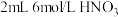 中通入稳定的
中通入稳定的 气流,溶液变黄。取该溶液与蓝色
气流,溶液变黄。取该溶液与蓝色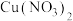 溶液混合,观察到溶液显绿色,验证了猜想。
溶液混合,观察到溶液显绿色,验证了猜想。
甲同学进一步探究硝酸溶液中何种粒子与 作用显黄色。
作用显黄色。
①写出铜和浓硝酸反应产生 的化学方程式
的化学方程式___________ 。
②实验1中溶液a是___________ 。
③依据上述实验推知,浓硝酸中溶液 呈黄色是溶液中
呈黄色是溶液中___________ 与 作用的结果。
作用的结果。
(2)资料:ⅰ.铜与浓硝酸反应过程中可生成 ,
, 易分解产生无色气体
易分解产生无色气体
ⅱ. 是一种弱酸。
是一种弱酸。 电离出
电离出 ,
, 与
与 发生如下反应:
发生如下反应: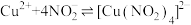 (绿色)
(绿色)
乙同学依据资料提出猜想:铜与浓硝酸反应过程中生成 ,使溶液呈绿色。
,使溶液呈绿色。
实验4: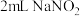 溶液与
溶液与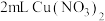 溶液混合,溶液呈绿色,加入
溶液混合,溶液呈绿色,加入 浓硝酸后,溶液变蓝。
浓硝酸后,溶液变蓝。
丙同学对加入浓硝酸后溶液变蓝的原因提出猜想并进行实验验证。
猜想1:加入浓硝酸后发生反应: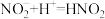 ,
, 浓度下降,绿色消失。
浓度下降,绿色消失。
猜想2:酸性条件下 分解,
分解, 浓度下降,绿色消失。
浓度下降,绿色消失。
①补全 分解的化学方程式:□
分解的化学方程式:□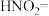 □
□ □___________+□___________
□___________+□______________________
②用离子方程式表示加入 溶液的作用
溶液的作用___________ 。
③丙同学依据实验推知猜想___________ (填“1”或“2”)成立。
(3)综合上述实验得出:过量浓硝酸与铜反应后溶液呈绿色的主要原因是___________ 。
 气体,实验后发现溶液呈绿色,对其原因进行如下探究。
气体,实验后发现溶液呈绿色,对其原因进行如下探究。(1)甲同学提出猜想:浓硝酸中溶解了生成的
 呈黄色,黄色与蓝色叠加显绿色。
呈黄色,黄色与蓝色叠加显绿色。实验:向
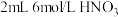 中通入稳定的
中通入稳定的 气流,溶液变黄。取该溶液与蓝色
气流,溶液变黄。取该溶液与蓝色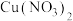 溶液混合,观察到溶液显绿色,验证了猜想。
溶液混合,观察到溶液显绿色,验证了猜想。甲同学进一步探究硝酸溶液中何种粒子与
 作用显黄色。
作用显黄色。| 实验装置 | 操作 | 编号 | 溶液a | 现象 |
| 向溶液a中通入稳定的 气流8s 气流8s | 实验1 | ___________ | 溶液基本无色 |
| 实验2 | 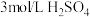 | 立即变黄 | ||
| 实验3 | 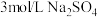 | 溶液基本无色 |
 的化学方程式
的化学方程式②实验1中溶液a是
③依据上述实验推知,浓硝酸中溶液
 呈黄色是溶液中
呈黄色是溶液中 作用的结果。
作用的结果。(2)资料:ⅰ.铜与浓硝酸反应过程中可生成
 ,
, 易分解产生无色气体
易分解产生无色气体ⅱ.
 是一种弱酸。
是一种弱酸。 电离出
电离出 ,
, 与
与 发生如下反应:
发生如下反应: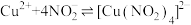 (绿色)
(绿色)乙同学依据资料提出猜想:铜与浓硝酸反应过程中生成
 ,使溶液呈绿色。
,使溶液呈绿色。实验4:
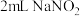 溶液与
溶液与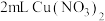 溶液混合,溶液呈绿色,加入
溶液混合,溶液呈绿色,加入 浓硝酸后,溶液变蓝。
浓硝酸后,溶液变蓝。丙同学对加入浓硝酸后溶液变蓝的原因提出猜想并进行实验验证。
猜想1:加入浓硝酸后发生反应:
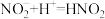 ,
, 浓度下降,绿色消失。
浓度下降,绿色消失。猜想2:酸性条件下
 分解,
分解, 浓度下降,绿色消失。
浓度下降,绿色消失。| 将实验4中蓝色溶液分成两份 | 加入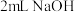 溶液,振荡 溶液,振荡 | 溶液变绿色 |
加入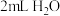 ,振荡 ,振荡 | 溶液仍为蓝色 |
 分解的化学方程式:□
分解的化学方程式:□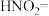 □
□ □___________+□___________
□___________+□___________②用离子方程式表示加入
 溶液的作用
溶液的作用③丙同学依据实验推知猜想
(3)综合上述实验得出:过量浓硝酸与铜反应后溶液呈绿色的主要原因是
您最近一年使用:0次
2023-07-11更新
|
293次组卷
|
7卷引用:北京市第五中学2023-2024学年高二上学期开学考化学试卷
北京市第五中学2023-2024学年高二上学期开学考化学试卷北京市第十五中学2023-2024学年高一下学期期中考试化学试题(已下线)专题01 硫、氮及其化合物-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(北京专用)(已下线)重难点04 硫和氮综合题-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(北京专用)北京工业大学附属中学2023-2024学年高一下学期期中考试化学试题北京市西城区2022-2023学年高一下学期期末测试化学试题 北京市第五中学2023-2024学年高二上学期10月月考化学试题
名校
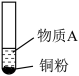
3 . 小组同学探究 和物质A的反应,实验如下。
和物质A的反应,实验如下。
下列分析不正确 的是
 和物质A的反应,实验如下。
和物质A的反应,实验如下。| 装置 | 序号 | 物质A | 实验现象 |
| ① | 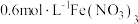 溶液(调 溶液(调 ) ) | 铜粉溶解,溶液变为深棕色[经检验含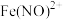 ] ] |
| ② | 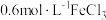 溶液 溶液 | 铜粉溶解,溶液变为蓝绿色 | |
| ③ | 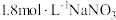 溶液(调 溶液(调 ) ) | 无明显变化 |
A.②中铜粉溶解的原因: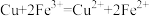 |
B.①中产生 的原因: 的原因: 时直接将 时直接将 还原为 还原为 |
C.若向③中加入 固体,推测铜粉会溶解 固体,推测铜粉会溶解 |
| D.①②③现象的差异不仅与物质氧化性(或还原性)强弱有关,也与反应速率有关 |
您最近一年使用:0次
2023-05-07更新
|
1493次组卷
|
15卷引用:北京市清华大学附属中学朝阳学校2023-2024学年高三下学期开学考化学试题
北京市清华大学附属中学朝阳学校2023-2024学年高三下学期开学考化学试题北京市第二中学2023-2024学年高三下学期开学考试化学试卷北京市八一学校2023-2024学年高一下学期3月月考化学试题北京市朝阳区2022-2023年高三下学期第二次模拟考试化学试题北京师范大学附属实验中学2023-2024学年暑期高三第一次督导化学试题北京师范大学附属中学2023-2024学年高三上学期10月月考化学试题北京市第一○一中学2023-2024学年高三上学期10月月考化学试题北京市清华大学附属中学2023-2024学年高三上学期10月月考化学试题北京市顺义牛栏山第一中学2023-2024学年高二上学期10月月考化学试题北京市第二十中学2023-2024学年高三上学期12月月考化学试题(已下线)热点19 化学微型实验(已下线)第7讲 金属材料和金属矿物利用(已下线)考点16 铜及其金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)湖南省长沙市长郡中学2022-2023学年高二下学期期末考试化学试题山东省青岛第二中学2023-2024学年高三上学期期中考试化学试卷
名校
4 . 根据如图所示装置进行实验,能得到相应结论的是。
| 试剂a、b | 现象 | 结论 | 装置 | |
| A |  、稀 、稀 | 产生的无色气体在导管口变红棕色 |  和稀 和稀 反应生成 反应生成 |
|
| B | 漂白粉、浓 | 导管口放置的湿润蓝色石蕊试纸先变红后褪色。 | 漂白粉和浓 反应生成 反应生成 | |
| C |  、75%酒精溶液 、75%酒精溶液 | 收集产生的气体,移近火焰,发出爆鸣声 |  和 和 反应生成 反应生成 | |
| D | 电石、饱和食盐水 | 产生的气体使酸性高锰酸钾溶液褪色 | 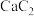 和 和 反应生成 反应生成 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-04-06更新
|
458次组卷
|
4卷引用:北京市顺义区第二中学2023-2024学年高三下学期开学测化学试题
名校
解题方法
5 . 在标准状况下将3.2g铜粉投入一定量浓 中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由
中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由 和NO组成的混合气体1.344L(已转化为标况下的体积),则混合气体中NO的体积为
和NO组成的混合气体1.344L(已转化为标况下的体积),则混合气体中NO的体积为
 中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由
中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由 和NO组成的混合气体1.344L(已转化为标况下的体积),则混合气体中NO的体积为
和NO组成的混合气体1.344L(已转化为标况下的体积),则混合气体中NO的体积为| A.112mL | B.224mL | C.448mL | D.1008mL |
您最近一年使用:0次
2023-03-21更新
|
438次组卷
|
8卷引用:北京市东直门中学2023-2024学年高一下学期3月学情监测化学试题
北京市东直门中学2023-2024学年高一下学期3月学情监测化学试题北京师范大学附属中学2020-2021学年高一下学期期中考试化学(选考班)试题北京师范大学附属中学2021-2022学年高一下学期期中考试化学试题北京师范大学附属中学2022-2023学年高一下学期期中考试化学试题天津市滨海新区塘沽第一中学2023-2024学年高一下学期第一次月考化学试卷 江西省南昌市第十中学2022—2023学年高一下学期第一次月考化学试题(已下线)专题01 金属及其化合物(知识串讲+专题过关)-2022-2023学年高一化学下学期期中期末考点大串讲(沪科版2020必修第二册)(已下线)期中模拟题(一)-2022-2023学年高一化学下学期期中期末考点大串讲(沪科版2020必修第二册)
22-23高一·全国·课后作业
名校
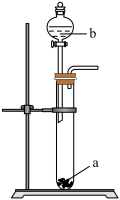
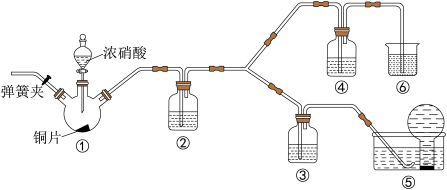
6 . 某学习小组探究浓、稀硝酸氧化性的相对强弱,按如图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
已知:氢氧化钠溶液不与NO反应,能与NO2反应:2NO2+2NaOH=NaNO3+NaNO2+H2O。
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是_______ 。
(2)装置①中发生反应的化学方程式是_______ 。
(3)装置②的作用是_______ ,发生反应的化学方程式是________ 。
(4)该小组得出的结论所依据的实验现象是_______ 。
(5)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种看法是否正确。这些方案中可行的是_______ (填字母)。
a.加热该绿色溶液,观察颜色变化
b.加水稀释该绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
已知:氢氧化钠溶液不与NO反应,能与NO2反应:2NO2+2NaOH=NaNO3+NaNO2+H2O。
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是
(2)装置①中发生反应的化学方程式是
(3)装置②的作用是
(4)该小组得出的结论所依据的实验现象是
(5)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种看法是否正确。这些方案中可行的是
a.加热该绿色溶液,观察颜色变化
b.加水稀释该绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
您最近一年使用:0次
名校
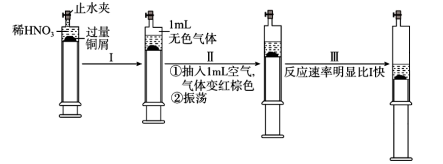
7 . 一定温度下,探究铜与稀 反应,过程如图,下列说法
反应,过程如图,下列说法不正确 的是
 反应,过程如图,下列说法
反应,过程如图,下列说法
A.过程Ⅰ中生成无色气体的离子方程式 |
B.过程Ⅲ反应速率比Ⅰ快的原因是 溶于水,使 溶于水,使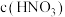 增大 增大 |
C.由实验推测, 对该反应具有催化作用或Ⅰ至Ⅲ过程中溶液温度升高 对该反应具有催化作用或Ⅰ至Ⅲ过程中溶液温度升高 |
| D.当活塞不再移动时,再抽入空气,铜可以继续溶解 |
您最近一年使用:0次
2022-08-02更新
|
487次组卷
|
2卷引用:北京理工大学附属中学2023-2024学年高二上学期开学考化学试卷
名校
解题方法
8 . 实验小组研究铜与硝酸的反应,实验如下(加持装置和尾气处理装置略)。
(1)实验Ⅰ、Ⅱ中的红棕色气体均是 。
。
①实验Ⅰ产生 的化学方程式是
的化学方程式是_______ 。
②实验Ⅱ产生 的化学方程式是
的化学方程式是_______ 。
(2)对实验Ⅰ产生 ,实验Ⅱ产生
,实验Ⅱ产生 的原因提出解释。
的原因提出解释。
①硝酸浓度越稀,溶液中单位体积内的 数目越少。被还原时,每个
数目越少。被还原时,每个 从铜片处获得较多电子的机会越
从铜片处获得较多电子的机会越_______ (填“大”或“小”),因此越易被还原为较低价态的含氮物质。
②浓硝酸具有较强的_______ 性,可将 转化为
转化为 。
。
(3)对实验Ⅰ所得溶液呈绿色,而实验Ⅱ所得溶液呈蓝色的原因提出猜想。
查阅资料:ⅰ. 溶于浓硝酸后呈黄色;
溶于浓硝酸后呈黄色;
ⅱ.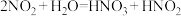 。
。 是弱酸,不稳定。
是弱酸,不稳定。
猜想一: 溶于浓硝酸,与蓝色
溶于浓硝酸,与蓝色 溶液混合而呈现绿色。
溶液混合而呈现绿色。
猜想二: 电离出的
电离出的 与
与 结合为
结合为 (绿色)。
(绿色)。
①向浓硝酸中通入 ,现象是
,现象是_______ ,滴加少量蓝色 溶液后呈绿色,证实猜想一合理。
溶液后呈绿色,证实猜想一合理。
②研究猜想二是否为实验Ⅰ所得溶液呈绿色的主要原因,实验如下。 的现象是
的现象是_______ 。
b.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想二不是实验Ⅰ所得溶液呈绿色的主要原因,说明理由:_______ 。
| 装置 | 编号 | 试剂a | 现象 |
| Ⅰ | 4 浓硝酸 (过量) 浓硝酸 (过量) | 铜片完全溶解,溶液变绿,出现大量红棕色气体 |
| Ⅱ | 4 稀硝酸 (过量) 稀硝酸 (过量) | 铜片完全溶解,溶液变蓝,液面上方气体呈浅红棕色 |
 。
。①实验Ⅰ产生
 的化学方程式是
的化学方程式是②实验Ⅱ产生
 的化学方程式是
的化学方程式是(2)对实验Ⅰ产生
 ,实验Ⅱ产生
,实验Ⅱ产生 的原因提出解释。
的原因提出解释。①硝酸浓度越稀,溶液中单位体积内的
 数目越少。被还原时,每个
数目越少。被还原时,每个 从铜片处获得较多电子的机会越
从铜片处获得较多电子的机会越②浓硝酸具有较强的
 转化为
转化为 。
。(3)对实验Ⅰ所得溶液呈绿色,而实验Ⅱ所得溶液呈蓝色的原因提出猜想。
查阅资料:ⅰ.
 溶于浓硝酸后呈黄色;
溶于浓硝酸后呈黄色;ⅱ.
 。
。 是弱酸,不稳定。
是弱酸,不稳定。猜想一:
 溶于浓硝酸,与蓝色
溶于浓硝酸,与蓝色 溶液混合而呈现绿色。
溶液混合而呈现绿色。猜想二:
 电离出的
电离出的 与
与 结合为
结合为 (绿色)。
(绿色)。①向浓硝酸中通入
 ,现象是
,现象是 溶液后呈绿色,证实猜想一合理。
溶液后呈绿色,证实猜想一合理。②研究猜想二是否为实验Ⅰ所得溶液呈绿色的主要原因,实验如下。

 的现象是
的现象是b.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想二不是实验Ⅰ所得溶液呈绿色的主要原因,说明理由:
您最近一年使用:0次
2022-07-10更新
|
763次组卷
|
3卷引用:重难点04 硫和氮综合题-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(北京专用)
(已下线)重难点04 硫和氮综合题-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(北京专用)北京朝阳区2021-2022学年高一下学期期末考试化学试题四川省成都石室蜀都中学2022-2023学年高一下学期期末考试化学试题
名校
解题方法
9 . 能用如下装置制取的气体是(夹持仪器略)
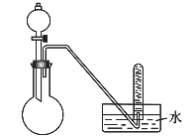
| A.MnO2、浓盐酸反应制取Cl2 | B.Cu、稀硝酸反应制取NO |
| C.Na2SO3、浓硫酸反应制取SO2 | D.Cu、浓硝酸反应制取NO2 |
您最近一年使用:0次
2022-05-26更新
|
101次组卷
|
2卷引用:北京市清华大学附属中学朝阳学校2023-2024学年高一下学期3月月考化学
名校
解题方法
10 . 铜与浓硫酸反应的装置如下图,下列说法不正确的是
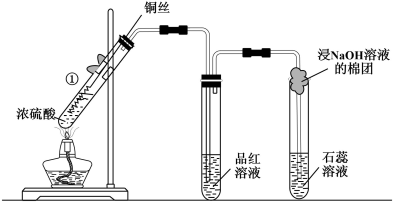
| A.反应一段时间后,品红溶液褪色,说明有SO2生成 |
| B.在该反应中,浓硫酸只表现出酸性 |
| C.石蕊溶液变红说明SO2与水发生了反应 |
| D.为确认CuSO4生成,试管①冷却后,将其中的物质缓慢倒入水中,观察颜色 |
您最近一年使用:0次
2022-01-14更新
|
434次组卷
|
3卷引用:北京市丰台区第二中学2024届高三下学期三模化学试题