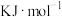名校
解题方法
1 . 利用煤化工的副产物甲醇 制丙烯
制丙烯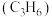 可缓解对石油的依赖。298K,100kPa下主反应为:
可缓解对石油的依赖。298K,100kPa下主反应为:
(1)在298K,100kPa下,由元素最稳定的单质生成1mol物质时的热效应叫做标准生成焓 。几种物质的标准生成焓
。几种物质的标准生成焓 数据如下:
数据如下:
则主反应的
___________  。
。
(2)450℃时,各物质均为气体,向容积为 的恒容密闭容器中通入
的恒容密闭容器中通入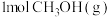 仅发生主反应,10min后达到平衡,此时容器中
仅发生主反应,10min后达到平衡,此时容器中 ,则10min内反应速率
,则10min内反应速率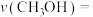
___________  ,该反应平衡常数K=
,该反应平衡常数K=___________ 。
(3)铝硅分子筛(表示为HAlSiO)催化 生成
生成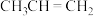 的机理如图:
的机理如图:
b.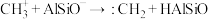
c.
①反应a中生成的 会继续参与反应生成某中性有机物,其结构简式为
会继续参与反应生成某中性有机物,其结构简式为___________ 。
②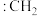 称为卡宾,有两种结构,如下图A、B所示,C原子采用
称为卡宾,有两种结构,如下图A、B所示,C原子采用 杂化的是
杂化的是___________ ,请利用电子排布规律判断基态时结构更为稳定___________ (填字母代号)。___________ ,温度超过450℃后,丙烯选择性降低的原因是___________ 。
 制丙烯
制丙烯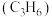 可缓解对石油的依赖。298K,100kPa下主反应为:
可缓解对石油的依赖。298K,100kPa下主反应为:
(1)在298K,100kPa下,由元素最稳定的单质生成1mol物质时的热效应叫做标准生成焓
 。几种物质的标准生成焓
。几种物质的标准生成焓 数据如下:
数据如下: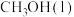 |  |  | |
 | -201.9 | -241.8 | 20.4 |

 。
。(2)450℃时,各物质均为气体,向容积为
 的恒容密闭容器中通入
的恒容密闭容器中通入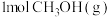 仅发生主反应,10min后达到平衡,此时容器中
仅发生主反应,10min后达到平衡,此时容器中 ,则10min内反应速率
,则10min内反应速率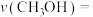
 ,该反应平衡常数K=
,该反应平衡常数K=(3)铝硅分子筛(表示为HAlSiO)催化
 生成
生成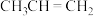 的机理如图:
的机理如图:

b.
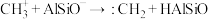
c.

①反应a中生成的
 会继续参与反应生成某中性有机物,其结构简式为
会继续参与反应生成某中性有机物,其结构简式为②
 称为卡宾,有两种结构,如下图A、B所示,C原子采用
称为卡宾,有两种结构,如下图A、B所示,C原子采用 杂化的是
杂化的是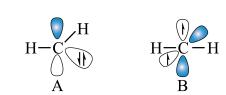
您最近一年使用:0次
名校
2 . 环己烯(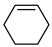 )是一种重要的化学试剂,主要用于有机合成和油类萃取。利用环己烷脱氢制备环己烯的反应原理如下。
)是一种重要的化学试剂,主要用于有机合成和油类萃取。利用环己烷脱氢制备环己烯的反应原理如下。


氧化脱氢:
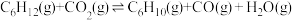

回答下列问题:
(1)已知几种化学键的键能数据如下表所示。
| 化学键 | H-H | C-H | C-C | C=C |
| 键能/(kJ·mol–1) | 436 | 413 | 348 | 615 |
(2)科技工作者结合实验与计算机模拟结果,研究环己烷直接脱氢制环己烯的反应历程(如图所示),其中吸附在催化剂表面的物种用*表示。
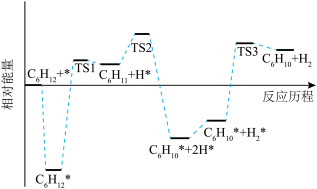
 的焓变小于零的原因是
的焓变小于零的原因是②
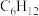 脱氢的速率
脱氢的速率 *脱氢的速率。
*脱氢的速率。③在恒容密闭容器中充入一定量的环己烷,其初始压强为p kPa,发生直接脱氢反应达到平衡时,环己烷的转化率为x,则反应I的标准平衡常数Kθ=
 gG(g)+hH(g),Kθ=
gG(g)+hH(g),Kθ= ,其中pθ=100 kPa,pG、pH、pD、pE为各组分的平衡分压]。
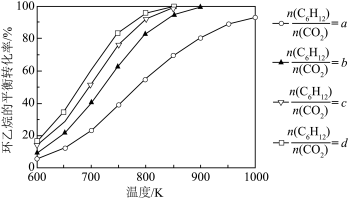
,其中pθ=100 kPa,pG、pH、pD、pE为各组分的平衡分压]。(3)在压强恒为p kPa的密闭容器中充入不同投料比的环己烷和CO2,在不同温度下达到平衡时,环己烷的转化率如下图所示,则a、b、c的大小关系为
您最近一年使用:0次
3 . 降低空气中二氧化碳的含量是当前研究热点,将二氧化碳转化为能源是缓解环境和能源问题的方案之一,二氧化碳和氢气在一定条件下可转化为甲烷,转化过程中发生的反应如下:
反应Ⅰ(主反应):

反应Ⅱ(副反应):

(1)甲烷与二氧化碳制备合成气的反应为 ,该反应的
,该反应的
___________ 。有利于反应Ⅰ自发进行的条件是___________ (填“高温”或“低温”)。
(2)在实际化工生产过程中,下列措施能提高 的转化效率的是
的转化效率的是___________ 。
a.在一定温度下,适当增大压强
b.总体积一定时,增大反应物 与
与 的体积比
的体积比
c.采用双温控制,前段加热,后段冷却
d.选取高效催化剂及增大催化剂的比表面积
(3) 催化加氢合成
催化加氢合成 的过程中,
的过程中, 活化的可能途径如图所示(“*”表示物质吸附在催化剂上),CO是
活化的可能途径如图所示(“*”表示物质吸附在催化剂上),CO是 活化的优势中间体,原因是
活化的优势中间体,原因是_______ 。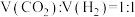 的投料比进行题干反应,平衡时
的投料比进行题干反应,平衡时 、
、 和CO在含碳物质中的体积分数
和CO在含碳物质中的体积分数 随温度T的变化如图所示。
随温度T的变化如图所示。___________ 。
②N点时反应Ⅱ的
___________ (以分压表示,物质的分压=总压×该物质的物质的量分数,结果保留至小数点后两位)。
(5)甲烷与二氧化碳的重整反应的Arrhenius经验公式的实验数据如图所示,已知Arrhenius经验公式为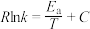 (
( 为活化能,k是温度为T时反应的速率常数,R和C都为常数),则该反应的活化能为
为活化能,k是温度为T时反应的速率常数,R和C都为常数),则该反应的活化能为_____  (用含x1、y1、x2、y2的式子表示)。
(用含x1、y1、x2、y2的式子表示)。
反应Ⅰ(主反应):


反应Ⅱ(副反应):


(1)甲烷与二氧化碳制备合成气的反应为
 ,该反应的
,该反应的
(2)在实际化工生产过程中,下列措施能提高
 的转化效率的是
的转化效率的是a.在一定温度下,适当增大压强
b.总体积一定时,增大反应物
 与
与 的体积比
的体积比c.采用双温控制,前段加热,后段冷却
d.选取高效催化剂及增大催化剂的比表面积
(3)
 催化加氢合成
催化加氢合成 的过程中,
的过程中, 活化的可能途径如图所示(“*”表示物质吸附在催化剂上),CO是
活化的可能途径如图所示(“*”表示物质吸附在催化剂上),CO是 活化的优势中间体,原因是
活化的优势中间体,原因是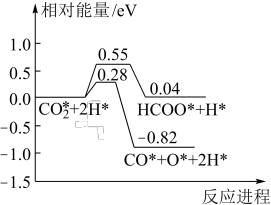
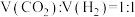 的投料比进行题干反应,平衡时
的投料比进行题干反应,平衡时 、
、 和CO在含碳物质中的体积分数
和CO在含碳物质中的体积分数 随温度T的变化如图所示。
随温度T的变化如图所示。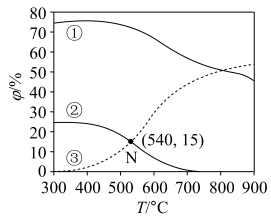
②N点时反应Ⅱ的

(5)甲烷与二氧化碳的重整反应的Arrhenius经验公式的实验数据如图所示,已知Arrhenius经验公式为
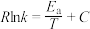 (
( 为活化能,k是温度为T时反应的速率常数,R和C都为常数),则该反应的活化能为
为活化能,k是温度为T时反应的速率常数,R和C都为常数),则该反应的活化能为 (用含x1、y1、x2、y2的式子表示)。
(用含x1、y1、x2、y2的式子表示)。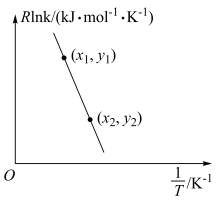
您最近一年使用:0次
名校
4 . 甲硫醇( )是重要的有机化工中间体,可用于合成维生素。通过
)是重要的有机化工中间体,可用于合成维生素。通过 和
和 合成
合成 的主要反应为:
的主要反应为:
I.
Ⅱ.
回答下列问题:
(1)计算反应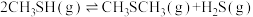 的
的
_______ kJ/mol。
(2) ℃时,向恒容密闭容器中充入一定量
℃时,向恒容密闭容器中充入一定量 和
和 发生反应,下列事实能说明反应达到平衡状态的是_______(填选项字母)。
发生反应,下列事实能说明反应达到平衡状态的是_______(填选项字母)。
(3) ℃时,向压强为
℃时,向压强为 的恒压密闭容器中按物质的量之比为1:2充入
的恒压密闭容器中按物质的量之比为1:2充入 和
和 发生反应,达到平衡时,
发生反应,达到平衡时, 的转化率为80%,
的转化率为80%, 的体积分数为5%。
的体积分数为5%。
①计算 的选择性为
的选择性为_______ ( 的选择性=
的选择性= )。
)。
②反应I的平衡常数 =
=_______ ( 是用分压表示的平衡常数,结果保留两位小数)。
是用分压表示的平衡常数,结果保留两位小数)。
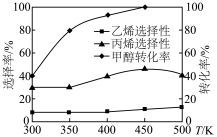
(4)在 反应压力为0.7Mpa条件下,气体按90mL/min的速率通过催化剂表面发生反应,每分钟反应体系中
反应压力为0.7Mpa条件下,气体按90mL/min的速率通过催化剂表面发生反应,每分钟反应体系中 转化率、
转化率、 选择性随温度的变化如图甲所示,催化机理如图乙所示。
选择性随温度的变化如图甲所示,催化机理如图乙所示。 分压表示的反应速率为
分压表示的反应速率为_______ Mpa/min(结果保留两位有效数字)。
②当温度高于370℃时, 转化率随温度升高而降低的原因可能为
转化率随温度升高而降低的原因可能为_______ 。
③从电负性的角度描述ⅲ→i中脱水的过程:_______ 。
 )是重要的有机化工中间体,可用于合成维生素。通过
)是重要的有机化工中间体,可用于合成维生素。通过 和
和 合成
合成 的主要反应为:
的主要反应为:I.

Ⅱ.

回答下列问题:
(1)计算反应
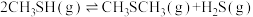 的
的
(2)
 ℃时,向恒容密闭容器中充入一定量
℃时,向恒容密闭容器中充入一定量 和
和 发生反应,下列事实能说明反应达到平衡状态的是_______(填选项字母)。
发生反应,下列事实能说明反应达到平衡状态的是_______(填选项字母)。| A.容器内气体密度不再发生变化 |
| B.混合气体的平均相对分子质量不再发生变化 |
C. 的体积分数不再发生变化 的体积分数不再发生变化 |
D. 和 和 的物质的量之比不再变化 的物质的量之比不再变化 |
(3)
 ℃时,向压强为
℃时,向压强为 的恒压密闭容器中按物质的量之比为1:2充入
的恒压密闭容器中按物质的量之比为1:2充入 和
和 发生反应,达到平衡时,
发生反应,达到平衡时, 的转化率为80%,
的转化率为80%, 的体积分数为5%。
的体积分数为5%。①计算
 的选择性为
的选择性为 的选择性=
的选择性= )。
)。②反应I的平衡常数
 =
= 是用分压表示的平衡常数,结果保留两位小数)。
是用分压表示的平衡常数,结果保留两位小数)。(4)在
 反应压力为0.7Mpa条件下,气体按90mL/min的速率通过催化剂表面发生反应,每分钟反应体系中
反应压力为0.7Mpa条件下,气体按90mL/min的速率通过催化剂表面发生反应,每分钟反应体系中 转化率、
转化率、 选择性随温度的变化如图甲所示,催化机理如图乙所示。
选择性随温度的变化如图甲所示,催化机理如图乙所示。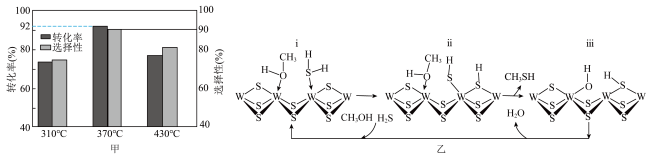
 分压表示的反应速率为
分压表示的反应速率为②当温度高于370℃时,
 转化率随温度升高而降低的原因可能为
转化率随温度升高而降低的原因可能为③从电负性的角度描述ⅲ→i中脱水的过程:
您最近一年使用:0次
名校
5 . 血红蛋白(Hb)和肌红蛋白(Mb)分别存在于血液和肌肉中,都能与氧气结合,与氧气的结合度α(吸附 的Hb或Mb的量占总Hb或Mb的量的比值)和氧气分压
的Hb或Mb的量占总Hb或Mb的量的比值)和氧气分压 密切相关。请回答下列问题:
密切相关。请回答下列问题:
(1)人体中的血红蛋白(Hb)能吸附 、
、 ,相关反应的热化学方程式及平衡常数如下:
,相关反应的热化学方程式及平衡常数如下:
Ⅰ.


Ⅱ.


Ⅲ.
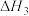

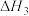 =
=___________ (用 、
、 表示),
表示), =
=___________ (用 、
、 表示)。
表示)。
(2)Hb与氧气的结合能力受到 的影响,相关反应如下:
的影响,相关反应如下: 。37℃,pH分别为7.2、7.4、7.6时氧气分压
。37℃,pH分别为7.2、7.4、7.6时氧气分压 与达到平衡时Hb与氧气的结合度α的关系如图所示,pH=7.6时对应的曲线为
与达到平衡时Hb与氧气的结合度α的关系如图所示,pH=7.6时对应的曲线为___________ (填“A”或“B”)。 ,37℃,氧气分压
,37℃,氧气分压 与达平衡时Mb与氧气的结合度α的关系如图所示。
与达平衡时Mb与氧气的结合度α的关系如图所示。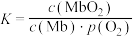 ,计算37℃时K=
,计算37℃时K=________  。
。
②人正常呼吸时,体温约为37℃,氧气分压约为20.00kPa,计算此时Mb与氧气的最大结合度为___________ (结果精确到0.1%)。
③经测定,体温升高,Mb与氧气的结合度降低,则该反应的
___________ (填“>”或“<”)0。
(4)人体酸碱平衡维持机制简要表达如下图: 会
会___________ (选填“增加”或“减少”)。
②对于重度代谢性酸中毒的病人应该采用什么治疗方法___________ 。(选填字母)
A.口服0.9%KCl溶液 B.口服5%葡萄糖溶液
C.静脉注射5% 溶液 D.静脉注射0.9%NaCl
溶液 D.静脉注射0.9%NaCl
 的Hb或Mb的量占总Hb或Mb的量的比值)和氧气分压
的Hb或Mb的量占总Hb或Mb的量的比值)和氧气分压 密切相关。请回答下列问题:
密切相关。请回答下列问题:(1)人体中的血红蛋白(Hb)能吸附
 、
、 ,相关反应的热化学方程式及平衡常数如下:
,相关反应的热化学方程式及平衡常数如下:Ⅰ.



Ⅱ.



Ⅲ.

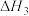

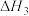 =
= 、
、 表示),
表示), =
= 、
、 表示)。
表示)。(2)Hb与氧气的结合能力受到
 的影响,相关反应如下:
的影响,相关反应如下: 。37℃,pH分别为7.2、7.4、7.6时氧气分压
。37℃,pH分别为7.2、7.4、7.6时氧气分压 与达到平衡时Hb与氧气的结合度α的关系如图所示,pH=7.6时对应的曲线为
与达到平衡时Hb与氧气的结合度α的关系如图所示,pH=7.6时对应的曲线为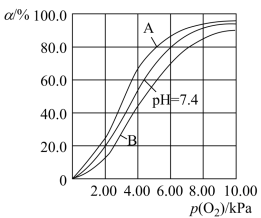
 ,37℃,氧气分压
,37℃,氧气分压 与达平衡时Mb与氧气的结合度α的关系如图所示。
与达平衡时Mb与氧气的结合度α的关系如图所示。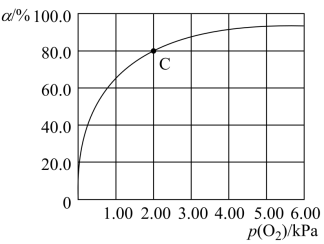
 ,计算37℃时K=
,计算37℃时K= 。
。②人正常呼吸时,体温约为37℃,氧气分压约为20.00kPa,计算此时Mb与氧气的最大结合度为
③经测定,体温升高,Mb与氧气的结合度降低,则该反应的

(4)人体酸碱平衡维持机制简要表达如下图:

 会
会②对于重度代谢性酸中毒的病人应该采用什么治疗方法
A.口服0.9%KCl溶液 B.口服5%葡萄糖溶液
C.静脉注射5%
 溶液 D.静脉注射0.9%NaCl
溶液 D.静脉注射0.9%NaCl
您最近一年使用:0次
解题方法
6 . 环己烯( )是一种重要的化学试剂,主要用于有机合成和油类萃取。利用环己烷脱氢制备环己烯的反应原理如下。
)是一种重要的化学试剂,主要用于有机合成和油类萃取。利用环己烷脱氢制备环己烯的反应原理如下。


氧化脱氢:


回答下列问题:
(1)已知几种化学键的键能数据如下表所示。
| 化学键 | H-H | C-H | C-C |  |
键能/(kJ | 436 | 413 | 348 | 615 |
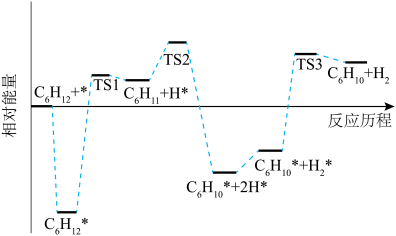
①
 的焓变小于零的原是
的焓变小于零的原是②
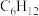 脱氢的速率
脱氢的速率 *脱氢的速率。
*脱氢的速率。③环己烷脱氢制备环己烯的副产物可能有
④在恒容密闭容器中充入一定量的环己烷,其初始压强为p
 ,发生直接脱氢反应达到平衡时,环己烷的转化率为x,则反应I的标准平衡常数Kθ=
,发生直接脱氢反应达到平衡时,环己烷的转化率为x,则反应I的标准平衡常数Kθ= ,Kθ=
,Kθ= ,其中pθ=100kPa,pG、pH、pD、pE为各组分的平衡分压]。
,其中pθ=100kPa,pG、pH、pD、pE为各组分的平衡分压]。(3)在压强恒为
 的密闭容器中充入不同投料比的环己烷和CO2,在不同温度下达到平衡时,环己烷的转化率如下图所示,则a、b、c的大小关系为
的密闭容器中充入不同投料比的环己烷和CO2,在不同温度下达到平衡时,环己烷的转化率如下图所示,则a、b、c的大小关系为 
您最近一年使用:0次
2024-06-04更新
|
116次组卷
|
4卷引用:湖北省普通高中2024届高三下学期高考押题预测卷化学试题
7 . 将CO或CO2转化为高附加值化学品是颇具前景的合成路线。
(1)工业上用CO2和H2反应合成二甲醚。
已知:
 ;
;

 。
。
写出 和
和 转化为
转化为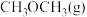 和
和 的热化学方程式:
的热化学方程式:_______________ ,该反应在________ (填“高温”或“低温”)条件下能自发进行。
(2)CO2催化加氢合成乙醇的反应原理为
 ,设m为起始时的投料比,即
,设m为起始时的投料比,即 。
。________________ 。
②图1右图表示在总压为5MPa的恒压条件下,且m=3时,平衡状态下各物质的物质的量分数与温度的关系,则曲线d代表的物质为________ (填化学式)。
(3)一种利用焦炉气中的H2和工业废气捕获的CO2生产绿色燃料甲醇的原理为 、
、 。
。
在研究该反应历程时发现,反应气中水蒸气含量会影响CH3OH的产率。为了研究水分子对该反应机制的内在影响,科学家利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响,如图3所示(吸附在催化剂表面上的物种用*标注)。________________ 。
②资料显示:水也可以使催化剂活化点位减少。结合资料、上图及学过的知识推测,在反应气中添加水蒸气将如何影响甲醇产率及产生这种影响的原因:________________ (任答两点)。
(4)一定条件下,利用CO2和H2还可制得甲烷: ,主要副反应为
,主要副反应为 。一定温度下,向恒容密闭容器中充入CO2和H2(物质的量之比为1:4)发生反应,容器内气体的压强随时间的变化如表所示:
。一定温度下,向恒容密闭容器中充入CO2和H2(物质的量之比为1:4)发生反应,容器内气体的压强随时间的变化如表所示:
①用单位时间内气体分压的变化表示反应 的速率,则前120min内CH4的平均反应速率
的速率,则前120min内CH4的平均反应速率
________ 。
②该温度下,平衡时CO的体积分数为8%,反应 的平衡常数
的平衡常数
________ ( 为以分压表示的平衡常数,保留小数点后2位)。
为以分压表示的平衡常数,保留小数点后2位)。
(1)工业上用CO2和H2反应合成二甲醚。
已知:

 ;
;
 。
。写出
 和
和 转化为
转化为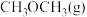 和
和 的热化学方程式:
的热化学方程式:(2)CO2催化加氢合成乙醇的反应原理为

 ,设m为起始时的投料比,即
,设m为起始时的投料比,即 。
。
②图1右图表示在总压为5MPa的恒压条件下,且m=3时,平衡状态下各物质的物质的量分数与温度的关系,则曲线d代表的物质为
(3)一种利用焦炉气中的H2和工业废气捕获的CO2生产绿色燃料甲醇的原理为
 、
、 。
。在研究该反应历程时发现,反应气中水蒸气含量会影响CH3OH的产率。为了研究水分子对该反应机制的内在影响,科学家利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响,如图3所示(吸附在催化剂表面上的物种用*标注)。
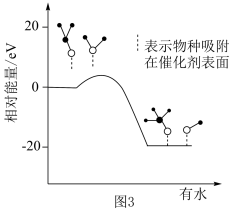
②资料显示:水也可以使催化剂活化点位减少。结合资料、上图及学过的知识推测,在反应气中添加水蒸气将如何影响甲醇产率及产生这种影响的原因:
(4)一定条件下,利用CO2和H2还可制得甲烷:
 ,主要副反应为
,主要副反应为 。一定温度下,向恒容密闭容器中充入CO2和H2(物质的量之比为1:4)发生反应,容器内气体的压强随时间的变化如表所示:
。一定温度下,向恒容密闭容器中充入CO2和H2(物质的量之比为1:4)发生反应,容器内气体的压强随时间的变化如表所示:时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 100 | 93.8 | 88.0 | 83.4 | 79.4 | 75.0 | 75.0 |
 的速率,则前120min内CH4的平均反应速率
的速率,则前120min内CH4的平均反应速率
②该温度下,平衡时CO的体积分数为8%,反应
 的平衡常数
的平衡常数
 为以分压表示的平衡常数,保留小数点后2位)。
为以分压表示的平衡常数,保留小数点后2位)。
您最近一年使用:0次
2024-06-04更新
|
123次组卷
|
3卷引用:湖北省十堰市2024届高三下学期第三次模拟化学试题
名校
解题方法
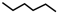
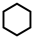
8 . 某研究小组试探究1,6-己二硫醇(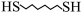 ,用HDT表示)与铜的反应历程。已知有下列反应:
,用HDT表示)与铜的反应历程。已知有下列反应:
 .
.
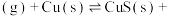

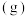

 .
.
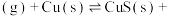
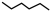
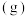

 .
.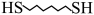


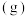

 .
.
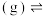
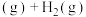

 ,写出两种提高己烷平衡转化率的措施
,写出两种提高己烷平衡转化率的措施| 化学键 |  |  |  |
键能 | 413 | 347 | 436 |
(2)温度一定时,在隔绝空气的条件下使HDT(g)以恒定的流速通过如甲图所示的反应器,仅发生反应
 、
、 、
、 ,在反应器出口处实时检测各物质的相对含量如图乙所示。
,在反应器出口处实时检测各物质的相对含量如图乙所示。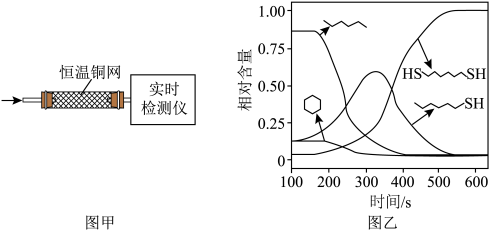
 、
、 、
、 的速率均
的速率均 达平衡。
达平衡。②推测
 在该实验条件下与Cu反应生成烃类产物的名称为
在该实验条件下与Cu反应生成烃类产物的名称为(3)向恒温刚性容器M中充入己烷(g)和HDT(g),初始总压为2.5Pa,己烷的体积分数为80%。容器M中只发生反应
 ,达平衡时,己烷的转化率为50%,则反应
,达平衡时,己烷的转化率为50%,则反应 的
的
 、
、 和
和 。将反应后的混合气全部充回容器M内,反应
。将反应后的混合气全部充回容器M内,反应 重新达到平衡时,p(己烷)/p(环己烷)=1.1,则HDT的完全脱硫率为
重新达到平衡时,p(己烷)/p(环己烷)=1.1,则HDT的完全脱硫率为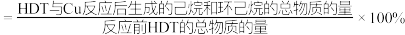 )
)
您最近一年使用:0次
名校
9 . 某研究小组试探究1,6-己二硫醇(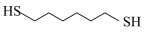 ,用HDT表示)与铜的反应历程。
,用HDT表示)与铜的反应历程。
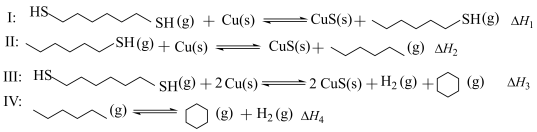
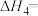
化学键 | C-H | C-C | H-H |
键能/ | 413 | 347 | 436 |
(2)温度一定时,在隔绝空气的条件下使HDT(g)以恒定的流速通过如甲图所示的反应器,仅发生反应Ⅰ、Ⅱ、Ⅲ,在反应器出口处实时检测各物质的相对含量如图乙所示。
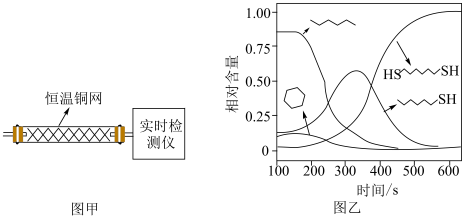
②推测
 在该实验条件下与Cu反应生成烃类产物的名称为
在该实验条件下与Cu反应生成烃类产物的名称为(3)向恒温刚性容器M中充入己烷(g)和HDT(g),初始总压为2.5Pa,己烷的体积分数为80%。容器M中只发生反应Ⅳ,达平衡时,己烷的转化率为50%,则反应Ⅳ的

(
 )
)
您最近一年使用:0次
2024-05-30更新
|
98次组卷
|
2卷引用:湖北省黄冈中学2024届高三下学期5月第三次模拟考试化学试题
解题方法
10 . 近日,科学家开发新型催化剂实现 对C4馏分中2-丁烯的气相选择性氧化,反应原理如下:
对C4馏分中2-丁烯的气相选择性氧化,反应原理如下:
反应l:
反应2:
(1) 的空间构型为
的空间构型为___________ 。
(2)在特定温度下,由稳定态单质生成lmol化合物的焓变叫该物质在此温度下的标准生成焓( )。稳定态单质的标准生成焓为0kJ/mol,下表为几种化合物在298K的标准生成焓数据:
)。稳定态单质的标准生成焓为0kJ/mol,下表为几种化合物在298K的标准生成焓数据:

___________ kJ/mol。
(3)某温度下,向恒压密闭容器中充入 和
和 ,发生上述反应1和反应2,测得平衡体系中
,发生上述反应1和反应2,测得平衡体系中 的体积分数与起始投料比
的体积分数与起始投料比 的关系如下图所示,
的关系如下图所示, 体积分数最大值小于50%的原因是
体积分数最大值小于50%的原因是___________ 。 (R、C为常数,T为热力学温度,k为速率常数,
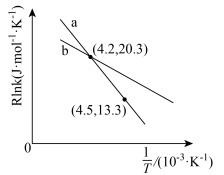
(R、C为常数,T为热力学温度,k为速率常数, 为活化能)。测得反应1在不同条件下,Rlnk与温度的倒数关系如图所示,在a条件下,该反应的活化能
为活化能)。测得反应1在不同条件下,Rlnk与温度的倒数关系如图所示,在a条件下,该反应的活化能
___________ kJ/mol,当改变外界条件时,实验数据如图中的曲线b所示,则实验改变的外界条件可能是___________ 。 ,发生上述反应,测得2-丁烯的平衡转化率与温度、压强的关系如上图所示,X点时丁酮的选择性为
,发生上述反应,测得2-丁烯的平衡转化率与温度、压强的关系如上图所示,X点时丁酮的选择性为 ,
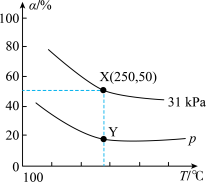
,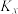 是以物质的量分数表示的平衡常数,则反应2在Y点的物质的量分数平衡常数
是以物质的量分数表示的平衡常数,则反应2在Y点的物质的量分数平衡常数
___________ (用分数表示)。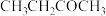 的选择性
的选择性 ]
]
(6)以熔融碳酸盐(如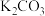 )为电解质,丁烯(
)为电解质,丁烯( )/空气燃料电池的能量转化率较高。电池总反应为
)/空气燃料电池的能量转化率较高。电池总反应为 ,则负极的电极方程式为
,则负极的电极方程式为___________ 。
 对C4馏分中2-丁烯的气相选择性氧化,反应原理如下:
对C4馏分中2-丁烯的气相选择性氧化,反应原理如下:反应l:

反应2:

(1)
 的空间构型为
的空间构型为(2)在特定温度下,由稳定态单质生成lmol化合物的焓变叫该物质在此温度下的标准生成焓(
 )。稳定态单质的标准生成焓为0kJ/mol,下表为几种化合物在298K的标准生成焓数据:
)。稳定态单质的标准生成焓为0kJ/mol,下表为几种化合物在298K的标准生成焓数据:| 物质 |  | 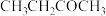 |  |  |
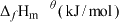 | a | b | c | d |

(3)某温度下,向恒压密闭容器中充入
 和
和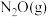 ,发生上述反应1和反应2,测得平衡体系中
,发生上述反应1和反应2,测得平衡体系中 的体积分数与起始投料比
的体积分数与起始投料比 的关系如下图所示,
的关系如下图所示, 体积分数最大值小于50%的原因是
体积分数最大值小于50%的原因是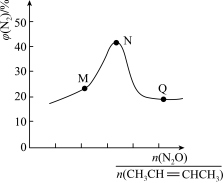
 (R、C为常数,T为热力学温度,k为速率常数,
(R、C为常数,T为热力学温度,k为速率常数, 为活化能)。测得反应1在不同条件下,Rlnk与温度的倒数关系如图所示,在a条件下,该反应的活化能
为活化能)。测得反应1在不同条件下,Rlnk与温度的倒数关系如图所示,在a条件下,该反应的活化能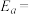
 ,发生上述反应,测得2-丁烯的平衡转化率与温度、压强的关系如上图所示,X点时丁酮的选择性为
,发生上述反应,测得2-丁烯的平衡转化率与温度、压强的关系如上图所示,X点时丁酮的选择性为 ,
,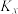 是以物质的量分数表示的平衡常数,则反应2在Y点的物质的量分数平衡常数
是以物质的量分数表示的平衡常数,则反应2在Y点的物质的量分数平衡常数
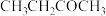 的选择性
的选择性 ]
](6)以熔融碳酸盐(如
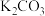 )为电解质,丁烯(
)为电解质,丁烯( )/空气燃料电池的能量转化率较高。电池总反应为
)/空气燃料电池的能量转化率较高。电池总反应为 ,则负极的电极方程式为
,则负极的电极方程式为
您最近一年使用:0次