名校
解题方法
1 . 下列说法正确的是( )
| A.HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的中和热ΔH=2×(-57.3) kJ/mol |
| B.CO(g)的燃烧热是ΔH=-283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+2×283.0 kJ/mol |
| C.101kPa时,1mol碳燃烧所放出的热量为碳的燃烧热 |
| D.反应物所具有的总能量小于生成物所具有的总能量时,△H<0 |
您最近一年使用:0次
2020-04-29更新
|
147次组卷
|
6卷引用:陕西省白河高级中学2020-2021学年高一下学期期中考试化学试题
解题方法
2 . 标准状况下将1 L纯净的CH4在空气中完全燃烧,生成CO2和液态水,放出39.75 kJ热量,则燃烧的热化学方程式为( )
| A.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-39.75 kJ/mol |
| B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=890.4 kJ/mol |
| C.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.4 kJ/mol |
| D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=39.75 kJ/mol |
您最近一年使用:0次
2020-04-29更新
|
109次组卷
|
4卷引用:陕西省西安市蓝田县大联考2022-2023学年高一下学期4月期中化学试题
陕西省西安市蓝田县大联考2022-2023学年高一下学期4月期中化学试题辽宁省凌源市第三中学2019-2020学年高二下学期第三次线上月考化学试题(已下线)1.2 燃烧热 能源(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)1.2+燃烧热++能源-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)
3 . 下列选项中说明乙醇作为燃料的优点是( )
①燃烧时发生氧化反应 ②燃烧时放出大量的热量 ③充分燃烧的产物不污染环境 ④乙醇是一种可再生能源
①燃烧时发生氧化反应 ②燃烧时放出大量的热量 ③充分燃烧的产物不污染环境 ④乙醇是一种可再生能源
| A.①②③ | B.①②④ |
| C.①③④ | D.②③④ |
您最近一年使用:0次
2020-03-06更新
|
348次组卷
|
22卷引用:2011-2012学年陕西省岐山县高一下学期期中考试化学试卷
(已下线)2011-2012学年陕西省岐山县高一下学期期中考试化学试卷(已下线)2010-2011学年内蒙古赤峰二中高一下学期期中考试化学试卷(已下线)2011~2012学年广东省汕头市金山中学高二期中考试化学(文)试卷(已下线)2011-2012学年吉林省吉林一中高二下学期期中考试化学试卷(已下线)2014-2015学年湖南省娄底市高二上学期期中联考化学试卷2014-2015学年云南省富民县一中高二上学期期中化学试卷2015-2016学年贵州凯里一中高一下期中文科化学试卷广东省茂名市高州中学2023-2024学年高一下学期期中考试化学(合格考)试题(已下线)吉林一中2009—2010学年上学期期末高二(化学)试题(已下线)2011-2012学年湖南省望城县第一中学高二上学期期末质量检测化学试卷(已下线)2012-2013年江苏南京学大教育专修学校高二3月月考化学试卷(已下线)四川省成都市成都七中实验学校2012-2013学年高一3月月考化学试卷2014-2015学年浙江省江山实验中学高二4月教学质量检测化学试卷2015-2016学年福建省长泰县第一中学高二上学期期末化学试卷广东省深圳市耀华实验学校2018-2019学年高二上学期第一次月考化学试题福建省永安市第十二中学2018-2019学年高二下学期3月月考化学试题百所名校联考-选修四模块综合检测(已下线)2019年8月28日 《每日一题》人教选修4——能源云南省曲靖市师宗县第二中学2019-2020学年高二上学期期末考试化学试题安徽省淮北市第一中学2020年人教版必修2第二章第一节课时2《化学能与热能的相互转化》 同步测试广东省2020年普通高中学业水平考试化学合格性考试模拟试题(六)吉林省大安市第六中学2019-2020学年高二下学期期末考试化学(理)试题
14-15高二上·黑龙江佳木斯·开学考试
名校
4 . 已知:(1)H2O(g)=H2O(l) △H1=-Q1kJ/mol
(2)CH3OH(g)=CH3OH(l) △H2=-Q2kJ/mol
(3)2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) △H3=-Q3kJ/mol
Q1、Q2、Q3均大于0.若要使32g液态甲醇完全燃烧并恢复到室温,放出的热量为( )
(2)CH3OH(g)=CH3OH(l) △H2=-Q2kJ/mol
(3)2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) △H3=-Q3kJ/mol
Q1、Q2、Q3均大于0.若要使32g液态甲醇完全燃烧并恢复到室温,放出的热量为( )
| A.Q1+Q2+Q3 | B.5Q3+Q2-2Q1 |
| C.0.5Q3-Q2+2Q1 | D.0.5(Q1+Q2+Q3) |
您最近一年使用:0次
2020-02-13更新
|
73次组卷
|
6卷引用:2015-2016学年陕西省西安第七十中学高二上学期期中测试化学试卷
5 . 甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)=2H2O(l) △H1=-571.8kJ· mol-1
②CH3OH(g)+ O2(g)=CO2(g)+2H2(g) △H=-192.9 kJ· mol-1
O2(g)=CO2(g)+2H2(g) △H=-192.9 kJ· mol-1
(1)甲醇蒸汽完全燃烧的热化学方程式为_____________ 。
(2)反应②中的能量变化如下图所示,则△H2=______ (用E1和E2表示)。

(3)H2(g)的燃烧热为__________ kJ· mol-1。
(4)请你分析H2(g)作为能源比甲醇蒸汽作为能源的优点:__________________ (写出一点)
①2H2(g)+O2(g)=2H2O(l) △H1=-571.8kJ· mol-1
②CH3OH(g)+
 O2(g)=CO2(g)+2H2(g) △H=-192.9 kJ· mol-1
O2(g)=CO2(g)+2H2(g) △H=-192.9 kJ· mol-1(1)甲醇蒸汽完全燃烧的热化学方程式为
(2)反应②中的能量变化如下图所示,则△H2=

(3)H2(g)的燃烧热为
(4)请你分析H2(g)作为能源比甲醇蒸汽作为能源的优点:
您最近一年使用:0次
2020-01-12更新
|
182次组卷
|
8卷引用:陕西省西安市第26中2017-2018学年第一学期高二期中考试化学试卷.
6 . 下列依据热化学方程式得出的结论正确的是( )
| A.已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1 |
| B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3 kJ |
| C.已知2C(s)+2O2(g)=2CO2(g) ΔH=a 2C(s)+O2(g)=2CO(g) ΔH=b,则a>b |
| D.已知P4(白磷,s)=4P(红磷,s) ΔH<0,则白磷比红磷稳定 |
您最近一年使用:0次
2019-12-24更新
|
507次组卷
|
7卷引用:陕西省渭南韩城市2019-2020学年高二上学期期中考试化学试题
7 . 下列图示关系不正确的是( )
A.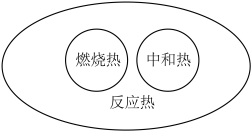 | B.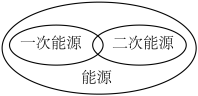 |
C.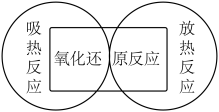 | D.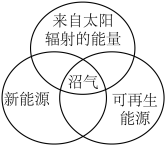 |
您最近一年使用:0次
2019-12-07更新
|
516次组卷
|
19卷引用:陕西省西安中学2016-2017学年高一(实验班)下学期期中考试化学试题
陕西省西安中学2016-2017学年高一(实验班)下学期期中考试化学试题(已下线)2013-2014学年江西省景德镇市高二上学期期中质量检测理科化学试卷陕西省西安市远东第一中学2018-2019学年高二上学期10月月考化学试题福建省莆田九中2019-2020学年高二上学期期中考试化学试题广东省珠海市北京师范大学珠海分校附属外国语学校2020-2021学年高二上学期期中考试化学试题(A卷)青海省海西蒙古族藏族自治州德令哈市海西州高级中学2020-2021学年高二上学期期中考试化学试题宁夏永宁县永宁中学2021-2022学年高二上学期期中考试化学试题宁夏青铜峡市宁朔中学2022-2023学年高二上学期期中考试化学试题(已下线)2013-2014江西省鹰潭市下学期期末质量检测高一化学试卷2014-2015学年贵州省习水县第一中学高一下学期期末考试化学试卷2016届河南省西华县第一高级中学高三上学期10月联考化学试卷2016-2017学年山东省枣庄二中高二第二次月考化学试卷宁夏银川一中2017-2018学年高二上学期第二次月考理综化学试题2020届高三化学二轮冲刺新题专练——化学与STSE考查河北省石家庄市第二中学2019-2020学年高一下学期4月月考化学试题河北省唐山市海港高级中学2019-2020学年高一下学期第五次校考化学试题四川省新津中学2020-2021学年高二10月月考化学试题辽宁省实验中学东戴河分校2020-2021学年高二10月月考化学试题河南省汤阴县五一中学2019-2020学年高一下学期第四次月考化学试题
名校
解题方法
8 . 1g氢气在氧气中燃烧生成液态水,放出142.9kJ的热量,表示该反应的热化学方程式是( )
A.H2(g)+1/2O2(g) H2O(l) ΔH=-285.8kJ·mol-1 H2O(l) ΔH=-285.8kJ·mol-1 |
B.H2(g)+1/2O2(g) H2O(g) ΔH=-285.8kJ·mol-1 H2O(g) ΔH=-285.8kJ·mol-1 |
C.2H2(g)+O2(g) 2H2O(l) ΔH=-285.8kJ·mol-1 2H2O(l) ΔH=-285.8kJ·mol-1 |
D.H2+1/2O2 H2O ΔH=-285.8kJ·mol-1 H2O ΔH=-285.8kJ·mol-1 |
您最近一年使用:0次
2019-12-02更新
|
75次组卷
|
4卷引用:陕西省黄陵中学2019-2020学年高二上学期期中考试化学试题
解题方法
9 . 在 25℃、101kPa 下,依据事实写出下列反应的热化学方程式。
(1)1g 乙醇燃烧生成CO2和液态水时放热 29.7kJ。则表示乙醇燃烧热的热化学方程式为_____ ;
(2)已知拆开 1mol H﹣H 键,1molN﹣H 键,1molN≡N 键分别需要的能量是 436kJ、391kJ、946kJ,则 N2 与H2 反应生成 NH3 的热化学方程式为________________ ;若适量的 N2 和O2 完全反应,每生成 23 克 NO2 需要吸收 16.95kJ 热量。则其热化学方程式为:_____ ;已知 AX3 的熔点和沸点分别为-93.6 ℃和 76℃,AX5 的熔点为 167 ℃。室温时 AX3与气体 X2 反应生成 1 mol AX5,放出热量 123.8 kJ。该反应的热化学方程式为:__________
(1)1g 乙醇燃烧生成CO2和液态水时放热 29.7kJ。则表示乙醇燃烧热的热化学方程式为
(2)已知拆开 1mol H﹣H 键,1molN﹣H 键,1molN≡N 键分别需要的能量是 436kJ、391kJ、946kJ,则 N2 与H2 反应生成 NH3 的热化学方程式为
您最近一年使用:0次
名校
解题方法
10 . 下列关于反应能量的说法正确的是 ( )
| A.101kPa 时,2H2(g)+O2(g)=2H2O(l)△H=﹣571.6 kJ•mol﹣1,H2 的燃烧热为 571.6 kJ•mol﹣1 |
| B.相同条件下,如果 1molH 所具有的能量为 E1,1molH2 所具有的能量为 E2,则 2 E1=E2 |
| C.H+(aq)+OH﹣(aq)=H2O(l) △H=﹣57.3 kJ•mol﹣1,含 1molNaOH 的氢氧化钠的溶液与含 0.5molH2SO4 的浓硫酸混合后放出 57.3kJ 的热量 |
| D.Zn(s)+CuSO4(aq)=ZnSO4 (aq)+Cu(s)△H=﹣216 kJ•mol﹣1,反应物总能量> 生成物总能量 |
您最近一年使用:0次
2019-11-26更新
|
144次组卷
|
2卷引用:陕西省西安电子科技大学附属中学2019-2020学年高二上学期期中考试化学(理)试题



