解题方法
1 . 下列有关化学反应表示正确的是
A.用稀硝酸溶解银镜: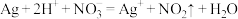 |
B.铜溶于氨水和过氧化氢的混合溶液: |
C. 燃烧热的热化学方程式: 燃烧热的热化学方程式: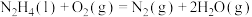 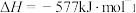 |
D.尿素与甲醛制备线型脲醛树脂: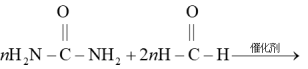 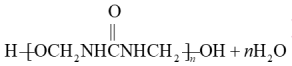 |
您最近一年使用:0次
2024-03-24更新
|
160次组卷
|
2卷引用:江西省南昌市2024届高三第一次模拟测试化学试卷
名校
解题方法
2 . 下列说法中正确的是
A.若 2NO2(g) N2O4(g) ∆H =+56.9kJ·mol-1 ,则 N2O4(g) ∆H =+56.9kJ·mol-1 ,则 置于密闭容器中充分反应吸收的热量为56.9kJ 置于密闭容器中充分反应吸收的热量为56.9kJ |
B.表示中和热的热化学方程式: |
| C.在稀溶液中,强酸与强碱反应的中和热为ΔH=-57.3kJ·mol-1,若将含有0.5mol H2SO4的浓硫酸和含有1molNaOH的溶液混合,放出的热量大于57.3kJ |
| D.H2(g)的燃烧热是285.8kJ·mol-1,则2H2O(g)=2H2(g)+O2(g) ∆H =+571.6kJ·mol-1 |
您最近一年使用:0次
2022-11-02更新
|
167次组卷
|
2卷引用:江西省鄱阳县第一中学2023届高三一模化学试题
名校
解题方法
3 . 下列热化学方程式中,ΔH能正确表示物质的燃烧热的是
A.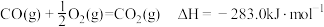 |
B.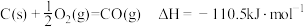 |
C.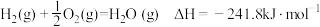 |
D. |
您最近一年使用:0次
2022-03-14更新
|
778次组卷
|
79卷引用:【校级联考】江西省南昌市八一中学、洪都中学2018-2019学年高二上学期10月联考化学试题
【校级联考】江西省南昌市八一中学、洪都中学2018-2019学年高二上学期10月联考化学试题(已下线)2011-2012学年江西省兴国县将军中学高二上学期期中考试化学试卷(已下线)2014陕西省西安中学高三上学期第三次质量检测化学试卷江西省靖安中学2020-2021学年高二上学期第二次月考化学试题江西省南昌市知行中学2021-2022学年高二上学期期中化学试题(已下线)2010年河北省唐山一中高二上学期期中考试化学卷(已下线)2011-2012天津南开中学高二第一学期期中考试理科化学试卷(已下线)2011-2012学年安徽省六安三中高二上学期期末考试化学A卷(已下线)2012-2013学年海南省农垦加来中学高二第一次月考化学试卷(已下线)2013-2014湖北省黄石市秋季高二化学期中统考试卷2015-2016学年山西太原五中高二上第一周考理科化学试卷2015-2016学年吉林省汪清县第六中学高二上学期9月月考化学试卷2015-2016学年安徽省郎溪中学高二上学期第一次月考化学试卷2015-2016学年吉林省汪清中学高二上学期第二次月考化学试卷2015-2016学年广西南宁市八中高二下学期期中段考化学试卷2016-2017学年吉林省汪清六中高二上学期期中化学试卷2016-2017学年陕西省宝鸡市岐山县高二上期中理化学卷2016-2017学年四川省乐山市高二上学期教学质检化学试卷2017届河北省八所重点中学高三下学期第一次联考化学试卷湖北省孝感市七校教学联盟2016-2017学年高二下学期期末考试化学试题甘肃省兰州第一中学2017-2018学年高二上学期第一次月考(9月)化学试题黑龙江省哈尔滨市第三中学2018届高三上学期第一次验收考试化学试题云南省德宏州芒市第一中学2017-2018学年高二上学期期中考试化学试题河北省邯郸市第二中学2017-2018学年高二上学期期中考试化学试题天津市红桥区2017-2018学年高二上学期期中考试化学试题广东省东莞市七校2017-2018学年高二上学期期中联考化学试题四川省乐山沫若中学2017-2018学年高二上学期第二次月考(12月)化学试题青海省西宁市第四高级中学2017-2018学年高二上学期期末考试化学试题河北省石家庄市鹿泉一中2017-2018学年高二3月月考化学试题河南省鹤壁市淇滨高级中学2018-2019学年高二上学期第一次月考化学试题陕西省蓝田县焦岱中学2018-2019学年高二上学期第一次月考化学试题吉林省长春市九台区师范高级中学2018-2019学年高二上学期期中考试化学试题新疆维吾尔自治区昌吉市第九中学2018-2019学年高二上学期期末考试化学试题【全国百强校】青海省西宁市第四高级中学2018-2019学年高二上学期期末考试化学试题青海省海东市第二中学2018-2019学年高一下学期期中考试化学试题江苏省沭阳县2018-2019学年高二下学期期中调研测试化学试题河北省鹿泉第一中学2019-2020学年高二9月月考化学试题辽宁省凌源市联合校2019-2020学年高二上学期期中考试化学试题甘肃省永昌四中2019-2020学年高二上学期期中考试化学试题新疆维吾尔自治区昌吉玛纳斯县第一中学2018-2019学年高二上学期期中考试化学试题河北省临漳县第一中学2019-2020学年高二上学期期中考试化学试题甘肃省张掖市山丹县第一中学2017—2018学年高二上学期期末质量检测化学试题吉林省通化市梅河口市博文学校2019-2020学年高二上学期期末考试化学试题北京101中学2019-2020学年高二上学期期末考试化学试题广东省湛江市第二十一中学2019-2020学年高二上学期期中考试化学试题吉林省长春市第二十九中学2019-2020学年高一下学期期中考试化学试题(理)山西省新绛县第二中学2019-2020学年高二上学期第一次考试化学试题新疆生产建设兵团第四师第一中学2020-2021学年高二上学期期中考试化学试题湖南省湘潭市第一中学2020-2021学年高二下学期期中考试(水平测试)化学试卷重庆市万州纯阳中学2020-2021学年高二上学期期中考试化学试题辽宁省阜新市第二高级中学2020-2021学年高二上学期第二次月考化学试题新疆哈密市第八中学2019-2020学年高二上学期期中考试化学试题安徽省滁州市2020-2021学年高二上学期期末联考化学试题山西省沁县中学2020-2021学年高二上学期第一次月考化学试题辽宁省阜新市第二高级中学2020-2021学年高二上学期期末考试化学试题黑龙江省鹤岗市绥滨县第一中学2020-2021学年高二上学期期末考试化学试题广西南宁市2020-2021学年高二上学期期末考试(原理)化学试题广西南宁市2020-2021学年高二上学期期末考试化学试题河北省唐山市丰润区第二中学2020-2021学年高二上学期1月月考化学试题云南省楚雄师范学院附属中学2020-2021学年高二上学期期中考试化学试题甘肃省庆阳市第六中学2021-2022学年高二上学期第一次月考化学(理)试题吉林省吉林市永吉县第四中学2021-2022学年高二上学期期中考试化学试题甘肃省兰州市第一中学2021-2022学年高二上学期期中考试化学(理科)试题福建省莆田第二十五中学2021-2022学年高二上学期期中考试化学试题黑龙江省大兴安岭实验中学(西校区)2021-2022学年高二上学期期中考试化学试题吉林省延边朝鲜族自治州汪清县汪清第四中学2021-2022学年高二上学期第二次阶段考试化学试题宁夏吴忠中学2021-2022学年高二上学期期末考试化学试题辽宁省营口市第二高级中学2021-2022学年高一下学期第一次月考化学试题安徽省六安中学2021-2022学年高二上学期期末考试化学试题湖南省涟源市第二中学2021-2022学年高二上学期期中考试化学试题北京市首都师范大学附属密云中学2022-2023学年高二上学期10月阶段性练习化学试题甘肃省临夏州临夏县中学2021-2022学年高二上学期期中考试化学(B卷)试题甘肃省临夏州临夏县中学2021-2022学年高二上学期期中考试化学(A卷)试题安徽省太和县第八中学2021-2022学年高二上学期第一次月考化学试题广西南宁市第五十六中学2022-2023学年高二上学期月考化学试题(已下线)单项选择题黑龙江省齐齐哈尔市龙沙区2022-2023学年高二上学期12月期末考试化学试题天津市滨海新区田家炳中学2023-2024学年高二上学期期中考试化学试题青海省西宁北外附属新华联外国语高级中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
4 . 下列热化学方程式正确的是
| A.已知2C(s)+2O2(g)=2CO2(g) ΔH=akJ·mol-1,2C(s)+O2(g)=2CO(g) ΔH=bkJ·mol-1,则a<b |
| B.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<0 |
| C.HCl和NaOH反应的中和热ΔH=-57.3kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1 |
| D.甲烷的燃烧热ΔH=-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJ·mol-1 |
您最近一年使用:0次
2022-01-03更新
|
298次组卷
|
13卷引用:江西省吉安市第三中学2023届高三一模考试化学试题
江西省吉安市第三中学2023届高三一模考试化学试题【校级联考】江西省赣州市南康中学、于都中学2018-2019学年高二上学期第三次月考化学试题江西省赣州市南康区南康中学2020-2021学年高二上学期第三次大考化学试题河北省张家口市宣化第一中学2020-2021学年高二上学期1月月考化学试题广西钦州市第四中学2020-2021学年下学期高二3月月考化学(体艺班)试题辽宁省辽河油田第二高级中学2021-2022学年高二上学期开学考试化学试题(已下线)选择性必修1 综合检测(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)山西省山西师范大学实验学校2021-2022学年高二上学期第二次月考化学试题山西省运城市芮城中学2021-2022学年高二上学期12月月考化学试题天津市武清区杨村第一中学2021-2022学年高二上学期第三次月考化学试题云南省楚雄天人中学2021-2022学年高二上学期12月月考化学试题(B卷)(已下线)选择题6-10河南省焦作市第十一中学2023-2024学年高二上学期期中考试 化学试题
5 . 研究碳、氮、硫的氧化物的性质对化工生产和环境保护有重要意义。回答下列问题:
(1)甲醇(CH3OH)可替代汽油作为公交车的燃料,写出由CO和H2生产甲醇的化学方程式___ 。用该反应合成1mol液态甲醇放出热量128.1kJ。又知2H2(g)+CO(g)+ O2(g)=CO2(g)+2H2O(g) ΔH=−766.6kJ·mol−1,H2O(g)=H2O(l) ΔH=−44kJ·mol−1。请写出表示甲醇燃烧热的热化学方程式
O2(g)=CO2(g)+2H2O(g) ΔH=−766.6kJ·mol−1,H2O(g)=H2O(l) ΔH=−44kJ·mol−1。请写出表示甲醇燃烧热的热化学方程式_____ 。
(2)一定条件下,CH4可与NO2反应降低氮氧化物的污染:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g) ΔH=−875.3kJ·mol−1;该反应是___________ (填“自发”或“非自发”)反应。用NH3催化还原NOx也可降低氮氧化物的污染,反应的方程式为NO(g)+NO2(g)+2NH3(g) 2N2(g)+3H2O(l)ΔH<0,该反应的平衡常数表达式为
2N2(g)+3H2O(l)ΔH<0,该反应的平衡常数表达式为__________ 。
(3)常温下,某NaNO2和HNO2混合溶液的pH为5,c( )∶c(HNO2)=10∶1,则混合溶液中
)∶c(HNO2)=10∶1,则混合溶液中 的水解常数为
的水解常数为_______ 。
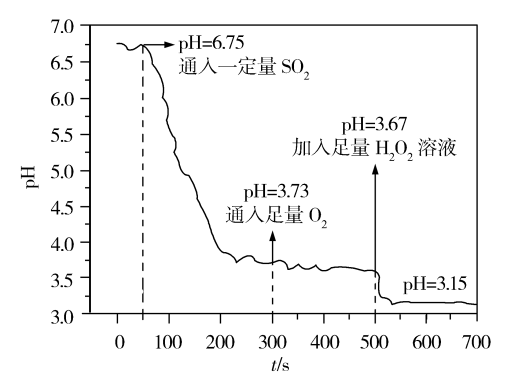
(4)在不同温度下的恒容容器中,将燃煤尾气中的SO2净化后与O2以2∶1的物质的量之比混合反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0,测得容器内总压强与反应时间的关系如图所示。
2SO3(g) ΔH<0,测得容器内总压强与反应时间的关系如图所示。

①T1___ T2(填“=”“>”或“<”)。
②C点的正反应速率v(C)正与A点的逆反应速率v(A)逆的大小关系为v(C)正___ v(A)逆(填“=”“>”或“<”)。
③B点SO2的转化率为_______ 。
(5)25℃时,将SO2通入蒸馏水中模拟酸雨形成过程,实验数据如下图。50s~300s时间段溶液pH降低的原因是_______ ;用化学方程式表示500s时溶液pH降低的原因________ 。
(1)甲醇(CH3OH)可替代汽油作为公交车的燃料,写出由CO和H2生产甲醇的化学方程式
 O2(g)=CO2(g)+2H2O(g) ΔH=−766.6kJ·mol−1,H2O(g)=H2O(l) ΔH=−44kJ·mol−1。请写出表示甲醇燃烧热的热化学方程式
O2(g)=CO2(g)+2H2O(g) ΔH=−766.6kJ·mol−1,H2O(g)=H2O(l) ΔH=−44kJ·mol−1。请写出表示甲醇燃烧热的热化学方程式(2)一定条件下,CH4可与NO2反应降低氮氧化物的污染:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g) ΔH=−875.3kJ·mol−1;该反应是
 2N2(g)+3H2O(l)ΔH<0,该反应的平衡常数表达式为
2N2(g)+3H2O(l)ΔH<0,该反应的平衡常数表达式为(3)常温下,某NaNO2和HNO2混合溶液的pH为5,c(
 )∶c(HNO2)=10∶1,则混合溶液中
)∶c(HNO2)=10∶1,则混合溶液中 的水解常数为
的水解常数为(4)在不同温度下的恒容容器中,将燃煤尾气中的SO2净化后与O2以2∶1的物质的量之比混合反应:2SO2(g)+O2(g)
 2SO3(g) ΔH<0,测得容器内总压强与反应时间的关系如图所示。
2SO3(g) ΔH<0,测得容器内总压强与反应时间的关系如图所示。
①T1
②C点的正反应速率v(C)正与A点的逆反应速率v(A)逆的大小关系为v(C)正
③B点SO2的转化率为
(5)25℃时,将SO2通入蒸馏水中模拟酸雨形成过程,实验数据如下图。50s~300s时间段溶液pH降低的原因是

您最近一年使用:0次
6 . 下列有关热化学方程式书写及对应表述均正确的是
A.密闭容器中,9.6g硫粉与11.2g铁粉混合加热生成硫 化亚铁17.6g时,放出19.12kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6kJ.mol-1 化亚铁17.6g时,放出19.12kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6kJ.mol-1 |
| B.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
| C.已知1mol氢气完全燃烧生成液态水所放出的热量为285.5kJ,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+285.5kJ.mol-1 |
| D.已知2C(s)+O2(g)═2CO(g)△H=-22.1kJ.mol-1则可知C的燃烧热△H=-110.5kJ.mol-1 |
您最近一年使用:0次
7 . 下列实验操作、现象和结论均正确的是
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向盛有1 mL浓硫酸的试管中加入5 mL 0 .1 mol/L的K2Cr2O7溶液 | 溶液橙 色变深 | 增大生成物浓度,平衡Cr2O +H2O +H2O 2CrO 2CrO +2H逆向移动 +2H逆向移动 |
| B | 向Mg(OH)2悬浊液中加入少量醋酸铵晶体 | 沉淀溶解,溶液变澄清 | 说明反应Mg2++2NH3·H2O Mg(OH)2+2NH Mg(OH)2+2NH ,具有可逆性 ,具有可逆性 |
| C | 相同温度下,同时向①4mL0.1 mol/L. KMnO4),酸性溶液和②4 mL 0.2 mol/LKMnO4,酸性溶液中,分别加入4mL 1 mol/L. H2C2O4溶液 | ①中溶液先褪色 | 该实验条件下,KMnO4浓度越小,反应速率越快 |
| D | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火焰煤炭燃烧更旺 | 加少量水后,可使煤炭燃烧放出更多的热量 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
8 . 下列说法正确的是
| A.将NaOH溶液分多次缓慢注入盐酸中,还是一次性快速注入盐酸中,都不影响中和热测定 |
| B.已知反应的中和热为ΔH=-57.3 kJ·mol-1,则稀H2SO4和稀Ca(OH)2溶液反应的中和热ΔH=-2×57.3 kJ·mol-1 |
| C.燃烧热是指在101 kPa时可燃物完全燃烧时所放出的热量,故S(s)+3/2O2(g)=SO3(g)ΔH=-315 kJ·mol-1即为硫的燃烧热 |
| D.已知冰的熔化热为6.0 kJ·mol-1,冰中氢键键能为20.0 kJ·mol-1,假设1 mol冰中有2 mol氢键,且熔化热完全用于破坏冰中的氢键,则最多只能破坏1 mol冰中15%氢键 |
您最近一年使用:0次
2018-10-28更新
|
1132次组卷
|
8卷引用:【南昌新东方】2018-2019 莲塘一中 高三11月 012
(已下线)【南昌新东方】2018-2019 莲塘一中 高三11月 012江西省景德镇市浮梁一中2020-2021学年高二下学期4月月考化学试题陕西省西安市长安区第五中学2019届高三上学期期中考试化学试题河北省衡水市衡水中学2019届高三上学期期中考试化学试题宁夏石嘴山市第三中学2020届高三上学期期中考试化学试题辽宁省实验中学东戴河分校2019-2020学年高二12月月考化学试题2020届高三化学二轮复习———燃烧热的综合(已下线)第01章 化学反应与能量(B卷提升篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)
名校
9 . 依据叙述,写出下列反应的热化学方程式.
(1)若适量的N2和O2完全反应,每生成23gNO2需要吸收16.95kJ热量 其热化学方程式为
其热化学方程式为______ .
(2)已知1g液态乙醇(C2H5OH)完全燃烧生成CO2气体和液态水时,放出29.7kJ的热量,写出乙醇燃烧热的热化学方程式为______ .
(1)若适量的N2和O2完全反应,每生成23gNO2需要吸收16.95kJ热量
 其热化学方程式为
其热化学方程式为(2)已知1g液态乙醇(C2H5OH)完全燃烧生成CO2气体和液态水时,放出29.7kJ的热量,写出乙醇燃烧热的热化学方程式为
您最近一年使用:0次
10 . 下图中,A~L为常见物质或该物质的水溶液,B在A气体中燃烧产生棕黄色烟,B、G为中学化学中常见的金属单质,E的稀溶液为蓝色,I的焰色反应为黄色,组成J的元素原子核内只有一个质子,F为无色、有刺激性气味的气体,且能使品红溶液褪色。
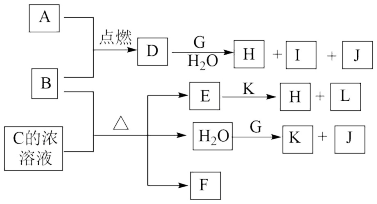
请回答下列问题:
(1)框图中所列物质中属于非电解质的物质是_____________ ;
(2)将D的水溶液蒸干并灼烧得到的固体物质的化学式为___________ ;
(3)在一定物质的量浓度的硝酸铵溶液中滴加适量的K溶液,使溶液的pH=7,则溶液中c(Na+)_______ c( )(选填“>”“=”或“<”)。
)(选填“>”“=”或“<”)。
(4)①4 g J在纯氧中完全燃烧生成液态化合物,放出热量为QkJ,写出表示J燃烧热的热化学方程式_____ 。
②A是重要的化工原料,工业上制取A的反应的化学方程式为___________ 。
(5)与F组成元素相同的一种-2价酸根离子M,M中两种元素的质量比为4∶3,已知1 mol A单质与含1 mol M的溶液能恰好完全反应,反应时仅观察到有浅黄色沉淀产生。取反应后的上层清液加入盐酸酸化的氯化钡溶液,有白色沉淀产生。则A单质与含M的溶液反应的离子方程式为:_________ 。
(6)25℃时,若Ksp(H)=2.2×10-20,向0.022mol/L的E溶液中逐滴滴入溶液K,当开始出现沉淀时,溶液中的c(OH-)=_________ 。

请回答下列问题:
(1)框图中所列物质中属于非电解质的物质是
(2)将D的水溶液蒸干并灼烧得到的固体物质的化学式为
(3)在一定物质的量浓度的硝酸铵溶液中滴加适量的K溶液,使溶液的pH=7,则溶液中c(Na+)
 )(选填“>”“=”或“<”)。
)(选填“>”“=”或“<”)。(4)①4 g J在纯氧中完全燃烧生成液态化合物,放出热量为QkJ,写出表示J燃烧热的热化学方程式
②A是重要的化工原料,工业上制取A的反应的化学方程式为
(5)与F组成元素相同的一种-2价酸根离子M,M中两种元素的质量比为4∶3,已知1 mol A单质与含1 mol M的溶液能恰好完全反应,反应时仅观察到有浅黄色沉淀产生。取反应后的上层清液加入盐酸酸化的氯化钡溶液,有白色沉淀产生。则A单质与含M的溶液反应的离子方程式为:
(6)25℃时,若Ksp(H)=2.2×10-20,向0.022mol/L的E溶液中逐滴滴入溶液K,当开始出现沉淀时,溶液中的c(OH-)=
您最近一年使用:0次



