1 . 几种物质间的转化焓变如图所示,下列说法不正确 的是
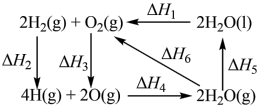

| A.ΔH3>ΔH4 | B.ΔH1>ΔH6 |
| C.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=0 | D.H—H的键能为ΔH2 |
您最近一年使用:0次
2023-11-11更新
|
180次组卷
|
2卷引用:福建省福州市八县一中2023-2024学年高二上学期11月期中化学试题
名校
解题方法
2 . Ⅰ.在载人航天器中,可以利用 与
与 的反应,将航天员呼出的
的反应,将航天员呼出的 转化为
转化为 等,然后通过电解
等,然后通过电解 得到
得到 ,从而实现
,从而实现 的再生。已知:
的再生。已知:
①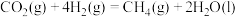

②
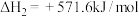
(1)请写出甲烷与氧气反应生成二氧化碳和液态水的热化学方程式___________ 。
Ⅱ.将 盐酸和
盐酸和 未知浓度的
未知浓度的 溶液混合均匀后测量并记录溶液的温度,实验结果如图所示,实验中始终保持
溶液混合均匀后测量并记录溶液的温度,实验结果如图所示,实验中始终保持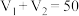 。
。
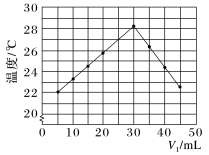
(2)下列叙述正确的是___________。
(3)中和反应的反应热的理论值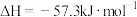 ,写出表示稀盐酸和
,写出表示稀盐酸和 溶液反应的中和热的热化学方程式
溶液反应的中和热的热化学方程式___________ 。下列操作可能使测得的 偏大的是
偏大的是___________ (填序号)。
①室温低于 时进行实验
时进行实验
②分多次把 溶液倒入盛有盐酸的小烧杯中
溶液倒入盛有盐酸的小烧杯中
③实验时用环形铜丝搅拌棒代替搅拌器
(4)在做测定中和反应的反应热实验时,应使用仪器的正确组合是___________。
①天平 ②量筒 ③烧杯 ④滴定管 ⑤温度计 ⑥试管 ⑦酒精灯
 与
与 的反应,将航天员呼出的
的反应,将航天员呼出的 转化为
转化为 等,然后通过电解
等,然后通过电解 得到
得到 ,从而实现
,从而实现 的再生。已知:
的再生。已知:①
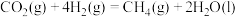

②

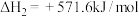
(1)请写出甲烷与氧气反应生成二氧化碳和液态水的热化学方程式
Ⅱ.将
 盐酸和
盐酸和 未知浓度的
未知浓度的 溶液混合均匀后测量并记录溶液的温度,实验结果如图所示,实验中始终保持
溶液混合均匀后测量并记录溶液的温度,实验结果如图所示,实验中始终保持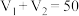 。
。
(2)下列叙述正确的是___________。
| A.该实验表明化学能可转化为热能 | B.做该实验时环境温度为 |
C. 溶液的浓度约为 溶液的浓度约为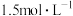 | D.该实验表明有水生成的反应都是放热反应 |
(3)中和反应的反应热的理论值
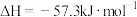 ,写出表示稀盐酸和
,写出表示稀盐酸和 溶液反应的中和热的热化学方程式
溶液反应的中和热的热化学方程式 偏大的是
偏大的是①室温低于
 时进行实验
时进行实验②分多次把
 溶液倒入盛有盐酸的小烧杯中
溶液倒入盛有盐酸的小烧杯中③实验时用环形铜丝搅拌棒代替搅拌器
(4)在做测定中和反应的反应热实验时,应使用仪器的正确组合是___________。
①天平 ②量筒 ③烧杯 ④滴定管 ⑤温度计 ⑥试管 ⑦酒精灯
| A.①②④ | B.②③⑤ | C.②③④⑦ | D.全部 |
您最近一年使用:0次
2023-11-11更新
|
75次组卷
|
2卷引用:福建省厦门大学附属科技中学2023-2024学年高二上学期第一次月考化学试题
名校
3 . 已知:
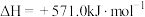 。以太阳能为热源分解
。以太阳能为热源分解 ,经热化学铁氧化合物循环分解水制
,经热化学铁氧化合物循环分解水制 的过程如下:
的过程如下:
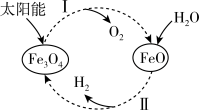
过程Ⅰ: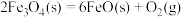
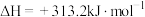
过程Ⅱ:∙∙∙∙∙∙
下列说法不正确的是

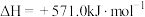 。以太阳能为热源分解
。以太阳能为热源分解 ,经热化学铁氧化合物循环分解水制
,经热化学铁氧化合物循环分解水制 的过程如下:
的过程如下:
过程Ⅰ:
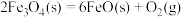
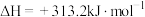
过程Ⅱ:∙∙∙∙∙∙
下列说法不正确的是
A.过程Ⅰ中每消耗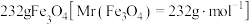 转移 转移 电子 电子 |
| B.过程Ⅰ、Ⅱ中能量转化的形式依次是太阳能→化学能→热能 |
C.铁氧化合物循环制 具有成本低、产物易分离等优点 具有成本低、产物易分离等优点 |
D.过程Ⅱ的热化学方程式为 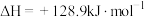 |
您最近一年使用:0次
名校
4 . 完成下列问题。
(1)实验测得16g甲醇 在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25kJ的热量,试写出甲醇完全燃烧的热化学方程式:
在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25kJ的热量,试写出甲醇完全燃烧的热化学方程式:___________ 。
(2)合成氨反应
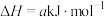 ,能量变化如图所示:
,能量变化如图所示:

①该反应通常用铁作催化剂,加催化剂会使图中
___________ (填“变大”“变小”或“不变”)。
②有关键能数据如下:
试根据表中所列键能数据计算a为___________ 。
(3)现根据下列的3个热化学反应方程式:
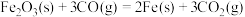

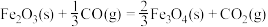
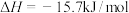

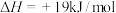
试写出CO气体还原FeO固体得到Fe固体和 气体的热化学反应方程式:
气体的热化学反应方程式:___________ 。
(1)实验测得16g甲醇
 在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25kJ的热量,试写出甲醇完全燃烧的热化学方程式:
在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25kJ的热量,试写出甲醇完全燃烧的热化学方程式:(2)合成氨反应

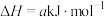 ,能量变化如图所示:
,能量变化如图所示:
①该反应通常用铁作催化剂,加催化剂会使图中

②有关键能数据如下:
| 化学键 | H-H | N-H | N≡N |
键能( ) ) | 436 | 391 | 945 |
(3)现根据下列的3个热化学反应方程式:
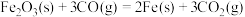

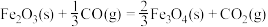
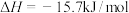

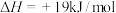
试写出CO气体还原FeO固体得到Fe固体和
 气体的热化学反应方程式:
气体的热化学反应方程式:
您最近一年使用:0次
5 . 甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义。
(1) ,
,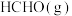 燃烧热
燃烧热 分别
分别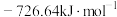 和
和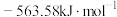 ,则
,则 与
与 反应生成
反应生成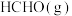 和
和 热化学反应方程式:
热化学反应方程式:___________ 。
(2)利用工业废气中的CO2可制取甲醇,其反应为: 常温常压下已知下列反应的能量变化如图1所示:
常温常压下已知下列反应的能量变化如图1所示:
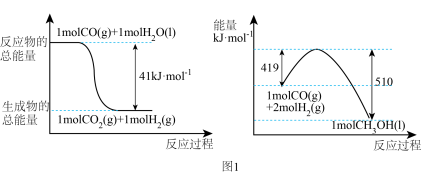
写出由二氧化碳和氢气制备甲醇的热化学方程式:___________ 。
(3)①为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了 的
的 晶体,在高温下它能传导
晶体,在高温下它能传导 离子。电池工作时正极反应式为
离子。电池工作时正极反应式为___________ 。
②若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液。
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象);阳极上收集到氧气的物质的量为___________ mol。
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将 氧化成
氧化成 ,然后以
,然后以 作氧化剂把水中的甲醇氧化成
作氧化剂把水中的甲醇氧化成 而净化。实验室用图2装置模拟上述过程:
而净化。实验室用图2装置模拟上述过程:
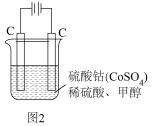
写出阳极电极反应式:___________ 。
(1)
 ,
,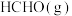 燃烧热
燃烧热 分别
分别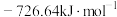 和
和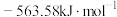 ,则
,则 与
与 反应生成
反应生成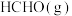 和
和 热化学反应方程式:
热化学反应方程式:(2)利用工业废气中的CO2可制取甲醇,其反应为:
 常温常压下已知下列反应的能量变化如图1所示:
常温常压下已知下列反应的能量变化如图1所示:
写出由二氧化碳和氢气制备甲醇的热化学方程式:
(3)①为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了
 的
的 晶体,在高温下它能传导
晶体,在高温下它能传导 离子。电池工作时正极反应式为
离子。电池工作时正极反应式为②若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液。
| 离子 | 铜离子 | 氢离子 | 氯离子 | 硫酸根离子 |
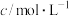 | 1 | 4 | 4 | 1 |
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将
 氧化成
氧化成 ,然后以
,然后以 作氧化剂把水中的甲醇氧化成
作氧化剂把水中的甲醇氧化成 而净化。实验室用图2装置模拟上述过程:
而净化。实验室用图2装置模拟上述过程:
写出阳极电极反应式:
您最近一年使用:0次
名校
6 . 甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、 和
和 )在催化剂作用下可合成甲醇,发生的主要反应如下:
)在催化剂作用下可合成甲醇,发生的主要反应如下:
Ⅰ.
 kJ⋅mol
kJ⋅mol ;
;
Ⅱ.
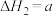 kJ⋅mol
kJ⋅mol ;
;
Ⅲ.
 kJ⋅mol
kJ⋅mol 。
。
(1)
___________ 。
(2)将2.0 mol 和3.0 mol
和3.0 mol  通入容积为3 L的恒容密闭容器中,在一定条件下发生反应Ⅱ,测得
通入容积为3 L的恒容密闭容器中,在一定条件下发生反应Ⅱ,测得 的平衡转化率与温度的关系如图所示。
的平衡转化率与温度的关系如图所示。
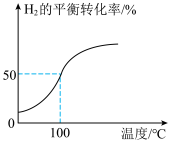
①100℃时反应达到平衡所需的时间为5 min,则反应从起始至5 min内,用 表示该反应的平均反应速率为
表示该反应的平均反应速率为___________ ;平衡后向容器中再通入3 mol Ar,平衡___________ (填“正向”“逆向”或“不”)移动。
②100℃时,反应Ⅱ的平衡常数
___________ 。
③若改变条件使平衡常数增大,则从改变条件至再次平衡正反应速率的变化为___________ 。
(3)甲醇会对水质造成一定的污染,有一种电化学法可消除稀硫酸和甲醇这种污染,其原理如下:通电后,将 氧化成
氧化成 ,下图然后以
,下图然后以 作氧化剂,将水中的甲醇氧化成
作氧化剂,将水中的甲醇氧化成 而净化。实验室用如图装置模拟上述过程。
而净化。实验室用如图装置模拟上述过程。
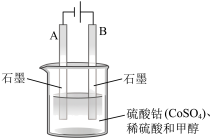
①写出阳极的电极反应式:___________ 。
②写出除去甲醇的离子方程式:___________ 。
 和
和 )在催化剂作用下可合成甲醇,发生的主要反应如下:
)在催化剂作用下可合成甲醇,发生的主要反应如下:Ⅰ.

 kJ⋅mol
kJ⋅mol ;
;Ⅱ.

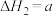 kJ⋅mol
kJ⋅mol ;
;Ⅲ.

 kJ⋅mol
kJ⋅mol 。
。(1)

(2)将2.0 mol
 和3.0 mol
和3.0 mol  通入容积为3 L的恒容密闭容器中,在一定条件下发生反应Ⅱ,测得
通入容积为3 L的恒容密闭容器中,在一定条件下发生反应Ⅱ,测得 的平衡转化率与温度的关系如图所示。
的平衡转化率与温度的关系如图所示。
①100℃时反应达到平衡所需的时间为5 min,则反应从起始至5 min内,用
 表示该反应的平均反应速率为
表示该反应的平均反应速率为②100℃时,反应Ⅱ的平衡常数

③若改变条件使平衡常数增大,则从改变条件至再次平衡正反应速率的变化为
(3)甲醇会对水质造成一定的污染,有一种电化学法可消除稀硫酸和甲醇这种污染,其原理如下:通电后,将
 氧化成
氧化成 ,下图然后以
,下图然后以 作氧化剂,将水中的甲醇氧化成
作氧化剂,将水中的甲醇氧化成 而净化。实验室用如图装置模拟上述过程。
而净化。实验室用如图装置模拟上述过程。
①写出阳极的电极反应式:
②写出除去甲醇的离子方程式:
您最近一年使用:0次
名校
解题方法
7 . 已知反应① 和反应②
和反应② 在T℃时的平衡常数分别为
在T℃时的平衡常数分别为 和
和 ,该温度下反应③
,该温度下反应③ 的平衡常数为
的平衡常数为 。则下列说法正确的是
。则下列说法正确的是
 和反应②
和反应② 在T℃时的平衡常数分别为
在T℃时的平衡常数分别为 和
和 ,该温度下反应③
,该温度下反应③ 的平衡常数为
的平衡常数为 。则下列说法正确的是
。则下列说法正确的是A.反应①的平衡常数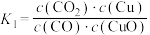 |
B.反应②中,增大氢气浓度,平衡正移, 增大 增大 |
C.对于反应③,T℃时,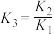 |
| D.对于反应③,恒容时,温度升高,K值减小,则该反应为放热反应 |
您最近一年使用:0次
8 . 镁和卤素单质( )反应的相对能量变化如图所示,下列说法正确的是
)反应的相对能量变化如图所示,下列说法正确的是
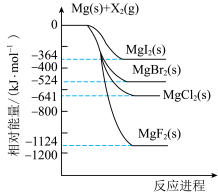
 )反应的相对能量变化如图所示,下列说法正确的是
)反应的相对能量变化如图所示,下列说法正确的是
A.热稳定性: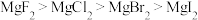 |
| B.1mol碘晶体与足量的Mg充分反应,放热364kJ |
C.工业上常用电解 溶液的方法冶炼金属Mg 溶液的方法冶炼金属Mg |
D.由图可知, 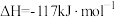 |
您最近一年使用:0次
2023-10-28更新
|
226次组卷
|
2卷引用:福建省漳州市东山县2023-2024学年高二上学期期中考试化学试题
名校
解题方法
9 . 如图1、图2分别表示 和
和 分解时的能量变化情况(单位:kJ)。下列说法错误的是
分解时的能量变化情况(单位:kJ)。下列说法错误的是
 和
和 分解时的能量变化情况(单位:kJ)。下列说法错误的是
分解时的能量变化情况(单位:kJ)。下列说法错误的是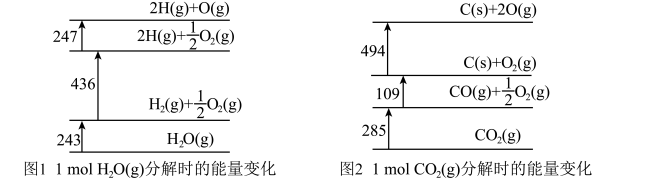
A.CO的燃烧热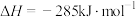 |
B. 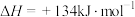 |
C.O=O的键能为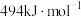 |
D.无法求得 的反应热 的反应热 |
您最近一年使用:0次
2023-10-27更新
|
469次组卷
|
11卷引用:福建省厦门外国语学校2023-2024学年高二上学期期中考试化学试题
福建省厦门外国语学校2023-2024学年高二上学期期中考试化学试题江西省上饶市广信中学2023-2024学年高二上学期11月月考化学试题(已下线)寒假作业01 化学反应的热效应-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)河南省豫北名校2024届高三毕业班上学期一轮复习联考(二)化学试题山西省部分学校2023-2024学年高三上学期10月月考(一轮复习联考(二))化学试题河北省石家庄部分高中2023-2024学年高三上学期10月期中考试化学试题甘肃省部分校2024届高三上学期10月月考化学试题辽宁省部分学校2023-2024学年高三上学期一轮复习联考(二)化学试题重庆市百师联盟2024届高三一轮复习联考(二)河北省保定市唐县第一中学2023-2024学年高三上学期11月期中考试化学试题(已下线)专题05 化学反应与能量-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
10 . 已知下列反应的平衡常数:
S(s)+ O2(g)⇌SO2(g),K1;
H2(g) +S(s)⇌H2S(g), K2;
则反应H2(g) +SO2(g)⇌O2(g) +H2S(g)的平衡常数是
S(s)+ O2(g)⇌SO2(g),K1;
H2(g) +S(s)⇌H2S(g), K2;
则反应H2(g) +SO2(g)⇌O2(g) +H2S(g)的平衡常数是
| A.K1+K2 | B.K2−K1 | C.K1 ×K2 | D.K2/K1 |
您最近一年使用:0次
2023-10-24更新
|
204次组卷
|
2卷引用:福建省建瓯市芝华中学2023-2024学年高二上学期期中考试化学试题



