名校
1 . 火箭推进器中装有还原剂液态肼(N2H4)和氧化剂过氧化氢(H2O2),当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量。回答下列问题:
(1)过氧化氢的电子式是___________ 。
(2)该反应的热化学方程式为___________ 。
(3)实验室可用次氯酸钠溶液与氨气反应制备液态肼,已知生成物之一是常见的盐,则反应的化学方程式为___________ 。
(4)在微生物作用的条件下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
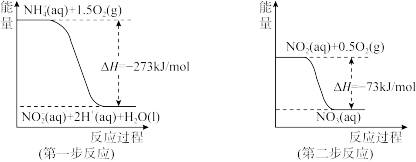
①第一步反应是___________ (填“放热”或“吸热”)反应,判断依据是___________ 。
②1 mol NH (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的反应热ΔH是
(aq)的反应热ΔH是___________ 。
(5)已知: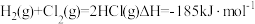 ,几种化学键的键能如下表所示,则a=
,几种化学键的键能如下表所示,则a=___________ 。
(1)过氧化氢的电子式是
(2)该反应的热化学方程式为
(3)实验室可用次氯酸钠溶液与氨气反应制备液态肼,已知生成物之一是常见的盐,则反应的化学方程式为
(4)在微生物作用的条件下,NH
 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
①第一步反应是
②1 mol NH
 (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的反应热ΔH是
(aq)的反应热ΔH是(5)已知:
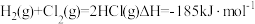 ,几种化学键的键能如下表所示,则a=
,几种化学键的键能如下表所示,则a=| 共价键 | H-H | Cl-Cl | H-Cl |
键能/( ) ) | 436 | 247 | a |
您最近一年使用:0次
2023-10-24更新
|
206次组卷
|
2卷引用:福建省漳州市东山县2023-2024学年高二上学期期中考试化学试题
名校
解题方法
2 .  是石油化工行业产生的污染性气体,工业上采取多种方式进行处理。
是石油化工行业产生的污染性气体,工业上采取多种方式进行处理。
(1)常温下可用空气直接氧化脱除: ;
; 已知
已知 、S的燃烧焓分别为akJ/mol、bkJ/mol,则
、S的燃烧焓分别为akJ/mol、bkJ/mol,则
___________ 。
(2)电化学溶解-沉淀法回收利用 的工艺原理如图所示:
的工艺原理如图所示:
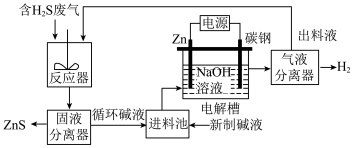
已知:Zn能与强碱溶液反应产生 ;
; 在强碱溶液中以
在强碱溶液中以 形式存在。
形式存在。
①锌棒连接直流电源的___________ (填“正极”或“负极”)。
②“反应器”中反应的离子方程式为___________ 。
③“电解槽”中没接通电源时已经有 产生,用化学用语解释原因
产生,用化学用语解释原因___________ ;
(3)间接电解法脱硫过程的装置图如图所示:
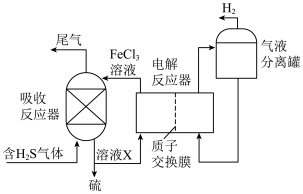
①溶液X的主要溶质是___________ 。
②简述在电解反应器中 溶液再生的原理:
溶液再生的原理:___________ 。
③不考虑其他副反应,理论上5mol 反应能生成
反应能生成___________  。
。
 是石油化工行业产生的污染性气体,工业上采取多种方式进行处理。
是石油化工行业产生的污染性气体,工业上采取多种方式进行处理。(1)常温下可用空气直接氧化脱除:
 ;
; 已知
已知 、S的燃烧焓分别为akJ/mol、bkJ/mol,则
、S的燃烧焓分别为akJ/mol、bkJ/mol,则
(2)电化学溶解-沉淀法回收利用
 的工艺原理如图所示:
的工艺原理如图所示:
已知:Zn能与强碱溶液反应产生
 ;
; 在强碱溶液中以
在强碱溶液中以 形式存在。
形式存在。①锌棒连接直流电源的
②“反应器”中反应的离子方程式为
③“电解槽”中没接通电源时已经有
 产生,用化学用语解释原因
产生,用化学用语解释原因(3)间接电解法脱硫过程的装置图如图所示:

①溶液X的主要溶质是
②简述在电解反应器中
 溶液再生的原理:
溶液再生的原理:③不考虑其他副反应,理论上5mol
 反应能生成
反应能生成 。
。
您最近一年使用:0次
名校
3 . 由 与
与 制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由
制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由 人工合成淀粉(节选途径见下图)中的重要反应之一,
人工合成淀粉(节选途径见下图)中的重要反应之一,
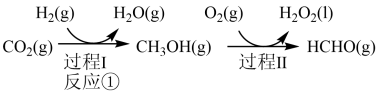
已知:
反应②:
反应③:

(1)反应①的热化学方程式为___________ ;若过程Ⅱ中O得到4mol电子,则理论上可生成___________ molHCHO。
(2)反应①在有、无催化剂条件下的反应历程如下图所示,其中吸附在催化剂表面上的物种用*标注,TS为过渡态。
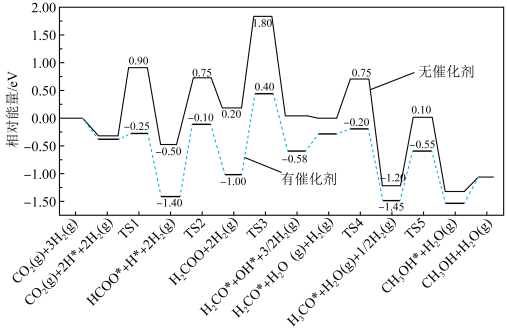
该反应历程中决速步骤的化学方程式为,催化剂使该步骤的活化能降低___________ eV。
(3)某研究小组采用上述催化剂,向密闭容器中通入3mol 和1mol
和1mol ,只发生反应①和反应②,在不同条件下达到平衡,在T=300℃下甲醇的体积分数
,只发生反应①和反应②,在不同条件下达到平衡,在T=300℃下甲醇的体积分数 (CHOH)随压强p的变化、在p-600kPa下
(CHOH)随压强p的变化、在p-600kPa下 (CHOH)随温度T的变化,如下图所示。
(CHOH)随温度T的变化,如下图所示。
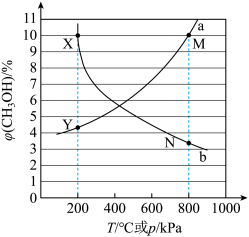
①X点对应的温度和压强为___________ ℃,___________ kPa。
②M点 的分压为
的分压为___________ kPa,此时容器中 为
为 ,CO为
,CO为 ,反应的压强平衡常数
,反应的压强平衡常数
___________  (压强平衡常数K是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数)。
(压强平衡常数K是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数)。
 与
与 制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由
制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由 人工合成淀粉(节选途径见下图)中的重要反应之一,
人工合成淀粉(节选途径见下图)中的重要反应之一,
已知:
反应②:

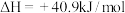
反应③:


(1)反应①的热化学方程式为
(2)反应①在有、无催化剂条件下的反应历程如下图所示,其中吸附在催化剂表面上的物种用*标注,TS为过渡态。

该反应历程中决速步骤的化学方程式为,催化剂使该步骤的活化能降低
(3)某研究小组采用上述催化剂,向密闭容器中通入3mol
 和1mol
和1mol ,只发生反应①和反应②,在不同条件下达到平衡,在T=300℃下甲醇的体积分数
,只发生反应①和反应②,在不同条件下达到平衡,在T=300℃下甲醇的体积分数 (CHOH)随压强p的变化、在p-600kPa下
(CHOH)随压强p的变化、在p-600kPa下 (CHOH)随温度T的变化,如下图所示。
(CHOH)随温度T的变化,如下图所示。
①X点对应的温度和压强为
②M点
 的分压为
的分压为 为
为 ,CO为
,CO为 ,反应的压强平衡常数
,反应的压强平衡常数
 (压强平衡常数K是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数)。
(压强平衡常数K是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数)。
您最近一年使用:0次
4 . 已知:在标准压强101kPa、25℃,由最稳定的单质合成1mol物质B的反应焓变,叫做物质B的标准摩尔生成焓,用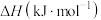 表示。有关物质的标准摩尔生成焓
表示。有关物质的标准摩尔生成焓 如图所示,下列有关判断正确的是
如图所示,下列有关判断正确的是
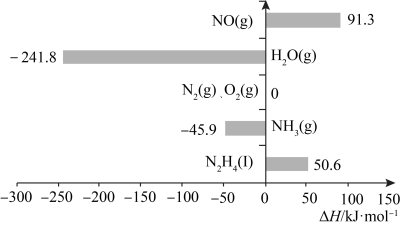
 表示。有关物质的标准摩尔生成焓
表示。有关物质的标准摩尔生成焓 如图所示,下列有关判断正确的是
如图所示,下列有关判断正确的是
A.H2O(l)的 | B.N2H4(l)的标准燃烧热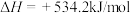 |
| C.N2H4比NH3稳定 | D. 是放热反应 是放热反应 |
您最近一年使用:0次
2023-10-15更新
|
408次组卷
|
3卷引用:福建省厦门外国语学校2023-2024学年高二上学期期中考试化学试题
5 . 化学反应过程伴随有热量的变化。
(1)在尿素合成塔中的主要反应可表示如下:
反应I:
反应Ⅱ: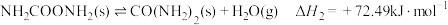
总反应: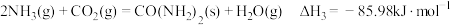
则反应I的
___________  。
。
(2)利用CH4可制备乙烯及合成气(CO、H2)。
①有关化学键键能(E)的数据如下表:
则

___________ 。(用a、b、c、d表示)
②制备合成气反应历程分两步(步骤I、步骤Ⅱ,反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:
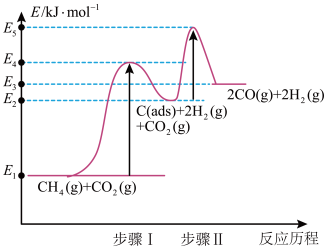
步骤1反应的焓变 为
为___________ kJ/mol(选用E1~E5的关系式表示)。
③反应 的焓变为
的焓变为 ,与步骤1焓变
,与步骤1焓变 相比,
相比,
___________  (填“>”或“<)。
(填“>”或“<)。
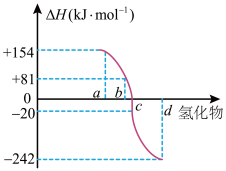
(3)一定条件下,由稳定单质反应生成1mol化合物的反应热叫该化合物的生成热( )。下图为VIA族元素(O、S、Se、Te)氢化物a、b、c、d的生成热数据示意图。已知非金属元素气态氢化物的稳定性越强,其氢化物的生成热
)。下图为VIA族元素(O、S、Se、Te)氢化物a、b、c、d的生成热数据示意图。已知非金属元素气态氢化物的稳定性越强,其氢化物的生成热 越小。硫化氢发生分解反应的热化学方程式为
越小。硫化氢发生分解反应的热化学方程式为___________ 。
(1)在尿素合成塔中的主要反应可表示如下:
反应I:

反应Ⅱ:
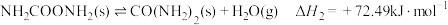
总反应:
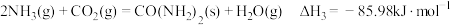
则反应I的

 。
。(2)利用CH4可制备乙烯及合成气(CO、H2)。
①有关化学键键能(E)的数据如下表:
| 化学键 | H—H | C=C | C—C | C—H |
| E(kJ/mol) | a | b | c | d |


②制备合成气反应历程分两步(步骤I、步骤Ⅱ,反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:

步骤1反应的焓变
 为
为③反应
 的焓变为
的焓变为 ,与步骤1焓变
,与步骤1焓变 相比,
相比,
 (填“>”或“<)。
(填“>”或“<)。(3)一定条件下,由稳定单质反应生成1mol化合物的反应热叫该化合物的生成热(
 )。下图为VIA族元素(O、S、Se、Te)氢化物a、b、c、d的生成热数据示意图。已知非金属元素气态氢化物的稳定性越强,其氢化物的生成热
)。下图为VIA族元素(O、S、Se、Te)氢化物a、b、c、d的生成热数据示意图。已知非金属元素气态氢化物的稳定性越强,其氢化物的生成热 越小。硫化氢发生分解反应的热化学方程式为
越小。硫化氢发生分解反应的热化学方程式为
您最近一年使用:0次
名校
解题方法
6 . 请回答下列问题:
(1)工业上以 和
和 为原料在一定温度和压强下合成尿素。
为原料在一定温度和压强下合成尿素。
反应分两步:i. 和
和 生成
生成 ;ii.
;ii. 分解生成尿素。
分解生成尿素。
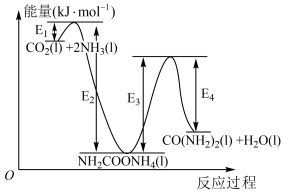
结合反应过程中能量变化示意图,合成尿素总反应的 为
为___________ 。(用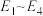 列式表示)
列式表示)
(2)根据表格计算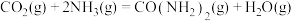

___________ 。
(3)尿素 燃料电池可直接去除城市废水中的尿素,既能产生净化水,又能发电。其装置如下图所示,正极反应为
燃料电池可直接去除城市废水中的尿素,既能产生净化水,又能发电。其装置如下图所示,正极反应为___________ 。
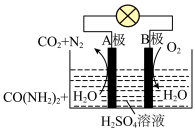
(4)近年研究发现,电催化 和含氮物质(
和含氮物质( 等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的
等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的 溶液通
溶液通 至饱和,在电极上反应生成
至饱和,在电极上反应生成 ,电解原理如图所示。
,电解原理如图所示。
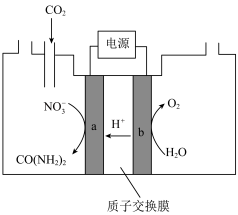
①电极b是电解池的___________ 极。
②尿素分子中,C元素的价态为___________ 。电解过程中生成尿素的电极反应为___________ 。
(5)以石墨为阳极、铁为阴极电解含 废水可用于去除
废水可用于去除 。电解过程中各种含氮微粒的浓度、溶液的pH与时间的关系如图所示。
。电解过程中各种含氮微粒的浓度、溶液的pH与时间的关系如图所示。

①0~1 min时,阴极发生的主要电极反应方程式为___________ 。
②若向废水中加入一定量的NaCl,则电解后的废水中 几乎完全转化为
几乎完全转化为 ,原因是
,原因是___________ 。
(1)工业上以
 和
和 为原料在一定温度和压强下合成尿素。
为原料在一定温度和压强下合成尿素。反应分两步:i.
 和
和 生成
生成 ;ii.
;ii. 分解生成尿素。
分解生成尿素。
结合反应过程中能量变化示意图,合成尿素总反应的
 为
为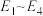 列式表示)
列式表示)(2)根据表格计算
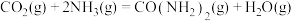

| 化学键 |  |  |  |  |
键能( ) ) | 389 | 728 | 305 | 464 |
(3)尿素
 燃料电池可直接去除城市废水中的尿素,既能产生净化水,又能发电。其装置如下图所示,正极反应为
燃料电池可直接去除城市废水中的尿素,既能产生净化水,又能发电。其装置如下图所示,正极反应为
(4)近年研究发现,电催化
 和含氮物质(
和含氮物质( 等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的
等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的 溶液通
溶液通 至饱和,在电极上反应生成
至饱和,在电极上反应生成 ,电解原理如图所示。
,电解原理如图所示。
①电极b是电解池的
②尿素分子中,C元素的价态为
(5)以石墨为阳极、铁为阴极电解含
 废水可用于去除
废水可用于去除 。电解过程中各种含氮微粒的浓度、溶液的pH与时间的关系如图所示。
。电解过程中各种含氮微粒的浓度、溶液的pH与时间的关系如图所示。
①0~1 min时,阴极发生的主要电极反应方程式为
②若向废水中加入一定量的NaCl,则电解后的废水中
 几乎完全转化为
几乎完全转化为 ,原因是
,原因是
您最近一年使用:0次
名校
解题方法
7 . A.为探究碳酸钠、碳酸氢钠分别与稀盐酸反应的热效应,某化学兴趣小组进行如下实验。
查阅资料:反应Ⅰ: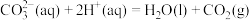
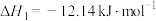 ;
;
反应Ⅱ: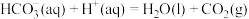
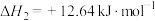
(1)反应Ⅲ:向碳酸钠溶液中滴加少量盐酸生成碳酸氢钠的离子反应的热化学方程式为___________ 。
(2)向 碳酸钠溶液中,逐滴加入
碳酸钠溶液中,逐滴加入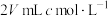 稀盐酸。下列图象中,能正确表示该反应过程中的能量变化的是___________(填标号)。
稀盐酸。下列图象中,能正确表示该反应过程中的能量变化的是___________(填标号)。
B.实验探究:按表格所示用量,在量热器中将相应试剂混合后测定温度,验证碳酸钠、碳酸氢钠分别与稀盐酸反应的热效应。

表格1:
表格2:
表格3:
(3)表格1实验___________ (填“能”或“否”)验证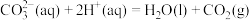
 ,
,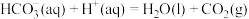
 。
。
(4)实验中玻璃搅拌器的使用方法是___________ 。(填标号)
A.顺时针搅拌 B.逆时针搅拌 C.上下拉动
(5)进行表格3操作的目的是___________ 。
(6)结合实验探究所得的结论进行分析判断。
反应Ⅳ: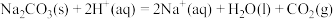
 ;
;
反应Ⅴ: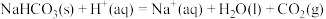

则
___________  (填“>”、“<”或“=”,下同),
(填“>”、“<”或“=”,下同),
___________  。
。
查阅资料:反应Ⅰ:
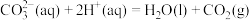
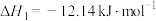 ;
;反应Ⅱ:
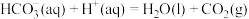
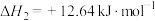
(1)反应Ⅲ:向碳酸钠溶液中滴加少量盐酸生成碳酸氢钠的离子反应的热化学方程式为
(2)向
 碳酸钠溶液中,逐滴加入
碳酸钠溶液中,逐滴加入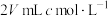 稀盐酸。下列图象中,能正确表示该反应过程中的能量变化的是___________(填标号)。
稀盐酸。下列图象中,能正确表示该反应过程中的能量变化的是___________(填标号)。A.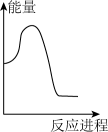 | B.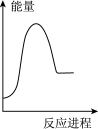 | C.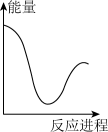 | D.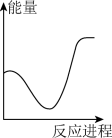 |
B.实验探究:按表格所示用量,在量热器中将相应试剂混合后测定温度,验证碳酸钠、碳酸氢钠分别与稀盐酸反应的热效应。

表格1:
| 试剂1 | 试剂2 | 试剂1和试剂2混合后温度 |
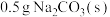 | 19.0℃的40 mL HCl | 21.7℃ |
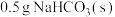 | 19.0℃的40 mL HCl | 18.1℃ |
| 试剂1 | 试剂2 | 试剂1溶解于试剂2后的温度 | 静置后混合液的温度 | 试剂3 | 静置后混合液再加入试剂3后的温度 |
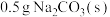 | 19.0℃的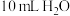 | 22.3℃ | 19.0℃ | 19.0℃的10 mL HCl | 20.5℃ |
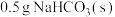 | 19.0℃的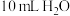 | 17.5℃ | 19.0℃ | 19.0℃的10 mL HCl | 18.3℃ |
| 试剂1 | 试剂2 | 试剂1溶解于试剂2后的温度 | 静置后混合液的温度 | 试剂3 | 静置后混合液再加入试剂3后的温度 |
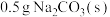 | 19.0℃的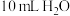 | 22.3℃ | 19.0℃ | 19.0℃的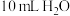 | 19.0℃ |
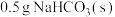 | 19.0℃的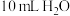 | 17.5℃ | 19.0℃ | 19.0℃的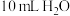 | 19.0℃ |
(3)表格1实验
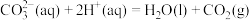
 ,
,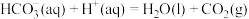
 。
。(4)实验中玻璃搅拌器的使用方法是
A.顺时针搅拌 B.逆时针搅拌 C.上下拉动
(5)进行表格3操作的目的是
(6)结合实验探究所得的结论进行分析判断。
反应Ⅳ:
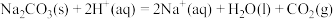
 ;
;反应Ⅴ:
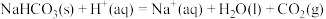

则

 (填“>”、“<”或“=”,下同),
(填“>”、“<”或“=”,下同),
 。
。
您最近一年使用:0次
名校
解题方法
8 . 甲醇制烯烃(MTO)是煤制烯烃工艺路线的核心技术。煤制烯烃主要包括煤的气化、液化、烯烃化三个阶段。
(1)煤的液化发生的主要反应之一为
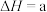 kJ⋅mol
kJ⋅mol ,在不同温度下,K(500°C)
,在不同温度下,K(500°C)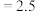 (mol⋅L
(mol⋅L ),K(700°C)
),K(700°C)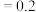 (mol⋅L
(mol⋅L )
)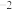 。
。
①
___________ 0(填“>”、“<”、“=”)。
②若反应在容积为2L的密闭容器中进行,500℃测得某一时刻体系内 、CO、
、CO、 物质的量分别为2 mol、1 mol、3 mol,则此时生成
物质的量分别为2 mol、1 mol、3 mol,则此时生成 的速率
的速率___________ 消耗 的速率(填“>”、“<”、“=”)。
的速率(填“>”、“<”、“=”)。
(2)通过研究外界条件对反应的影响,尽可能提高甲醇生成乙烯或丙烯的产率。
甲醇制烯烃的主要反应有:
Ⅰ.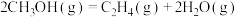
 kJ⋅mol
kJ⋅mol
Ⅱ.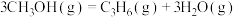
 kJ⋅mol
kJ⋅mol
Ⅲ.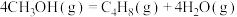
 kJ⋅mol
kJ⋅mol
① 转化为
转化为 的热化学方程式为Ⅳ:
的热化学方程式为Ⅳ: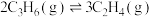
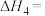
___________ 。
②加入 作为稀释剂,反应Ⅰ中
作为稀释剂,反应Ⅰ中 的产率将
的产率将___________ (填“增大”、“减小”或“不变”)。
(3)为研究不同条件对反应的影响,测得不同温度下平衡时 、
、 和
和 的物质的量分数变化,如图所示:
的物质的量分数变化,如图所示:
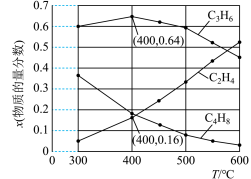
①随着温度的升高, 的物质的量分数呈现先增大后减小的趋势。温度高于400℃时,原因是
的物质的量分数呈现先增大后减小的趋势。温度高于400℃时,原因是___________ 。
②体系总压为0.1 MPa,400℃时反应Ⅳ的平衡常数
___________ 。
(1)煤的液化发生的主要反应之一为

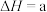 kJ⋅mol
kJ⋅mol ,在不同温度下,K(500°C)
,在不同温度下,K(500°C)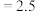 (mol⋅L
(mol⋅L ),K(700°C)
),K(700°C)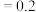 (mol⋅L
(mol⋅L )
)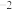 。
。①

②若反应在容积为2L的密闭容器中进行,500℃测得某一时刻体系内
 、CO、
、CO、 物质的量分别为2 mol、1 mol、3 mol,则此时生成
物质的量分别为2 mol、1 mol、3 mol,则此时生成 的速率
的速率 的速率(填“>”、“<”、“=”)。
的速率(填“>”、“<”、“=”)。(2)通过研究外界条件对反应的影响,尽可能提高甲醇生成乙烯或丙烯的产率。
甲醇制烯烃的主要反应有:
Ⅰ.
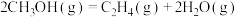
 kJ⋅mol
kJ⋅mol
Ⅱ.
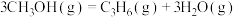
 kJ⋅mol
kJ⋅mol
Ⅲ.
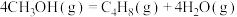
 kJ⋅mol
kJ⋅mol
①
 转化为
转化为 的热化学方程式为Ⅳ:
的热化学方程式为Ⅳ: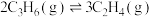
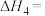
②加入
 作为稀释剂,反应Ⅰ中
作为稀释剂,反应Ⅰ中 的产率将
的产率将(3)为研究不同条件对反应的影响,测得不同温度下平衡时
 、
、 和
和 的物质的量分数变化,如图所示:
的物质的量分数变化,如图所示:
①随着温度的升高,
 的物质的量分数呈现先增大后减小的趋势。温度高于400℃时,原因是
的物质的量分数呈现先增大后减小的趋势。温度高于400℃时,原因是②体系总压为0.1 MPa,400℃时反应Ⅳ的平衡常数

您最近一年使用:0次
名校
解题方法
9 . 下列叙述不正确的是
| A.物质发生化学变化一定会伴有能量的变化 |
| B.可逆反应的ΔH表示完全反应时的热量变化,与反应是否可逆无关 |
| C.水蒸气变为液态水时放出的能量就是该变化的反应热 |
| D.同温同压下,反应H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的ΔH相同 |
您最近一年使用:0次
名校
解题方法
10 . 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:
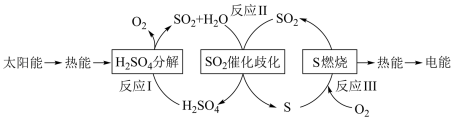
(1)反应I: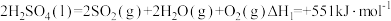
反应Ⅲ: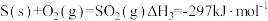
①反应I在_______ (填“高温”“低温”“任何温度”)条件下易自发进行。
②反应Ⅱ的热化学方程式:_______ 。
(2) 可以作为水溶液中
可以作为水溶液中 歧化反应的催化剂,可能的催化过程如下。将ⅱ补充完整。
歧化反应的催化剂,可能的催化过程如下。将ⅱ补充完整。
i.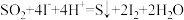
ⅱ.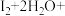
_______ 
_______ +_______ 
(3)探究(2)中i、ii反应速率与 歧化反应速率的关系,实验如下:分别将
歧化反应速率的关系,实验如下:分别将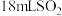 饱和溶液加入到
饱和溶液加入到 下列试剂中,密闭放置观察现象。(已知:
下列试剂中,密闭放置观察现象。(已知: 易溶解在
易溶解在 溶液中)
溶液中)
①B是A的对比实验,则
_______ 。
②比较A、B、C,可得出的结论是_______ 。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因_______ 。

(1)反应I:
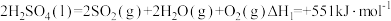
反应Ⅲ:
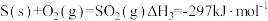
①反应I在
②反应Ⅱ的热化学方程式:
(2)
 可以作为水溶液中
可以作为水溶液中 歧化反应的催化剂,可能的催化过程如下。将ⅱ补充完整。
歧化反应的催化剂,可能的催化过程如下。将ⅱ补充完整。i.
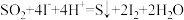
ⅱ.
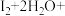


(3)探究(2)中i、ii反应速率与
 歧化反应速率的关系,实验如下:分别将
歧化反应速率的关系,实验如下:分别将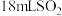 饱和溶液加入到
饱和溶液加入到 下列试剂中,密闭放置观察现象。(已知:
下列试剂中,密闭放置观察现象。(已知: 易溶解在
易溶解在 溶液中)
溶液中)| A | B | C | D | |
| 试剂组成 | 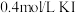 | 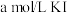 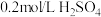 | 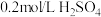 | 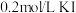 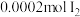 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色变成黄色,出现浑浊较A快 |

②比较A、B、C,可得出的结论是
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因
您最近一年使用:0次



