2010·上海浦东新·一模
1 . 已知石墨和金刚石燃烧的热化学方程式如下:
C(石墨,s)+O2(g) → CO2(g) -393.8 kJ ;C(金刚石,s)+O2(g) → CO2(g) -395.2 kJ
下列说法中正确的是
C(石墨,s)+O2(g) → CO2(g) -393.8 kJ ;C(金刚石,s)+O2(g) → CO2(g) -395.2 kJ
下列说法中正确的是
| A.石墨燃烧得到的CO2分子能量大于金刚石燃烧得到的CO2分子能量 |
| B.相同条件下,石墨比金刚石稳定 |
| C.等质量的石墨储存的能量大于金刚石 |
| D.石墨转化为金刚石是一个放热过程 |
您最近一年使用:0次
9-10高二下·福建福州·期中
2 . (1)经测定,20g氢气在氧气中燃烧生成水蒸气,放热2418.0kJ,写出该反应的热化学方程式_____________________________________ ;
已知:3Fe (s)+2O2(g)="=" Fe3O4(s) △H=-1118.4kJ• mol—1,根据以上信息,则反应 3Fe(s)+4H2O(g)==Fe3O4(s)+4H2(g) 的△H=_______________________ ,该反应达平衡时,化学平衡常数表达式K=___________________________ 。
(2)某学生实验小组用50mL0.50mol•L—1的盐酸与50mL0.50mol•L—1的NaOH溶液在下图所示的装置中进行中和反应反应热的测定
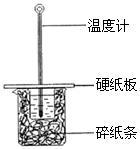
①图中装置缺少的一种仪器,该仪器名称为_____ 。
②将反应混合液的____ 温度记为反应的终止温度。
③下列说法正确的是_____________
A.小烧杯内残留有水,会使测得的反应热数值偏小
B.酸、碱混合时,应把量筒中的溶液缓缓倒入烧杯的溶液中,以防液体外溅
C.烧杯间填满碎纸条的作用是固定小烧杯
D.可用相同浓度和体积的醋酸代替稀盐酸溶液进行实验
已知:3Fe (s)+2O2(g)="=" Fe3O4(s) △H=-1118.4kJ• mol—1,根据以上信息,则反应 3Fe(s)+4H2O(g)==Fe3O4(s)+4H2(g) 的△H=
(2)某学生实验小组用50mL0.50mol•L—1的盐酸与50mL0.50mol•L—1的NaOH溶液在下图所示的装置中进行中和反应反应热的测定


①图中装置缺少的一种仪器,该仪器名称为
②将反应混合液的
③下列说法正确的是
A.小烧杯内残留有水,会使测得的反应热数值偏小
B.酸、碱混合时,应把量筒中的溶液缓缓倒入烧杯的溶液中,以防液体外溅
C.烧杯间填满碎纸条的作用是固定小烧杯
D.可用相同浓度和体积的醋酸代替稀盐酸溶液进行实验
您最近一年使用:0次
3 . 已知下列热化学方程式:
① Fe2O3(s) + 3CO(g) = 2Fe(s) + 3CO2(g) △H= -25kJ·mol-1
② 3Fe2O3(s) + CO(g) = 2Fe3O4(s) + CO2(g) △H= - 47kJ·mol-1
则下列关于Fe3O4(s)被CO还原成Fe(s)和CO2的热化学方程式的书写中正确的是
① Fe2O3(s) + 3CO(g) = 2Fe(s) + 3CO2(g) △H= -25kJ·mol-1
② 3Fe2O3(s) + CO(g) = 2Fe3O4(s) + CO2(g) △H= - 47kJ·mol-1
则下列关于Fe3O4(s)被CO还原成Fe(s)和CO2的热化学方程式的书写中正确的是
| A.Fe3O4 + 4CO = 3Fe + 4CO2△H= -14kJ·mol-1 |
| B.Fe3O4(s) + 4CO(g) = 3Fe(s) + 4CO2(g)△H= -22kJ·mol-1 |
| C.Fe3O4(s) + 4CO(g) = 3Fe(s) + 4CO2(g)△H= +14kJ·mol-1 |
| D.Fe3O4(s) + 4CO(g) = 3Fe(s) + 4CO2(g)△H= -14kJ·mol-1 |
您最近一年使用:0次
2016-05-23更新
|
172次组卷
|
6卷引用:2015-2016学年福建省大田一中高二上学期期中考试化学试卷
11-12高二上·福建泉州·期中
解题方法
4 . 将煤转化为水煤气(CO和H2的混合气体)是通过化学方法将煤转化为洁净燃料的方法之一。煤转化为水煤气的主要化学反应为:C(s) + H2O(g)=CO(g) + H2(g);△H1。 已知:
①2H2(g) + O2(g) = 2H2O(g);△H2=-483.6kJ·mol-1
②2C(s) + O2(g) = 2 CO(g); △H3=-221.0kJ·mol-1
结合上述热化学方程式,计算得出△H1=_____________ 。
①2H2(g) + O2(g) = 2H2O(g);△H2=-483.6kJ·mol-1
②2C(s) + O2(g) = 2 CO(g); △H3=-221.0kJ·mol-1
结合上述热化学方程式,计算得出△H1=
您最近一年使用:0次
11-12高二上·福建·期中
5 . (1)已知①C2H5OH(g)+3O2(g)==2CO2(g)+3H2O(g) △H1=akJ·mol-1;
②H2O(g)==H2O(1) △H2=bkJ·mol-1;
③C2H5OH(g)==C2H5OH(1) △H3=ckJ·mol-1,
写出 C2H5OH(1)完全燃烧生成CO2(g)和H2O(1)的热化学方程式__________________
(2)已知下列热化学方程式:
① H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ/mol
② C(s)+1/2O2(g)=CO(g) ΔH=-110.5 kJ/moL
则水煤气能源的制取原理:C(s)+H2O(g)=H2(g)+CO (g) ΔH=______ kJ/moL
②H2O(g)==H2O(1) △H2=bkJ·mol-1;
③C2H5OH(g)==C2H5OH(1) △H3=ckJ·mol-1,
写出 C2H5OH(1)完全燃烧生成CO2(g)和H2O(1)的热化学方程式
(2)已知下列热化学方程式:
① H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ/mol
② C(s)+1/2O2(g)=CO(g) ΔH=-110.5 kJ/moL
则水煤气能源的制取原理:C(s)+H2O(g)=H2(g)+CO (g) ΔH=
您最近一年使用:0次
11-12高二上·福建福州·阶段练习
6 . 同素异形体相互转化的反应热相当少而且转化速率较慢,有时还很不完全,测定反应热很困难,现在可根据盖斯定律进行计算。
已知:P4(固体.白磷)+5O2(气体)= P4O10(固体) △H=-2983.2kJ·mol-1①
P(固体.红磷)+5/4 O2(气体)=1/4 P4O10(固体) △H=-738.5kJ·mol-1②
由热化学方程式来看,更稳定的磷的同素异形体是_______ 。试写出白磷转化为红磷的热化学方程式________________________ 。
已知:P4(固体.白磷)+5O2(气体)= P4O10(固体) △H=-2983.2kJ·mol-1①
P(固体.红磷)+5/4 O2(气体)=1/4 P4O10(固体) △H=-738.5kJ·mol-1②
由热化学方程式来看,更稳定的磷的同素异形体是
您最近一年使用:0次
10-11高二上·福建厦门·阶段练习
7 . 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
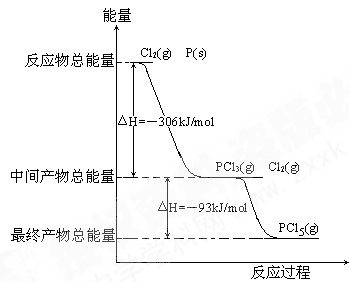
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式______________________________ 。
(2)PCl5分解成PCl3和Cl2的热化学方程式______________________________ ,上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80molPCl5,反应达到平衡时PCl5还剩0.60mol,其分解率α1[分解率即分解量除起始量]等于___________ ;。
(3)P和Cl2分两步反应生成1molPCl5的△H3=_________ ,P和Cl2一步反应生成1molPCl5的△H4______ △H3(填“大于”、“小于”或“等于”)。
(4)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是_____________ 。

根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式
(2)PCl5分解成PCl3和Cl2的热化学方程式
(3)P和Cl2分两步反应生成1molPCl5的△H3=
(4)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是
您最近一年使用:0次
9-10高二下·福建·期末
8 . 已知25℃、101kpa时,一些物质的燃烧热为:
(1)写出该条件下CH3OH(l)完全燃烧的热化学方程式:_____________ 。
(2)根据盖斯定律完成下列热化学方程式CO(g)+ 2H2(g)= CH3OH(l) △H=__________ 。
| 化学式 | CO(g) | H2(g) | CH3OH(l) |
| △H/(kJ/mol) | -283.0 | -285.8 | -726.5 |
(1)写出该条件下CH3OH(l)完全燃烧的热化学方程式:
(2)根据盖斯定律完成下列热化学方程式CO(g)+ 2H2(g)= CH3OH(l) △H=
您最近一年使用:0次
真题
9 . W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数一次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的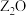 和黑色的ZO两种氧化物。
和黑色的ZO两种氧化物。
(1)W位于元素周期表第_________ 周期第_________ 族。W的气态氢化物稳定性比

__________ (填“强”或“弱”)。
(2)Y的基态原子核外电子排布式是________ ,Y的第一电离能比X的__________ (填“大”或“小”)。
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
_________________________________________________________________________ 。
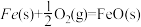
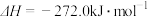
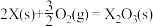
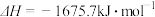
X的单质和FeO反应的热化学方程式是_________________________________________ 。
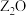 和黑色的ZO两种氧化物。
和黑色的ZO两种氧化物。(1)W位于元素周期表第

(2)Y的基态原子核外电子排布式是
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
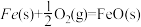
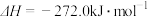
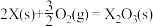
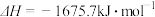
X的单质和FeO反应的热化学方程式是
您最近一年使用:0次



