名校
解题方法
1 . 向 溶液中滴加盐酸,反应过程中能量变化如下图所示,下列说法正确的是
溶液中滴加盐酸,反应过程中能量变化如下图所示,下列说法正确的是

 溶液中滴加盐酸,反应过程中能量变化如下图所示,下列说法正确的是
溶液中滴加盐酸,反应过程中能量变化如下图所示,下列说法正确的是
A.反应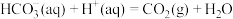 (1)为放热反应 (1)为放热反应 |
B. |
C.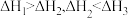 |
D. (1),若使用催化剂,则 (1),若使用催化剂,则 变小 变小 |
您最近一年使用:0次
2021-12-21更新
|
856次组卷
|
26卷引用:福建省泉州市第七中学 2020-2021学年高二上学期期中考试化学试题
福建省泉州市第七中学 2020-2021学年高二上学期期中考试化学试题宁夏银川一中2017-2018学年高二上学期第二次月考理综化学试题河北安平中学2018-2019学年高二下学期期末考试化学试题江西省南昌市新建县第一中学2019-2020学年高二上学期第一次月考化学试题(共建部)安徽省滁州市定远县炉桥中学2019-2020学年高二上学期第一次检测化学试题安徽省芜湖市2019-2020学年高二上学期期末考试化学(理)试题湖南省衡阳市第八中学2019-2020学年高二下学期期中考试化学试题鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第1章 综合检测陕西省西安市第八十九中学2018-2019学年高二上学期期中考试化学试题江西省彭泽县第一中学2020-2021学年高二上学期第一次月考化学试题江西省吉安县立中学2020-2021学年高二上学期期中考试化学试题辽宁省庄河市高级中学2021-2022学年高二上学期开学考试化学试题浙江省温州市2021-2022学年高二上学期12月普通高中学考适应性测试化学试题新疆乌鲁木齐第四中学2021-2022学年高二上学期期中考试化学试题内蒙古乌兰察布市2021-2022学年高二上学期期末考试化学试题山东省实验中学2022-2023学年高二上学期10月月考化学试题浙江省北斗星盟2023-2024学年高二上学期12月月考化学试题2017届天津市五区县高三上学期期末考试化学试卷天津市五区县2017届高三上学期期末考试化学试卷天津市2018届高三第二学期高考模拟化学试题山东省潍坊市2019-2020学年高一下学期4月阶段考试化学试题安徽省淮南市第一中学2019-2020学年高一下学期期末考试化学试题黑龙江省八校2021届高三摸底考试化学试题新疆维吾尔自治区巴州二中2021届高三第六次月考化学试题黑龙江省佳木斯市第一中学2022-2023学年高三上学期第三次调研化学试题湖南省常德市鼎城一中2022-2023学年高三第五次月考化学试题
名校
解题方法
2 . CO2与CH4的催化重整有利于减少空气中的CO2,实现碳中和。
已知:①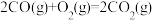 △H1=akJ·mol-1
△H1=akJ·mol-1
② △H2=bkJ·mol-1
△H2=bkJ·mol-1
③ △H3=ckJ·mol-1
△H3=ckJ·mol-1
则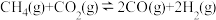 的△H4为
的△H4为
已知:①
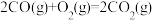 △H1=akJ·mol-1
△H1=akJ·mol-1②
 △H2=bkJ·mol-1
△H2=bkJ·mol-1③
 △H3=ckJ·mol-1
△H3=ckJ·mol-1则
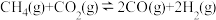 的△H4为
的△H4为| A.(-a-b+c)kJ·mol-1 | B.(a+b-c)kJ·mol-1 |
| C.(-a+b-c)kJ·mol-1 | D.(a-b-c)kJ·mol-1 |
您最近一年使用:0次
2023-08-31更新
|
259次组卷
|
3卷引用:福建省部分名校2023-2024学年高二上学期入学联考化学试题
名校
3 . I.科学家已实现反应 。
。
某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.4 mol NO和0.4 mol CO,在三种 不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间变化如图所示。
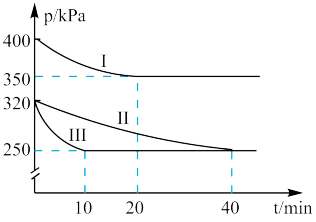
(1)①与实验II相比,实验I和实验III分别仅改变一种反应条件,所改变的条件分别为:实验I___________ ,实验III___________ 。
②三组实验中CO的平衡转化率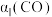 、
、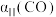 和
和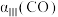 的大小关系为
的大小关系为___________ 。
③实验III的平衡常数
___________ 。
II.已知 分解成水和氧气放出热量,在少量
分解成水和氧气放出热量,在少量 作用下,常温时能剧烈分解,
作用下,常温时能剧烈分解, 分解的机理分为两步基元反应,第一步为:
分解的机理分为两步基元反应,第一步为: (慢反应,
(慢反应, )、第二步略(快反应)。
)、第二步略(快反应)。
(2)请补充第二步反应方程式:___________ 。
(3)在如图中分别画出无加入 和有加入
和有加入 的反应能量变化示意图(大致曲线)
的反应能量变化示意图(大致曲线) _______ 。

 。
。某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.4 mol NO和0.4 mol CO,在三种 不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间变化如图所示。

(1)①与实验II相比,实验I和实验III分别仅改变一种反应条件,所改变的条件分别为:实验I
②三组实验中CO的平衡转化率
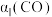 、
、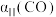 和
和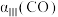 的大小关系为
的大小关系为③实验III的平衡常数

II.已知
 分解成水和氧气放出热量,在少量
分解成水和氧气放出热量,在少量 作用下,常温时能剧烈分解,
作用下,常温时能剧烈分解, 分解的机理分为两步基元反应,第一步为:
分解的机理分为两步基元反应,第一步为: (慢反应,
(慢反应, )、第二步略(快反应)。
)、第二步略(快反应)。(2)请补充第二步反应方程式:
(3)在如图中分别画出无加入
 和有加入
和有加入 的反应能量变化示意图(大致曲线)
的反应能量变化示意图(大致曲线) 
您最近一年使用:0次
2022-08-30更新
|
342次组卷
|
3卷引用:福建省龙岩市第一中学2022-2023学年高二上学期第一次月考(实验班)化学试题
名校
4 . 已知下列反应:
SO2(g)+2OH‑(aq)= (aq)+H2O(1) ΔH1
(aq)+H2O(1) ΔH1
ClO-(aq)+ (aq)=
(aq)= (aq)+Cl-(aq) ΔH2
(aq)+Cl-(aq) ΔH2
CaSO4(s)=Ca2+(aq)+ (aq) ΔH3
(aq) ΔH3
则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)=CaSO4(s)+H2O(1)+Cl-(aq)的ΔH为
SO2(g)+2OH‑(aq)=
 (aq)+H2O(1) ΔH1
(aq)+H2O(1) ΔH1ClO-(aq)+
 (aq)=
(aq)= (aq)+Cl-(aq) ΔH2
(aq)+Cl-(aq) ΔH2CaSO4(s)=Ca2+(aq)+
 (aq) ΔH3
(aq) ΔH3则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)=CaSO4(s)+H2O(1)+Cl-(aq)的ΔH为
| A.ΔH1+ΔH2+ΔH3 | B.ΔH1+ΔH2-ΔH3 |
| C.ΔH1-ΔH2+ΔH3 | D.ΔH3-ΔH1+ΔH2 |
您最近一年使用:0次
2021-08-05更新
|
617次组卷
|
3卷引用:福建省泉州科技中学2021-2022学年高二上学期第一次月考化学试题
名校
5 . 多晶硅是制作光伏电池的关键材料。以下是由粗硅制备多晶硅的简易过程。

回答下列问题:
(1)硅粉与HCl在300℃时反应生成SiHCl3气体和H2,当有1gSi反应时放出8.4kJ热量,该反应的热化学方程式为____ 。
(2)将SiCl4氢化为SiHCl3有三种方法,对应的反应依次为:
①SiCl4(g)+H2(g) SiHCl3(g)+HCl(g) △H1>0
SiHCl3(g)+HCl(g) △H1>0
②3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g) △H2<0
4SiHCl3(g) △H2<0
③2SiCl4(g)+H2(g)+Si(s)+HCl(g) 3SiHCl3(g) △H3
3SiHCl3(g) △H3
反应③的△H3____ 0(填“>”或“<”)。
(3)由粗硅制备多晶硅过程中循环使用的物质除SiCl4、SiHCl3、Si外,还有____ (填化学式)。
(4)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能,利用键能可以衡量化学键的强弱,也可以计算化学反应的焓变。已知:
则SiO2与SiC中比较稳定的是____ (填化学式),工业上高纯硅可以通过下列反应制取:SiCl4(g)+2H2(g)=Si(s)+4HCl(g),该反应的△H=____ 。(提示:1mol晶体Si中含有2molSi-Si键)

回答下列问题:
(1)硅粉与HCl在300℃时反应生成SiHCl3气体和H2,当有1gSi反应时放出8.4kJ热量,该反应的热化学方程式为
(2)将SiCl4氢化为SiHCl3有三种方法,对应的反应依次为:
①SiCl4(g)+H2(g)
 SiHCl3(g)+HCl(g) △H1>0
SiHCl3(g)+HCl(g) △H1>0②3SiCl4(g)+2H2(g)+Si(s)
 4SiHCl3(g) △H2<0
4SiHCl3(g) △H2<0③2SiCl4(g)+H2(g)+Si(s)+HCl(g)
 3SiHCl3(g) △H3
3SiHCl3(g) △H3反应③的△H3
(3)由粗硅制备多晶硅过程中循环使用的物质除SiCl4、SiHCl3、Si外,还有
(4)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能,利用键能可以衡量化学键的强弱,也可以计算化学反应的焓变。已知:
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
您最近一年使用:0次
2022-09-25更新
|
266次组卷
|
4卷引用:福建省泉州第五中学2022-2023学年高二上学期期中考化学试题
名校
6 . 完成下列问题。
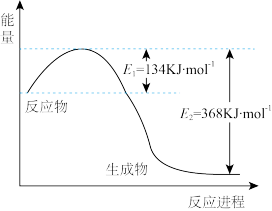
(1)下图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出CO和NO2反应的热化学方程式_______ 。
(2)常温常压下,1克乙醇完全燃烧生成CO2气体和液态水放出的热量为52.0kJ,写出乙醇燃烧热的热化学方程式:_______ 。
(3)写出硫酸和烧碱的稀溶液反应生成1摩尔水时的中和热的热化学反应方程式__________ (中和热为57.3kJ/mol)。
(4)同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:
P4(白磷,s)+5O2(g)=P4O10(s) ΔH=-2983.2kJ/mol ①
P(红磷,s)+ O2(g)=
O2(g)= P4O10(s) ΔH=-738.5kJ/mol ②
P4O10(s) ΔH=-738.5kJ/mol ②
则白磷转化为红磷的热化学方程式为_______ 。相同状况下,能量状态较低的是_______ ;白磷的稳定性比红磷_______ (填“高”或“低”)。
(5)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2 2Cl2+2H2O
2Cl2+2H2O
已知:此条件下反应A中,4molHCl被氧化,放出115.6kJ的热量。
①写出此条件下,反应A的热化学方程式_______ 。
②断开1molH-O键与断开1molH-Cl键所需能量相差约为_______ kJ,H2O中H-O键比HCl中H-Cl键_______ (填“强”或“弱”)。
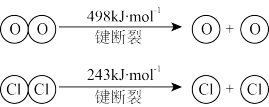
(1)下图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出CO和NO2反应的热化学方程式

(2)常温常压下,1克乙醇完全燃烧生成CO2气体和液态水放出的热量为52.0kJ,写出乙醇燃烧热的热化学方程式:
(3)写出硫酸和烧碱的稀溶液反应生成1摩尔水时的中和热的热化学反应方程式
(4)同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:
P4(白磷,s)+5O2(g)=P4O10(s) ΔH=-2983.2kJ/mol ①
P(红磷,s)+
 O2(g)=
O2(g)= P4O10(s) ΔH=-738.5kJ/mol ②
P4O10(s) ΔH=-738.5kJ/mol ②则白磷转化为红磷的热化学方程式为
(5)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2
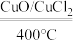 2Cl2+2H2O
2Cl2+2H2O已知:此条件下反应A中,4molHCl被氧化,放出115.6kJ的热量。
①写出此条件下,反应A的热化学方程式
②断开1molH-O键与断开1molH-Cl键所需能量相差约为
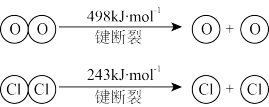
您最近一年使用:0次
2022-09-08更新
|
283次组卷
|
2卷引用:福建省厦门市松柏中学2023-2024学年高二上学期10月月考化学试题
解题方法
7 . 甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以接用作燃料。
已知:
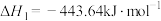
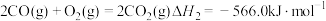
(1)试写出CH3OH(l)在氧气中完全燃烧生成CO2和H2O(g)的热化学方程式:___________ 。
(2)某公司开发了一种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。其中B电极的电极材料为碳,如图是一个电化学过程的示意图。请填空:
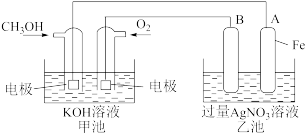
①放电时,甲醇在___________ (填“正”或“负”)极发生反应,正极的电极反应为___________
②工作时,B极的电极反应式为___________ ,A极的电极反应式为___________
(3)某同学设计了一种用电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法不正确的是___________(填序号)。

已知:

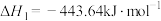
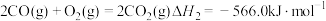
(1)试写出CH3OH(l)在氧气中完全燃烧生成CO2和H2O(g)的热化学方程式:
(2)某公司开发了一种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。其中B电极的电极材料为碳,如图是一个电化学过程的示意图。请填空:

①放电时,甲醇在
②工作时,B极的电极反应式为
(3)某同学设计了一种用电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法不正确的是___________(填序号)。

| A.a为电源正极,b为电源负极 |
| B.可以用NaCl溶液作为电解质溶液 |
| C.A、B两端都必须用铁作电极 |
D.阴极发生的反应为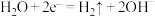 |
您最近一年使用:0次
8 . 合成氨技术的发明使工业化人工固氮成为现实。请回答下列问题:
(1)合成氨的反应为:2NH3(g) N2(g)+3H2(g),有关化学键的键能如表所示。
N2(g)+3H2(g),有关化学键的键能如表所示。
①该反应的反应热ΔH=_______ 。
②已知该反应的ΔS=198.9 J·mol−1·K−1,在下列哪些温度下反应能自发进行?_______ (填标号)
A.25℃ B.125℃ C.225℃ D.325℃
(2)在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为3.0 mol。
①达平衡时,H2的转化率α=_______ 。
②已知平衡时,容器压强为8 MPa,则平衡常数Kp=_______ (用平衡分压代替浓度计算,分压=总压×物质的量分数)。
(3)利用电解原理,将氨转化为高纯氢气,其装置如图所示。
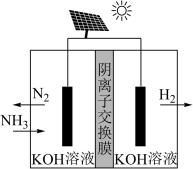
①阴极产生标准状况下112mL气体时,通过阴离子交换膜的离子的物质的量为_______ ;
②阳极的电极反应式为_______ 。
(1)合成氨的反应为:2NH3(g)
 N2(g)+3H2(g),有关化学键的键能如表所示。
N2(g)+3H2(g),有关化学键的键能如表所示。| 化学键 |  |  |  |
| 键能E/ kJ·mol−1 | 946 | 436.0 | 390.8 |
②已知该反应的ΔS=198.9 J·mol−1·K−1,在下列哪些温度下反应能自发进行?
A.25℃ B.125℃ C.225℃ D.325℃
(2)在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为3.0 mol。
①达平衡时,H2的转化率α=
②已知平衡时,容器压强为8 MPa,则平衡常数Kp=
(3)利用电解原理,将氨转化为高纯氢气,其装置如图所示。

①阴极产生标准状况下112mL气体时,通过阴离子交换膜的离子的物质的量为
②阳极的电极反应式为
您最近一年使用:0次
2022-09-06更新
|
281次组卷
|
3卷引用:福建省宁德市部分达标中学2021-2022学年高二上学期期中联合考试化学试题
名校
解题方法
9 . 下列关于热化学方程式的叙述正确的是
| A.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定 |
| B.已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ•mol -1,则H2燃烧热为241.8kJ•mol -1 |
| C.S(g)+O2(g) =SO2(g) ΔH1;S(s)+O2(g) =SO2(g) ΔH2 则ΔH1 < ΔH2 |
| D.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ•mol-1,若将0.5 mol •L -1的稀 H2SO4与1 mol •L -1的NaOH的溶液等体积混合,放出的热量等于57.3 kJ |
您最近一年使用:0次
2020-01-24更新
|
994次组卷
|
7卷引用:福建省永安市第九中学2022-2023学年高二上学期9月月考化学试题
10 . 依据图示关系,下列说法不正确的是
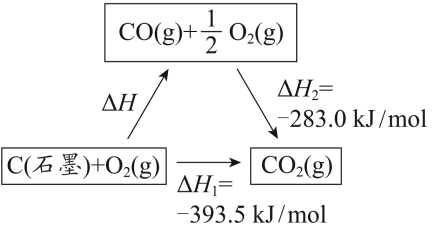

| A.石墨燃烧是放热反应 |
| B.1molC(石墨)和 1molCO 分别在足量 O2中燃烧, 全部转化为 CO2,前者放热多 |
| C.ΔH=ΔH1+ΔH2 |
| D.化学反应的ΔH,只与反应体系的始态和终态有关,与反应途径无关 |
您最近一年使用:0次
2023-08-19更新
|
275次组卷
|
3卷引用:福建省龙岩市一级校联盟2023-2024学年高二上学期11月期中考试化学试题
福建省龙岩市一级校联盟2023-2024学年高二上学期11月期中考试化学试题重庆市大足中学2021-2022学年高二上学期第一次月考化学试题(已下线)专题02 盖斯定律、反应热的计算【考点清单】(讲+练)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)



