1 . 合成是转化的一种应用,甲醇作为一种可再生能源,工业上一般采用下列两种反应合成甲醇:
反应一:CO(g)+2H2(g) CH3OH(g)ΔH1
CH3OH(g)ΔH1
反应二:CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH2
CH3OH(g)+H2O(g)ΔH2
(1)相同条件下,反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH3,则ΔH3=
CO(g)+H2O(g) ΔH3,则ΔH3=___________ (用ΔH1和ΔH2表示)。
(2)下表所列数据是反应CO(g)+2H2(g) CH3OH(g) ΔH1在不同温度下的化学平衡常数(K)。
CH3OH(g) ΔH1在不同温度下的化学平衡常数(K)。
①此反应的ΔH1___________ 0,ΔS___________ 0.(填“>”“=”或“<”)
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率是___________ ,此时的温度是___________ 。
③要提高CO的转化率,可以采取的措施是___________ 。
A.升温 B.恒容充入CO C.恒容充入H2 D.恒压充入惰性气体 E.分离出甲醇
(3)在水溶液中电解CO2生成甲醇的原理如图所示。___________ 。
②A极生成1mol甲醇时,B极生成气体在标准状况下的体积是___________ 。
反应一:CO(g)+2H2(g)
 CH3OH(g)ΔH1
CH3OH(g)ΔH1反应二:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)ΔH2
CH3OH(g)+H2O(g)ΔH2(1)相同条件下,反应CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH3,则ΔH3=
CO(g)+H2O(g) ΔH3,则ΔH3=(2)下表所列数据是反应CO(g)+2H2(g)
 CH3OH(g) ΔH1在不同温度下的化学平衡常数(K)。
CH3OH(g) ΔH1在不同温度下的化学平衡常数(K)。| 温度/℃ | 250 | 300 | 350 |
| 平衡常数(K) | 2.04 | 0.27 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率是
③要提高CO的转化率,可以采取的措施是
A.升温 B.恒容充入CO C.恒容充入H2 D.恒压充入惰性气体 E.分离出甲醇
(3)在水溶液中电解CO2生成甲醇的原理如图所示。

②A极生成1mol甲醇时,B极生成气体在标准状况下的体积是
您最近一年使用:0次
2 . 含氮化合物中,NOx、 、
、 等是环境污染物,需要消除其污染;HNO3、NH3等物质又是极其重要的化工原料。
等是环境污染物,需要消除其污染;HNO3、NH3等物质又是极其重要的化工原料。
Ⅰ.苯酚(C6H5OH)是一种广泛使用、易氧化的化工产品。一种在650K下用N2O废气催化氧化苯制备苯酚的新方法为: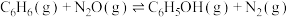 。
。
(1)已知: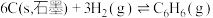 △H1=+82.9 kJ⋅mol
△H1=+82.9 kJ⋅mol
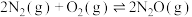 △H2=+163.2 kJ⋅mol-1
△H2=+163.2 kJ⋅mol-1
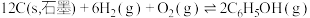 △H3=-243 kJ⋅mol-1
△H3=-243 kJ⋅mol-1
则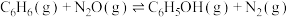 △H=
△H=___________ 。
Ⅱ.在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮( ),以达到降低溶液中含氮量、消除污染的目的,其工作原理如图所示。
),以达到降低溶液中含氮量、消除污染的目的,其工作原理如图所示。
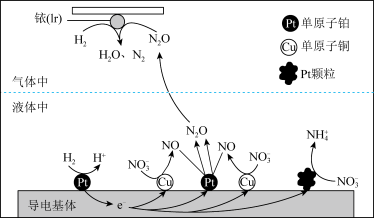
(2) 被H2还原为N2的过程可描述为:液体中H2在导电基体的单原子铂上失去电子生成
被H2还原为N2的过程可描述为:液体中H2在导电基体的单原子铂上失去电子生成 ,电子进入导电基体中进行传导,
,电子进入导电基体中进行传导,___________ 。
(3)若导电基体上的Pt颗粒增多,造成的后果是___________ 。
(4)单原子铂催化剂相比于Pt颗粒催化剂,优点有___________ 。
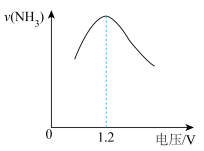
Ⅲ.科研人员发现利用低温固体质子导体作电解质,催化合成NH3,与传统的热催化合成氨相比,催化效率较高。其合成原理如图所示。

(5)P-C3N4是___________ (填电极名称),电极反应式为___________ 。
(6)电源电压改变与生成NH3速率的关系如图所示。其他条件不变时,逐渐增大电压,氨生成速率加快,当电压高于1.2eV时,氨生成速率下降,其可能的原因是__________ 。(用电极反应式表示)
 、
、 等是环境污染物,需要消除其污染;HNO3、NH3等物质又是极其重要的化工原料。
等是环境污染物,需要消除其污染;HNO3、NH3等物质又是极其重要的化工原料。Ⅰ.苯酚(C6H5OH)是一种广泛使用、易氧化的化工产品。一种在650K下用N2O废气催化氧化苯制备苯酚的新方法为:
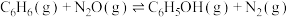 。
。(1)已知:
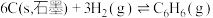 △H1=+82.9 kJ⋅mol
△H1=+82.9 kJ⋅mol
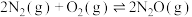 △H2=+163.2 kJ⋅mol-1
△H2=+163.2 kJ⋅mol-1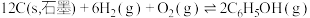 △H3=-243 kJ⋅mol-1
△H3=-243 kJ⋅mol-1则
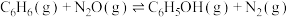 △H=
△H=Ⅱ.在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(
 ),以达到降低溶液中含氮量、消除污染的目的,其工作原理如图所示。
),以达到降低溶液中含氮量、消除污染的目的,其工作原理如图所示。
(2)
 被H2还原为N2的过程可描述为:液体中H2在导电基体的单原子铂上失去电子生成
被H2还原为N2的过程可描述为:液体中H2在导电基体的单原子铂上失去电子生成 ,电子进入导电基体中进行传导,
,电子进入导电基体中进行传导,(3)若导电基体上的Pt颗粒增多,造成的后果是
(4)单原子铂催化剂相比于Pt颗粒催化剂,优点有
Ⅲ.科研人员发现利用低温固体质子导体作电解质,催化合成NH3,与传统的热催化合成氨相比,催化效率较高。其合成原理如图所示。

(5)P-C3N4是
(6)电源电压改变与生成NH3速率的关系如图所示。其他条件不变时,逐渐增大电压,氨生成速率加快,当电压高于1.2eV时,氨生成速率下降,其可能的原因是

您最近一年使用:0次
名校
解题方法
3 . 我国要在2030年前实现碳达峰、2060年前实现碳中和的目标, 的捕集与转化是研究的重要课题。
的捕集与转化是研究的重要课题。

(1) 和
和 重整可制合成气CO和
重整可制合成气CO和 ,其热化学反应方程式为
,其热化学反应方程式为
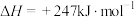 。已知下列热化学反应方程式:
。已知下列热化学反应方程式:
反应1: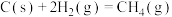

反应2:
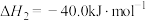
反应3:
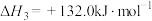
则
_____  。
。
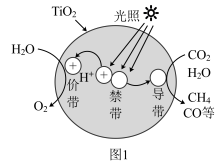
(2)光催化还原法实现 甲烷化可能的反应机理如图1所示。该过程可简述为:光照条件下,催化剂
甲烷化可能的反应机理如图1所示。该过程可简述为:光照条件下,催化剂 表面的价带(VB)中失去的电子(图中电子以
表面的价带(VB)中失去的电子(图中电子以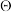 表示)激发至导带(CB)中,价带中形成电子空穴
表示)激发至导带(CB)中,价带中形成电子空穴 (图中
(图中 以
以 表示,
表示, 具有强氧化性),
具有强氧化性), 在VB端,
在VB端, 在CB端发生类似于电解原理的反应。
在CB端发生类似于电解原理的反应。
①在价带的电极反应式为_____ 。
②在催化剂 表面,每生成
表面,每生成 ,则价带产生的空穴
,则价带产生的空穴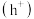 数为
数为_____  。
。
(3)一种电化学法将 转化为乙烯的原理如图2所示。
转化为乙烯的原理如图2所示。
①阴极上的电极反应式为_____ 。
②已知铅蓄电池发生的总反应为: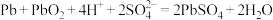 。以铅蓄电池为电源,每生成
。以铅蓄电池为电源,每生成 乙烯,理论上需消耗铅蓄电池中硫酸的物质的量为
乙烯,理论上需消耗铅蓄电池中硫酸的物质的量为_____ 。
(4) 和
和 可合成甲烷,合成过程中发生如下反应:
可合成甲烷,合成过程中发生如下反应:

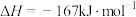


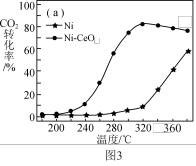
反应的压强和 与
与 气体比例一定,在两种不同催化剂条件下反应相同时间,测得
气体比例一定,在两种不同催化剂条件下反应相同时间,测得 的转化率随温度变化关系如图3所示。高于320℃后,以
的转化率随温度变化关系如图3所示。高于320℃后,以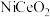 为催化剂,
为催化剂, 转化率略有下降,以Ni为催化剂,
转化率略有下降,以Ni为催化剂, 转化率大幅上升,其原因是
转化率大幅上升,其原因是_____ 。
 的捕集与转化是研究的重要课题。
的捕集与转化是研究的重要课题。


(1)
 和
和 重整可制合成气CO和
重整可制合成气CO和 ,其热化学反应方程式为
,其热化学反应方程式为
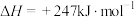 。已知下列热化学反应方程式:
。已知下列热化学反应方程式:反应1:
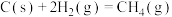

反应2:

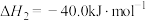
反应3:

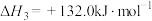
则

 。
。(2)光催化还原法实现
 甲烷化可能的反应机理如图1所示。该过程可简述为:光照条件下,催化剂
甲烷化可能的反应机理如图1所示。该过程可简述为:光照条件下,催化剂 表面的价带(VB)中失去的电子(图中电子以
表面的价带(VB)中失去的电子(图中电子以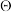 表示)激发至导带(CB)中,价带中形成电子空穴
表示)激发至导带(CB)中,价带中形成电子空穴 (图中
(图中 以
以 表示,
表示, 具有强氧化性),
具有强氧化性), 在VB端,
在VB端, 在CB端发生类似于电解原理的反应。
在CB端发生类似于电解原理的反应。①在价带的电极反应式为
②在催化剂
 表面,每生成
表面,每生成 ,则价带产生的空穴
,则价带产生的空穴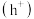 数为
数为 。
。(3)一种电化学法将
 转化为乙烯的原理如图2所示。
转化为乙烯的原理如图2所示。①阴极上的电极反应式为
②已知铅蓄电池发生的总反应为:
 。以铅蓄电池为电源,每生成
。以铅蓄电池为电源,每生成 乙烯,理论上需消耗铅蓄电池中硫酸的物质的量为
乙烯,理论上需消耗铅蓄电池中硫酸的物质的量为(4)
 和
和 可合成甲烷,合成过程中发生如下反应:
可合成甲烷,合成过程中发生如下反应:
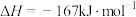


反应的压强和
 与
与 气体比例一定,在两种不同催化剂条件下反应相同时间,测得
气体比例一定,在两种不同催化剂条件下反应相同时间,测得 的转化率随温度变化关系如图3所示。高于320℃后,以
的转化率随温度变化关系如图3所示。高于320℃后,以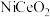 为催化剂,
为催化剂, 转化率略有下降,以Ni为催化剂,
转化率略有下降,以Ni为催化剂, 转化率大幅上升,其原因是
转化率大幅上升,其原因是
您最近一年使用:0次
名校
4 . SO2转化为SO3的反应为
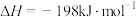 。在有、无催化剂条件下SO2氧化成SO3过程中能量的变化如图所示。450℃、V2O5催化时,该反应机理为:
。在有、无催化剂条件下SO2氧化成SO3过程中能量的变化如图所示。450℃、V2O5催化时,该反应机理为:
反应①

反应②

下列说法正确的是


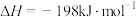 。在有、无催化剂条件下SO2氧化成SO3过程中能量的变化如图所示。450℃、V2O5催化时,该反应机理为:
。在有、无催化剂条件下SO2氧化成SO3过程中能量的变化如图所示。450℃、V2O5催化时,该反应机理为:反应①


反应②


下列说法正确的是

A. |
| B.V2O5催化时,反应②的速率大于反应① |
| C.保持其它条件不变,升高温度,活化分子百分数不变 |
| D.反应中每消耗22.4LO2,转移电子数目约等于4×6.02×1023 |
您最近一年使用:0次
2023-09-04更新
|
164次组卷
|
2卷引用:江苏省镇江市丹阳市2023-2024学年高二上学期开学考试化学试题
名校
5 .  的资源化利用和转化已成为当今科学研究的热点。
的资源化利用和转化已成为当今科学研究的热点。
(1)1902年,PaulSabatier首次报道了 的甲烷化。在一定的温度和压力条件下,将按一定比例混合的
的甲烷化。在一定的温度和压力条件下,将按一定比例混合的 和
和 通过装有金属Ni的反应器可得到
通过装有金属Ni的反应器可得到 。已知:
。已知: 和
和 的标准燃烧热分别为
的标准燃烧热分别为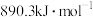 、
、 。
。 甲烷化反应
甲烷化反应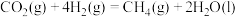 的
的
___________  。
。
(2)近年来,生物电催化技术运用微生物电解池实现了 的甲烷化,其工作原理如图所示。微生物电解池实现
的甲烷化,其工作原理如图所示。微生物电解池实现 甲烷化的阴极电极反应式为
甲烷化的阴极电极反应式为___________ 。

(3)325℃时,水在Mn粉表面产生的 可将
可将 转化成甲酸,同时生成MnO。直接加热
转化成甲酸,同时生成MnO。直接加热 与
与 难以生成甲酸,该条件下能较快生成甲酸的原因是
难以生成甲酸,该条件下能较快生成甲酸的原因是___________ 。
(4) 和环氧乙烷在MgO作催化剂的条件下合成碳酸乙烯酯。
和环氧乙烷在MgO作催化剂的条件下合成碳酸乙烯酯。
① 溶液中加入尿素
溶液中加入尿素 生成
生成 沉淀,同时有
沉淀,同时有 气体产生。该反应的离子方程式为
气体产生。该反应的离子方程式为___________ 。
② 与沉淀剂(尿素、氢氧化钠)反应生成沉淀,过滤后将沉淀焙烧得到MgO。与氢氧化钠作沉淀剂相比,用尿素作沉淀剂焙烧生成的MgO作催化剂效果更好,其原因是
与沉淀剂(尿素、氢氧化钠)反应生成沉淀,过滤后将沉淀焙烧得到MgO。与氢氧化钠作沉淀剂相比,用尿素作沉淀剂焙烧生成的MgO作催化剂效果更好,其原因是___________ 。
③MgO催化 合成碳酸乙烯酯(
合成碳酸乙烯酯( )可能的反应机理如图所示。根据元素电负性的变化规律,步骤I、II的过程可描述为
)可能的反应机理如图所示。根据元素电负性的变化规律,步骤I、II的过程可描述为___________ 。

 的资源化利用和转化已成为当今科学研究的热点。
的资源化利用和转化已成为当今科学研究的热点。(1)1902年,PaulSabatier首次报道了
 的甲烷化。在一定的温度和压力条件下,将按一定比例混合的
的甲烷化。在一定的温度和压力条件下,将按一定比例混合的 和
和 通过装有金属Ni的反应器可得到
通过装有金属Ni的反应器可得到 。已知:
。已知: 和
和 的标准燃烧热分别为
的标准燃烧热分别为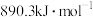 、
、 。
。 甲烷化反应
甲烷化反应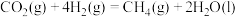 的
的
 。
。(2)近年来,生物电催化技术运用微生物电解池实现了
 的甲烷化,其工作原理如图所示。微生物电解池实现
的甲烷化,其工作原理如图所示。微生物电解池实现 甲烷化的阴极电极反应式为
甲烷化的阴极电极反应式为
(3)325℃时,水在Mn粉表面产生的
 可将
可将 转化成甲酸,同时生成MnO。直接加热
转化成甲酸,同时生成MnO。直接加热 与
与 难以生成甲酸,该条件下能较快生成甲酸的原因是
难以生成甲酸,该条件下能较快生成甲酸的原因是(4)
 和环氧乙烷在MgO作催化剂的条件下合成碳酸乙烯酯。
和环氧乙烷在MgO作催化剂的条件下合成碳酸乙烯酯。①
 溶液中加入尿素
溶液中加入尿素 生成
生成 沉淀,同时有
沉淀,同时有 气体产生。该反应的离子方程式为
气体产生。该反应的离子方程式为②
 与沉淀剂(尿素、氢氧化钠)反应生成沉淀,过滤后将沉淀焙烧得到MgO。与氢氧化钠作沉淀剂相比,用尿素作沉淀剂焙烧生成的MgO作催化剂效果更好,其原因是
与沉淀剂(尿素、氢氧化钠)反应生成沉淀,过滤后将沉淀焙烧得到MgO。与氢氧化钠作沉淀剂相比,用尿素作沉淀剂焙烧生成的MgO作催化剂效果更好,其原因是③MgO催化
 合成碳酸乙烯酯(
合成碳酸乙烯酯( )可能的反应机理如图所示。根据元素电负性的变化规律,步骤I、II的过程可描述为
)可能的反应机理如图所示。根据元素电负性的变化规律,步骤I、II的过程可描述为
您最近一年使用:0次
名校
6 . 我国提出了2030年前碳达峰、2060年前碳中和的“双碳”目标。研发二氧化碳被转化为多种基础化学品,如一氧化碳、甲烷、甲醇等是实现“双碳”目标的有效方法。二氧化碳催化加氢部分热化学反应式如下:
Ⅰ.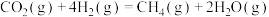
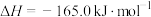
Ⅱ.
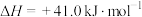
Ⅲ.
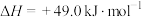
(1)二氧化碳与甲烷反应生成一氧化碳和氢气的热化学方程式为________ ;恒温恒容密闭容器中进行该反应,下列事实能说明反应达到平衡状态的是________ (填选项字母)。
A.相同时间内形成C—H键和H—H键的数目相等
B.相同时间内消耗 和形成CO的分子数目相等
和形成CO的分子数目相等
C.体系内各物质的浓度保持不变
D.体系内气体的密度保持不变
(2)消除NO污染物,在一定条件下,用 将NO还原为
将NO还原为 和
和 。
。
① 还原NO的总反应为
还原NO的总反应为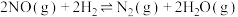 ,其能量变化如图所示。每还原1mol NO,应
,其能量变化如图所示。每还原1mol NO,应___________ (填“释放”或“吸收”)___________ kJ能量。
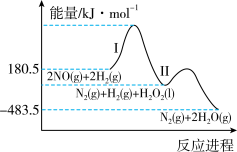
②研究表明上述反应历程分两步:
Ⅰ. ;
;
Ⅱ.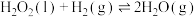
该总反应的反应物的总键能___________ (填>,<或=)生成物的总键能。
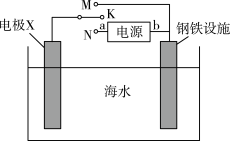
(3)电渗析法淡化海水(在直流电源作用下通过离子交换膜对海水进行处理)
①利用如图所示装置可以减缓海水中钢铁设施的腐蚀。若开关K置于M处,则电极X可选用的物质是___________ (选填“石墨块”、“锌块”或“铜块”),钢铁设施表面发生的电极反应为_______ ;若开关K置于N处,则a极为电源的________ (选填“正极”或“负极”)。
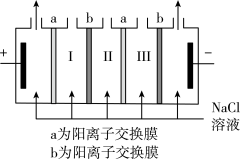
②用NaCl溶液模拟海水淡化,电解装置原理示意图如图所示,淡水从___________ 室(填Ⅰ、Ⅱ或Ⅲ)流出。
Ⅰ.
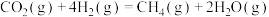
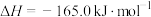
Ⅱ.

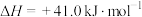
Ⅲ.

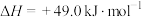
(1)二氧化碳与甲烷反应生成一氧化碳和氢气的热化学方程式为
A.相同时间内形成C—H键和H—H键的数目相等
B.相同时间内消耗
 和形成CO的分子数目相等
和形成CO的分子数目相等C.体系内各物质的浓度保持不变
D.体系内气体的密度保持不变
(2)消除NO污染物,在一定条件下,用
 将NO还原为
将NO还原为 和
和 。
。①
 还原NO的总反应为
还原NO的总反应为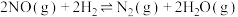 ,其能量变化如图所示。每还原1mol NO,应
,其能量变化如图所示。每还原1mol NO,应
②研究表明上述反应历程分两步:
Ⅰ.
 ;
;Ⅱ.
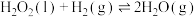
该总反应的反应物的总键能
(3)电渗析法淡化海水(在直流电源作用下通过离子交换膜对海水进行处理)
①利用如图所示装置可以减缓海水中钢铁设施的腐蚀。若开关K置于M处,则电极X可选用的物质是

②用NaCl溶液模拟海水淡化,电解装置原理示意图如图所示,淡水从

您最近一年使用:0次
名校
解题方法
7 . 在催化剂作用下,以 和
和 为原料进行合成
为原料进行合成 的实验。保持压强一定,将起始
的实验。保持压强一定,将起始 的混合气体通过装有催化剂的反应管,测得出口处
的混合气体通过装有催化剂的反应管,测得出口处 的转化率和
的转化率和 的选择性[
的选择性[ ]与温度的关系如图所示(图中虚线表示平衡时
]与温度的关系如图所示(图中虚线表示平衡时 的转化率或
的转化率或 的选择性)。已知反应管内发生的反应为:
的选择性)。已知反应管内发生的反应为:
反应1:

反应2:

下列说法正确的是

 和
和 为原料进行合成
为原料进行合成 的实验。保持压强一定,将起始
的实验。保持压强一定,将起始 的混合气体通过装有催化剂的反应管,测得出口处
的混合气体通过装有催化剂的反应管,测得出口处 的转化率和
的转化率和 的选择性[
的选择性[ ]与温度的关系如图所示(图中虚线表示平衡时
]与温度的关系如图所示(图中虚线表示平衡时 的转化率或
的转化率或 的选择性)。已知反应管内发生的反应为:
的选择性)。已知反应管内发生的反应为:反应1:


反应2:


下列说法正确的是

A.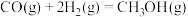 的 的 |
B. 时,出口处一定存在: 时,出口处一定存在: |
C. ,保持其他条件不变, ,保持其他条件不变, 随温度的升高而增加 随温度的升高而增加 |
D.为提高 的产率,应研发低温下催化活性更强的催化剂 的产率,应研发低温下催化活性更强的催化剂 |
您最近一年使用:0次
2023-05-21更新
|
318次组卷
|
3卷引用:江苏省镇江市句容市南京人民中学、海安实验中学、句容三中2022-2023学年高二下学期5月月考化学试题
江苏省镇江市句容市南京人民中学、海安实验中学、句容三中2022-2023学年高二下学期5月月考化学试题江苏省决胜新高考2023届高三5月份大联考化学试题(已下线)2023年高考浙江卷化学真题(6月)变式题(选择题11-16)
8 . “碳达峰”“碳中和”是我国社会发展重大战略之一。
I.中国首次实现了利用二氧化碳人工合成淀粉,其中最关键的一步是以 为原料制
为原料制 。在某
。在某 催化加氢制
催化加氢制 的反应体系中,发生的主要反应有:
的反应体系中,发生的主要反应有:
①
 kJ·mol
kJ·mol
②
 kJ·mol
kJ·mol
③
 kJ·mol
kJ·mol
(1)5 Mpa时,往某密闭容器中按投料比 充入
充入 和
和 。反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
。反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
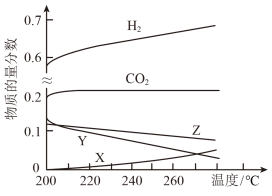
①图中Y代表______ (填化学式)。
②体系中 的物质的量分数受温度影响不大,原因是
的物质的量分数受温度影响不大,原因是__________________ 。
Ⅱ. 还原
还原 是实现“双碳”经济的有效途径之一,相关的主要反应有:
是实现“双碳”经济的有效途径之一,相关的主要反应有:
①
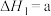 kJ·mol
kJ·mol
②
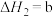 kJ·mol
kJ·mol
请回答:
(2)反应 的
的
______ kJ·mol (用a,b表示)。
(用a,b表示)。
(3)恒压,750℃时, 和
和 按物质的量之比1︰3投料,经如下流程可实现
按物质的量之比1︰3投料,经如下流程可实现 高效转化。
高效转化。
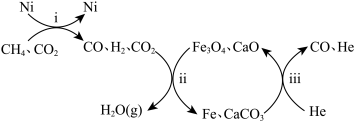
①写出过程ⅱ产生 的化学方程式
的化学方程式__________________ 。
②过程ⅱ的催化剂是______ 。
③过程ⅱ平衡后通入稀有气体He,测得一段时间内CO物质的量上升,根据过程ⅲ,结合平衡移动原理,解释CO物质的量上升的原因____________ 。
I.中国首次实现了利用二氧化碳人工合成淀粉,其中最关键的一步是以
 为原料制
为原料制 。在某
。在某 催化加氢制
催化加氢制 的反应体系中,发生的主要反应有:
的反应体系中,发生的主要反应有:①

 kJ·mol
kJ·mol
②

 kJ·mol
kJ·mol
③

 kJ·mol
kJ·mol
(1)5 Mpa时,往某密闭容器中按投料比
 充入
充入 和
和 。反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
。反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
①图中Y代表
②体系中
 的物质的量分数受温度影响不大,原因是
的物质的量分数受温度影响不大,原因是Ⅱ.
 还原
还原 是实现“双碳”经济的有效途径之一,相关的主要反应有:
是实现“双碳”经济的有效途径之一,相关的主要反应有:①

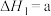 kJ·mol
kJ·mol②

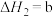 kJ·mol
kJ·mol请回答:
(2)反应
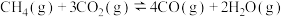 的
的
 (用a,b表示)。
(用a,b表示)。(3)恒压,750℃时,
 和
和 按物质的量之比1︰3投料,经如下流程可实现
按物质的量之比1︰3投料,经如下流程可实现 高效转化。
高效转化。
①写出过程ⅱ产生
 的化学方程式
的化学方程式②过程ⅱ的催化剂是
③过程ⅱ平衡后通入稀有气体He,测得一段时间内CO物质的量上升,根据过程ⅲ,结合平衡移动原理,解释CO物质的量上升的原因
您最近一年使用:0次
9 .  的反应机理如下:
的反应机理如下:
反应I:
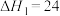 kJ·mol
kJ·mol
反应Ⅱ:
 kJ·mol
kJ·mol
反应中的能量变化如图所示,下列说法不正确 的是

 的反应机理如下:
的反应机理如下:反应I:

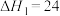 kJ·mol
kJ·mol
反应Ⅱ:

 kJ·mol
kJ·mol
反应中的能量变化如图所示,下列说法

A.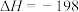 kJ·mol kJ·mol |
B.反应I的 |
C.通入过量空气,可提高 的平衡转化率 的平衡转化率 |
| D.反应速率由反应Ⅱ决定 |
您最近一年使用:0次
名校
10 . 工厂烟气(主要污染物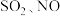 )直接排放会造成空气污染,需处理后才能排放。
)直接排放会造成空气污染,需处理后才能排放。
(1) 氧化。
氧化。 氧化过程中部分反应的能量变化如图所示。
氧化过程中部分反应的能量变化如图所示。

已知 ,则反应
,则反应
___________  。
。
(2)“纳米零价铁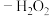 ”体系可将烟气中难溶的
”体系可将烟气中难溶的 氧化为可溶的
氧化为可溶的 。在一定温度下,将
。在一定温度下,将 溶液和
溶液和 溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的
溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的 氧化。
氧化。
① 催化
催化 分解产生
分解产生 ,
, 将
将 氧化为
氧化为 的机理如图所示,Y的化学式为
的机理如图所示,Y的化学式为_____ 。

② 与
与 反应生成
反应生成 的化学方程式为
的化学方程式为___________ 。
③纳米零价铁的作用是___________ 。
④ 脱除率随温度的变化如图所示。温度高于120℃时,
脱除率随温度的变化如图所示。温度高于120℃时, 脱除率随温度升高呈现下降趋势的主要原因是
脱除率随温度升高呈现下降趋势的主要原因是___________ 。

(3) 和
和 等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
① 的处理。
的处理。 是硝酸生产中氨催化氧化的副产物,用特种催化剂能使
是硝酸生产中氨催化氧化的副产物,用特种催化剂能使 分解。
分解。 与
与 在加热和催化剂作用下生成
在加热和催化剂作用下生成 的化学方程式为
的化学方程式为___________ 。
② 和
和 的处理。已除去
的处理。已除去 的硝酸尾气可用
的硝酸尾气可用 溶液吸收,主要反应:
溶液吸收,主要反应:

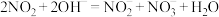
下列措施能提高尾气中 和
和 去除率的有
去除率的有___________ (填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量 溶液
溶液
(4) 的氧化吸收。用
的氧化吸收。用 溶液吸收硝酸尾气,可提高尾气中
溶液吸收硝酸尾气,可提高尾气中 的去除率。其他条件相同,
的去除率。其他条件相同, 转化为
转化为 的转化率随
的转化率随 溶液初始
溶液初始 (用稀盐酸调节)的变化如图所示。
(用稀盐酸调节)的变化如图所示。

①在酸性 溶液中,
溶液中, 氧化
氧化 生成
生成 和
和 ,其离子方程式为
,其离子方程式为___________ 。
② 溶液的初始
溶液的初始 越小,
越小, 转化率越高。其原因是
转化率越高。其原因是___________ 。
 )直接排放会造成空气污染,需处理后才能排放。
)直接排放会造成空气污染,需处理后才能排放。(1)
 氧化。
氧化。 氧化过程中部分反应的能量变化如图所示。
氧化过程中部分反应的能量变化如图所示。
已知
 ,则反应
,则反应
 。
。(2)“纳米零价铁
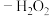 ”体系可将烟气中难溶的
”体系可将烟气中难溶的 氧化为可溶的
氧化为可溶的 。在一定温度下,将
。在一定温度下,将 溶液和
溶液和 溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的
溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的 氧化。
氧化。①
 催化
催化 分解产生
分解产生 ,
, 将
将 氧化为
氧化为 的机理如图所示,Y的化学式为
的机理如图所示,Y的化学式为
②
 与
与 反应生成
反应生成 的化学方程式为
的化学方程式为③纳米零价铁的作用是
④
 脱除率随温度的变化如图所示。温度高于120℃时,
脱除率随温度的变化如图所示。温度高于120℃时, 脱除率随温度升高呈现下降趋势的主要原因是
脱除率随温度升高呈现下降趋势的主要原因是
(3)
 和
和 等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。①
 的处理。
的处理。 是硝酸生产中氨催化氧化的副产物,用特种催化剂能使
是硝酸生产中氨催化氧化的副产物,用特种催化剂能使 分解。
分解。 与
与 在加热和催化剂作用下生成
在加热和催化剂作用下生成 的化学方程式为
的化学方程式为②
 和
和 的处理。已除去
的处理。已除去 的硝酸尾气可用
的硝酸尾气可用 溶液吸收,主要反应:
溶液吸收,主要反应:
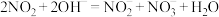
下列措施能提高尾气中
 和
和 去除率的有
去除率的有A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量
 溶液
溶液(4)
 的氧化吸收。用
的氧化吸收。用 溶液吸收硝酸尾气,可提高尾气中
溶液吸收硝酸尾气,可提高尾气中 的去除率。其他条件相同,
的去除率。其他条件相同, 转化为
转化为 的转化率随
的转化率随 溶液初始
溶液初始 (用稀盐酸调节)的变化如图所示。
(用稀盐酸调节)的变化如图所示。
①在酸性
 溶液中,
溶液中, 氧化
氧化 生成
生成 和
和 ,其离子方程式为
,其离子方程式为②
 溶液的初始
溶液的初始 越小,
越小, 转化率越高。其原因是
转化率越高。其原因是
您最近一年使用:0次



