名校
解题方法
1 . 深入研究碳、氮元素的物质转化有着重要的实际意义,汽车尾气净化装置中CO和NO发生如下反应:
i.
 ,
,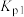
ii.
 ,
,
iii.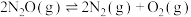
 ,
,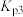
回答下列问题:
(1)上述反应的 的线性关系如图所示(
的线性关系如图所示( )。
)。
_______ (填“>”或“<”)0,反应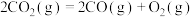 的
的
_______ (用 、
、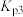 表示)。
表示)。 ,初始总压强为
,初始总压强为 ,仅发生以上反应ⅰ、ⅱ,且反应ⅰ的
,仅发生以上反应ⅰ、ⅱ,且反应ⅰ的 ,
, ,
, ,
, 分别为正、逆反应速率常数。充分反应达平衡时总压强为
分别为正、逆反应速率常数。充分反应达平衡时总压强为 ,
, 的物质的量为1.25mol,则
的物质的量为1.25mol,则
_______ 。
(3)CO和NO发生上述三个反应,在不同条件下达到平衡时,在 K时NO的转化率与
K时NO的转化率与 的变化曲线及
的变化曲线及 时NO的转化率与T的变化曲线如图所示。
时NO的转化率与T的变化曲线如图所示。 时NO的转化率与T的变化曲线为
时NO的转化率与T的变化曲线为_______ 曲线(填“Ⅰ”或“Ⅱ”),A点后NO的平衡转化率增大的原因是_______ 。
(4)CO、NO均能够与血红蛋白(Hb)中 形成稳定的配合物使血红蛋白失去携氧能力,因而具有毒性。已知:CO进入血液后有如下平衡:
形成稳定的配合物使血红蛋白失去携氧能力,因而具有毒性。已知:CO进入血液后有如下平衡: 。
。
①从化学平衡角度简述CO的中毒原理:_______ 。
②已知反应
 实验表明,人体内HbCO与
实验表明,人体内HbCO与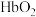 的浓度之比为1∶50已足以使人智力受损,则抽烟时吸入肺部的空气中CO与
的浓度之比为1∶50已足以使人智力受损,则抽烟时吸入肺部的空气中CO与 的体积比大于
的体积比大于_______ 即达到智力受损的程度。
i.

 ,
,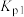
ii.

 ,
,
iii.
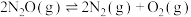
 ,
,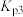
回答下列问题:
(1)上述反应的
 的线性关系如图所示(
的线性关系如图所示( )。
)。
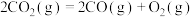 的
的
 、
、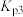 表示)。
表示)。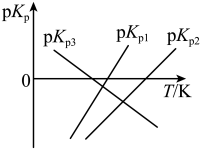
 ,初始总压强为
,初始总压强为 ,仅发生以上反应ⅰ、ⅱ,且反应ⅰ的
,仅发生以上反应ⅰ、ⅱ,且反应ⅰ的 ,
, ,
, ,
, 分别为正、逆反应速率常数。充分反应达平衡时总压强为
分别为正、逆反应速率常数。充分反应达平衡时总压强为 ,
, 的物质的量为1.25mol,则
的物质的量为1.25mol,则
(3)CO和NO发生上述三个反应,在不同条件下达到平衡时,在
 K时NO的转化率与
K时NO的转化率与 的变化曲线及
的变化曲线及 时NO的转化率与T的变化曲线如图所示。
时NO的转化率与T的变化曲线如图所示。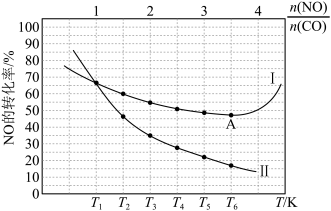
 时NO的转化率与T的变化曲线为
时NO的转化率与T的变化曲线为(4)CO、NO均能够与血红蛋白(Hb)中
 形成稳定的配合物使血红蛋白失去携氧能力,因而具有毒性。已知:CO进入血液后有如下平衡:
形成稳定的配合物使血红蛋白失去携氧能力,因而具有毒性。已知:CO进入血液后有如下平衡: 。
。①从化学平衡角度简述CO的中毒原理:
②已知反应

 实验表明,人体内HbCO与
实验表明,人体内HbCO与 的浓度之比为1∶50已足以使人智力受损,则抽烟时吸入肺部的空气中CO与
的浓度之比为1∶50已足以使人智力受损,则抽烟时吸入肺部的空气中CO与 的体积比大于
的体积比大于
您最近一年使用:0次
名校
解题方法
2 . 燃油汽车尾气中含有NO、 、CO等有毒气体造成大气污染,可在汽车尾气排放装置中加催化转化装置,将有毒气体转化为无毒气体。反应原理如下:
、CO等有毒气体造成大气污染,可在汽车尾气排放装置中加催化转化装置,将有毒气体转化为无毒气体。反应原理如下:
反应①:

反应②: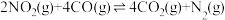
回答下列问题:
(1)已知:1 mol物质中化学键断裂时所需能量如下表。
CO燃烧热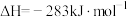 ,则反应①的
,则反应①的
___________  。
。
(2)恒温恒压密闭容器中充入一定量NO(g)和CO(g)(不考虑反应②),下列条件不能判断反应①达到平衡状态的是___________(填标号)。
(3)瑞典化学家阿伦尼乌斯根据实验结果,提出了温度与反应速率常数关系的经验公式: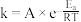 [k为反应速率常数,A为比例常数,e为自然对数的底数,R为摩尔气体常数,T为开尔文温度,
[k为反应速率常数,A为比例常数,e为自然对数的底数,R为摩尔气体常数,T为开尔文温度, 为活化能(
为活化能( )]。
)]。
①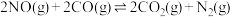 反应达到平衡后,升高温度,正反应速率常数增大的倍数
反应达到平衡后,升高温度,正反应速率常数增大的倍数___________ (填“大于”“小于”或“等于”)逆反应速率常数增大的倍数。
②由此判断下列说法正确的是___________ (填标号, 、
、 为正、逆反应速率常数)。
为正、逆反应速率常数)。
A.其他条件不变,升高温度, 增大,
增大, 变小
变小
B.其他条件不变,使用催化剂, 、
、 同倍数增大
同倍数增大
C.其他条件不变,增大反应物浓度 增大,
增大, 不变
不变
D.其他条件不变,减小压强, 、
、 都变小
都变小
(4)探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,测量相同时间内逸出气体中NO含量,从而确定尾气脱氮率(即NO的转化率),结果如图所示。曲线上a点的脱氮率___________ (填“ ”“
”“ ”或“
”或“ ”)对应温度下的平衡脱氮率。催化剂
”)对应温度下的平衡脱氮率。催化剂 条件下,450℃后,脱氮率随温度升高而下降的原因可能是
条件下,450℃后,脱氮率随温度升高而下降的原因可能是___________ 。 催化还原NO,也可以消除氮氧化物的污染。在适当催化剂的作用下,用
催化还原NO,也可以消除氮氧化物的污染。在适当催化剂的作用下,用 脱氮过程中存在主反应和副反应:
脱氮过程中存在主反应和副反应:
主反应: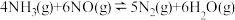

副反应: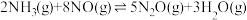

在TK下,向恒容密闭容器中充入2 mol 和3 mol NO,发生上述反应;若初始压强为20MPa,反应达到平衡时,压强仍为20 MPa且
和3 mol NO,发生上述反应;若初始压强为20MPa,反应达到平衡时,压强仍为20 MPa且 的分压为4MPa。
的分压为4MPa。
①该温度下主反应的压强平衡常数
___________ (保留1位小数)。
②若反应10min达到上述平衡状态,则用 表示的平均速率
表示的平均速率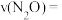
___________ 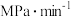 。
。
 、CO等有毒气体造成大气污染,可在汽车尾气排放装置中加催化转化装置,将有毒气体转化为无毒气体。反应原理如下:
、CO等有毒气体造成大气污染,可在汽车尾气排放装置中加催化转化装置,将有毒气体转化为无毒气体。反应原理如下:反应①:


反应②:
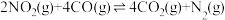
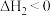
回答下列问题:
(1)已知:1 mol物质中化学键断裂时所需能量如下表。
| 物质 |  |  |  |
| 能量/kJ | 945 | 498 | 631 |
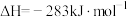 ,则反应①的
,则反应①的
 。
。(2)恒温恒压密闭容器中充入一定量NO(g)和CO(g)(不考虑反应②),下列条件不能判断反应①达到平衡状态的是___________(填标号)。
| A.混合气体的颜色保持不变 |
| B.混合气体的平均相对分子质量保持不变 |
C. 的体积分数不变 的体积分数不变 |
D.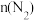 和 和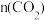 的比值一定 的比值一定 |
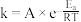 [k为反应速率常数,A为比例常数,e为自然对数的底数,R为摩尔气体常数,T为开尔文温度,
[k为反应速率常数,A为比例常数,e为自然对数的底数,R为摩尔气体常数,T为开尔文温度, 为活化能(
为活化能( )]。
)]。①
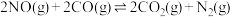 反应达到平衡后,升高温度,正反应速率常数增大的倍数
反应达到平衡后,升高温度,正反应速率常数增大的倍数②由此判断下列说法正确的是
 、
、 为正、逆反应速率常数)。
为正、逆反应速率常数)。A.其他条件不变,升高温度,
 增大,
增大, 变小
变小B.其他条件不变,使用催化剂,
 、
、 同倍数增大
同倍数增大C.其他条件不变,增大反应物浓度
 增大,
增大, 不变
不变D.其他条件不变,减小压强,
 、
、 都变小
都变小(4)探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,测量相同时间内逸出气体中NO含量,从而确定尾气脱氮率(即NO的转化率),结果如图所示。曲线上a点的脱氮率
 ”“
”“ ”或“
”或“ ”)对应温度下的平衡脱氮率。催化剂
”)对应温度下的平衡脱氮率。催化剂 条件下,450℃后,脱氮率随温度升高而下降的原因可能是
条件下,450℃后,脱氮率随温度升高而下降的原因可能是
 催化还原NO,也可以消除氮氧化物的污染。在适当催化剂的作用下,用
催化还原NO,也可以消除氮氧化物的污染。在适当催化剂的作用下,用 脱氮过程中存在主反应和副反应:
脱氮过程中存在主反应和副反应:主反应:
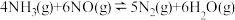

副反应:
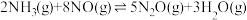

在TK下,向恒容密闭容器中充入2 mol
 和3 mol NO,发生上述反应;若初始压强为20MPa,反应达到平衡时,压强仍为20 MPa且
和3 mol NO,发生上述反应;若初始压强为20MPa,反应达到平衡时,压强仍为20 MPa且 的分压为4MPa。
的分压为4MPa。①该温度下主反应的压强平衡常数

②若反应10min达到上述平衡状态,则用
 表示的平均速率
表示的平均速率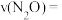
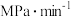 。
。
您最近一年使用:0次
解题方法
3 . 燃煤会产生CO2、CO、SO2等大气污染物。燃煤脱硫的相关反应的热化学方程式如下:
Ⅰ.
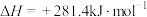
Ⅱ.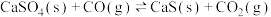
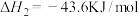
(1)一定温度下,向某恒容密闭容器中加入CaSO4(s)和1molCO,若只发生反应Ⅰ,下列能说明该反应已达到平衡状态的是________ (填字母)。
a.容器内的压强不发生变化 b.
c.容器内气体的密度不发生变化 d.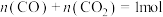
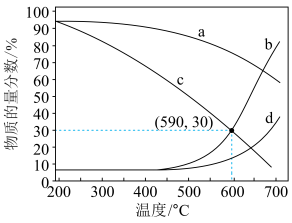
(2)一定温度下,体积为1L的容器中加入CaSO4(s)和1molCO,若只发生反应Ⅱ,测得CO2的物质的量随时间变化如图中曲线A所示:
________ 。
②曲线B表示过程与曲线A相比,改变的反应条件可能为________ (答出一条即可)。
③若要提高反应体系中CO2的体积分数,可采取的措施为________ 。
(3)以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.
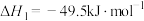
Ⅱ.

Ⅲ.

回答下列问题:

________ kJmol-1。
Ⅰ.

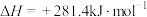
Ⅱ.
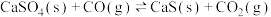
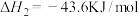
(1)一定温度下,向某恒容密闭容器中加入CaSO4(s)和1molCO,若只发生反应Ⅰ,下列能说明该反应已达到平衡状态的是
a.容器内的压强不发生变化 b.

c.容器内气体的密度不发生变化 d.
(2)一定温度下,体积为1L的容器中加入CaSO4(s)和1molCO,若只发生反应Ⅱ,测得CO2的物质的量随时间变化如图中曲线A所示:
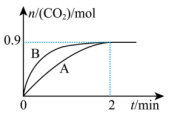

②曲线B表示过程与曲线A相比,改变的反应条件可能为
③若要提高反应体系中CO2的体积分数,可采取的措施为
(3)以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.

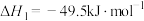
Ⅱ.


Ⅲ.


回答下列问题:

您最近一年使用:0次
4 . 天然气经催化重整转化成合成气(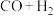 )后再合成其他化工产品,既可减少能源浪费,又能生产高附加值产品。以甲烷、二氧化碳为原料催化重整制合成气,体系中可发生如下两个反应:
)后再合成其他化工产品,既可减少能源浪费,又能生产高附加值产品。以甲烷、二氧化碳为原料催化重整制合成气,体系中可发生如下两个反应:
反应Ⅰ:

反应Ⅱ:

(1)反应Ⅰ可分为如下两步:
 裂解:
裂解: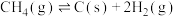
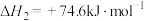
 重整:
重整: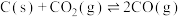
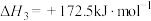
则 =
=______ 。反应Ⅰ能够自发进行的条件是______ ,判断依据是______ 。
(2) ℃时,向4L容器中通入7mol
℃时,向4L容器中通入7mol 、6mol
、6mol ,发生反应Ⅰ、Ⅱ.
,发生反应Ⅰ、Ⅱ. min后达到平衡,体系中
min后达到平衡,体系中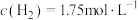 ,
,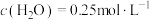 ,压强为
,压强为 。①此温度下,反应Ⅰ的平衡常数
。①此温度下,反应Ⅰ的平衡常数 =
=______ (写出计算式即可,不必化简)[对于气相反应,用某组分B的平衡压强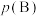 代替物质的量浓度
代替物质的量浓度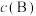 表示的平衡常数,记作
表示的平衡常数,记作 ,如
,如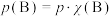 ,
, 为平衡总压强,
为平衡总压强,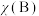 为平衡系统中B的物质的量分数]。
为平衡系统中B的物质的量分数]。
②请在图中画出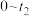 时段
时段 随时间变化曲线并标出
随时间变化曲线并标出 的平衡浓度
的平衡浓度______ 。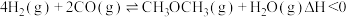
①在恒温恒压条件进行此反应,下列能说明反应已达到平衡的是______ (填标号)。
A. 、
、 、
、 、
、 的反应速率之比为4:2:1:1
的反应速率之比为4:2:1:1
B. 、
、 、
、 、
、 的物质的量之比为4:2:1:1
的物质的量之比为4:2:1:1
C.混合气体的平均摩尔质量保持不变
D.容器中气体的密度保持不变
②某温度下,将2.0mol 和4.0mol
和4.0mol 充入容积为2L的密闭容器中,反应达到平衡时,改变压强和温度,平衡体系中
充入容积为2L的密闭容器中,反应达到平衡时,改变压强和温度,平衡体系中 的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是
的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是______ (填标号)。 ,
,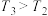 B.
B. ,
,
C. ,
, D.
D. ,
,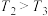
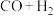 )后再合成其他化工产品,既可减少能源浪费,又能生产高附加值产品。以甲烷、二氧化碳为原料催化重整制合成气,体系中可发生如下两个反应:
)后再合成其他化工产品,既可减少能源浪费,又能生产高附加值产品。以甲烷、二氧化碳为原料催化重整制合成气,体系中可发生如下两个反应:反应Ⅰ:


反应Ⅱ:


(1)反应Ⅰ可分为如下两步:
 裂解:
裂解: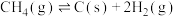
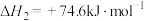
 重整:
重整: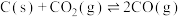
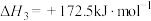
则
 =
=(2)
 ℃时,向4L容器中通入7mol
℃时,向4L容器中通入7mol 、6mol
、6mol ,发生反应Ⅰ、Ⅱ.
,发生反应Ⅰ、Ⅱ. min后达到平衡,体系中
min后达到平衡,体系中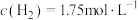 ,
,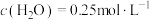 ,压强为
,压强为 。①此温度下,反应Ⅰ的平衡常数
。①此温度下,反应Ⅰ的平衡常数 =
=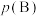 代替物质的量浓度
代替物质的量浓度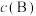 表示的平衡常数,记作
表示的平衡常数,记作 ,如
,如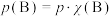 ,
, 为平衡总压强,
为平衡总压强,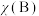 为平衡系统中B的物质的量分数]。
为平衡系统中B的物质的量分数]。②请在图中画出
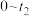 时段
时段 随时间变化曲线并标出
随时间变化曲线并标出 的平衡浓度
的平衡浓度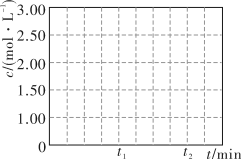
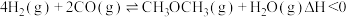
①在恒温恒压条件进行此反应,下列能说明反应已达到平衡的是
A.
 、
、 、
、 、
、 的反应速率之比为4:2:1:1
的反应速率之比为4:2:1:1B.
 、
、 、
、 、
、 的物质的量之比为4:2:1:1
的物质的量之比为4:2:1:1C.混合气体的平均摩尔质量保持不变
D.容器中气体的密度保持不变
②某温度下,将2.0mol
 和4.0mol
和4.0mol 充入容积为2L的密闭容器中,反应达到平衡时,改变压强和温度,平衡体系中
充入容积为2L的密闭容器中,反应达到平衡时,改变压强和温度,平衡体系中 的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是
的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是
 ,
,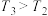 B.
B. ,
,
C.
 ,
, D.
D. ,
,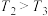
您最近一年使用:0次
名校
5 . 我国提出2060年前实现碳中和,为有效降低大气 中的含量,以
中的含量,以 为原料制备甲烷、戊烷、甲醇等能源物质具有较好的发展前景。
为原料制备甲烷、戊烷、甲醇等能源物质具有较好的发展前景。 在固体催化剂表面加氢合成甲烷过程中发生如下反应:
在固体催化剂表面加氢合成甲烷过程中发生如下反应:
Ⅰ.主反应:

Ⅱ.副反应:

(1)已知:Ⅲ.
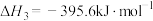
Ⅳ.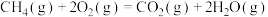

___________ 。
(2) 加氢合成甲烷时,通常控制温度为500℃左右,其可能的原因为___________。
加氢合成甲烷时,通常控制温度为500℃左右,其可能的原因为___________。
(3)500℃时,向1L恒容密闭容器中充入4mol 和12mol
和12mol ,初始压强为p,20min时主、副反应都达到平衡状态,测得
,初始压强为p,20min时主、副反应都达到平衡状态,测得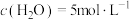 ,体系压强为
,体系压强为 ,则0~20min内
,则0~20min内
___________  ,平衡时
,平衡时 选择性=
选择性=___________ ( 选择性
选择性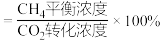 ,计算保留三位有效数字,下同),副反应的
,计算保留三位有效数字,下同),副反应的
___________ 。
(4)以 催化加氢合成的甲醇为原料,在催化剂作用下可以制取丙烯,反应的化学方程式为
催化加氢合成的甲醇为原料,在催化剂作用下可以制取丙烯,反应的化学方程式为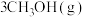
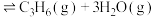 。该反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arhenius经验公式
。该反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arhenius经验公式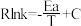 ,(Ea为活化能,k为速率常数,R和C为常数)。当改变外界条件时,实验数据如图中的曲线b所示,则实验可能改变的外界条件是
,(Ea为活化能,k为速率常数,R和C为常数)。当改变外界条件时,实验数据如图中的曲线b所示,则实验可能改变的外界条件是___________ 。 配体:四面体中心为硼原子,顶点均为氢原子。若其摩尔质量为
配体:四面体中心为硼原子,顶点均为氢原子。若其摩尔质量为 ,则M元素为
,则M元素为___________ (填元素符号):在该化合物中,M离子的价电子排布式为___________ 。
 中的含量,以
中的含量,以 为原料制备甲烷、戊烷、甲醇等能源物质具有较好的发展前景。
为原料制备甲烷、戊烷、甲醇等能源物质具有较好的发展前景。 在固体催化剂表面加氢合成甲烷过程中发生如下反应:
在固体催化剂表面加氢合成甲烷过程中发生如下反应:Ⅰ.主反应:


Ⅱ.副反应:


(1)已知:Ⅲ.

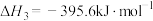
Ⅳ.
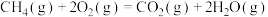

(2)
 加氢合成甲烷时,通常控制温度为500℃左右,其可能的原因为___________。
加氢合成甲烷时,通常控制温度为500℃左右,其可能的原因为___________。| A.反应速率快 | B.平衡转化率高 |
| C.催化剂活性高 | D.主反应催化剂选择性好 |
(3)500℃时,向1L恒容密闭容器中充入4mol
 和12mol
和12mol ,初始压强为p,20min时主、副反应都达到平衡状态,测得
,初始压强为p,20min时主、副反应都达到平衡状态,测得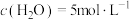 ,体系压强为
,体系压强为 ,则0~20min内
,则0~20min内
 ,平衡时
,平衡时 选择性=
选择性= 选择性
选择性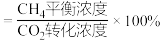 ,计算保留三位有效数字,下同),副反应的
,计算保留三位有效数字,下同),副反应的
(4)以
 催化加氢合成的甲醇为原料,在催化剂作用下可以制取丙烯,反应的化学方程式为
催化加氢合成的甲醇为原料,在催化剂作用下可以制取丙烯,反应的化学方程式为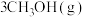
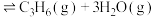 。该反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arhenius经验公式
。该反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arhenius经验公式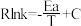 ,(Ea为活化能,k为速率常数,R和C为常数)。当改变外界条件时,实验数据如图中的曲线b所示,则实验可能改变的外界条件是
,(Ea为活化能,k为速率常数,R和C为常数)。当改变外界条件时,实验数据如图中的曲线b所示,则实验可能改变的外界条件是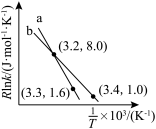
 配体:四面体中心为硼原子,顶点均为氢原子。若其摩尔质量为
配体:四面体中心为硼原子,顶点均为氢原子。若其摩尔质量为 ,则M元素为
,则M元素为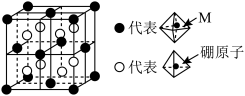
您最近一年使用:0次
名校
解题方法
6 . 某温度下,利用CO2生产甲醇主要涉及以下反应。
反应Ⅰ.
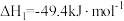 K1
K1
反应Ⅱ.
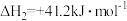 K2
K2
反应Ⅲ.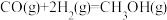 △H3
△H3
回答下列问题:
(1)△H3=_____ kJ/mol。
(2)恒压条件下发生反应Ⅰ和Ⅱ,平衡后再充入惰性气体,反应Ⅱ平衡将_____ 移动(填“正向”“逆向”或“不”)。
(3)将1 mol CO2(g)和3 mol H2(g)充入密闭容器发生反应Ⅰ和Ⅱ,并达到平衡状态。相同温度下,在不同压强下测得CO2的平衡转化率、CH3OH(g)的选择性 和
和 的选择性
的选择性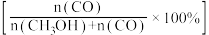 随压强变化曲线如图所示。图中表示CO2的平衡转化率的曲线是
随压强变化曲线如图所示。图中表示CO2的平衡转化率的曲线是_____ (填“m”“n”或“p”),A点时 的转化率为
的转化率为_____ 。_____ (填标号)。
②200~400℃b、d曲线基本重合的原因是_____ 。
③590℃时,反应Ⅰ的Kp为_____ (MPa)-2 (保留2位有效数字)。
反应Ⅰ.

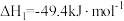 K1
K1反应Ⅱ.

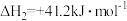 K2
K2反应Ⅲ.
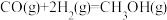 △H3
△H3回答下列问题:
(1)△H3=
(2)恒压条件下发生反应Ⅰ和Ⅱ,平衡后再充入惰性气体,反应Ⅱ平衡将
(3)将1 mol CO2(g)和3 mol H2(g)充入密闭容器发生反应Ⅰ和Ⅱ,并达到平衡状态。相同温度下,在不同压强下测得CO2的平衡转化率、CH3OH(g)的选择性
 和
和 的选择性
的选择性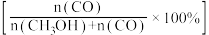 随压强变化曲线如图所示。图中表示CO2的平衡转化率的曲线是
随压强变化曲线如图所示。图中表示CO2的平衡转化率的曲线是 的转化率为
的转化率为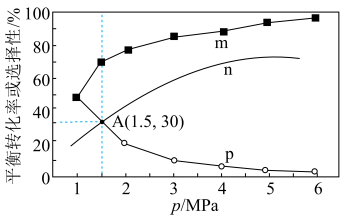
②200~400℃b、d曲线基本重合的原因是
③590℃时,反应Ⅰ的Kp为
您最近一年使用:0次
2024-04-08更新
|
208次组卷
|
2卷引用:湖南省长沙市雅礼中学2023-2024学年高三下学期月考(七)化学试题
名校
解题方法
7 . 丙烷的价格低廉且产量大,而丙烯及其衍生物具有较高的经济附加值,因此丙烷脱氢制丙烯具有重要的价值。回答下列问题:
(1)已知下列反应的热化学方程式:
直接脱氢
反应①:

反应②:

计算 氧化丙烷脱氢反应③:
氧化丙烷脱氢反应③: 的
的
___________  。
。
(2)已知下列键能数据,结合反应①数据,计算 的键能是
的键能是___________  。
。
(3)一定温度下,向密闭容器中充入1mol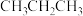 ,发生反应①。
,发生反应①。
①若该反应在恒压环境中进行,常通过向体系中通入稀有气体Ar的方式来提高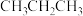 的平衡转化率,原因是
的平衡转化率,原因是___________ 。
②若该反应在恒容环境中进行,用压强传感器测出容器内体系压强随时间的变化关系如图a所示,计算该温度下反应①的平衡常数
___________ kPa( 为用平衡时各气体分压代替气体的浓度表示的平衡常数,分压=总压×物质的量分数)。若保持相同反应时间,在不同温度下,丙烯产率如图b所示,丙烯产率在425℃之前随温度升高而增大的原因可能是
为用平衡时各气体分压代替气体的浓度表示的平衡常数,分压=总压×物质的量分数)。若保持相同反应时间,在不同温度下,丙烯产率如图b所示,丙烯产率在425℃之前随温度升高而增大的原因可能是___________ 、___________ ,随着温度继续升高,丙烷可能分解为其他产物。
 作催化剂,对反应③的机理展开研究。以
作催化剂,对反应③的机理展开研究。以 和
和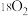 为原料,初期产物中没有检测到
为原料,初期产物中没有检测到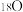 ;以含有
;以含有 的
的 (D为
(D为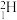 )和
)和 为原料,反应过程中没有检测到
为原料,反应过程中没有检测到 。下列推断合理的是
。下列推断合理的是___________ (填标号)。
A. 先吸附氧气,吸附的氧气直接与吸附的丙烷反应
先吸附氧气,吸附的氧气直接与吸附的丙烷反应
B. 直接氧化吸附的丙烷,吸附的氧气补充
直接氧化吸附的丙烷,吸附的氧气补充 中反应掉的氧
中反应掉的氧
C. 催化丙烷脱氢过程中,碳氢键的断裂是可逆的
催化丙烷脱氢过程中,碳氢键的断裂是可逆的
(5)基于电化学原理,我国科学家利用固体氧化物电解池实现高选择性 电化学脱氢制
电化学脱氢制 的工艺,装置如图c,则
的工艺,装置如图c,则 生成
生成 的电极反应式为
的电极反应式为___________ 。
(1)已知下列反应的热化学方程式:
直接脱氢
反应①:


反应②:
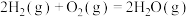

计算
 氧化丙烷脱氢反应③:
氧化丙烷脱氢反应③: 的
的
 。
。(2)已知下列键能数据,结合反应①数据,计算
 的键能是
的键能是 。
。| 化学键 |  |  |  |
键能/( ) ) | 347.7 | 413.4 | 436.0 |
(3)一定温度下,向密闭容器中充入1mol
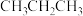 ,发生反应①。
,发生反应①。①若该反应在恒压环境中进行,常通过向体系中通入稀有气体Ar的方式来提高
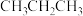 的平衡转化率,原因是
的平衡转化率,原因是②若该反应在恒容环境中进行,用压强传感器测出容器内体系压强随时间的变化关系如图a所示,计算该温度下反应①的平衡常数

 为用平衡时各气体分压代替气体的浓度表示的平衡常数,分压=总压×物质的量分数)。若保持相同反应时间,在不同温度下,丙烯产率如图b所示,丙烯产率在425℃之前随温度升高而增大的原因可能是
为用平衡时各气体分压代替气体的浓度表示的平衡常数,分压=总压×物质的量分数)。若保持相同反应时间,在不同温度下,丙烯产率如图b所示,丙烯产率在425℃之前随温度升高而增大的原因可能是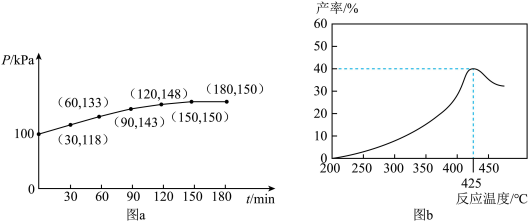
 作催化剂,对反应③的机理展开研究。以
作催化剂,对反应③的机理展开研究。以 和
和 为原料,初期产物中没有检测到
为原料,初期产物中没有检测到 ;以含有
;以含有 的
的 (D为
(D为 )和
)和 为原料,反应过程中没有检测到
为原料,反应过程中没有检测到 。下列推断合理的是
。下列推断合理的是A.
 先吸附氧气,吸附的氧气直接与吸附的丙烷反应
先吸附氧气,吸附的氧气直接与吸附的丙烷反应B.
 直接氧化吸附的丙烷,吸附的氧气补充
直接氧化吸附的丙烷,吸附的氧气补充 中反应掉的氧
中反应掉的氧C.
 催化丙烷脱氢过程中,碳氢键的断裂是可逆的
催化丙烷脱氢过程中,碳氢键的断裂是可逆的(5)基于电化学原理,我国科学家利用固体氧化物电解池实现高选择性
 电化学脱氢制
电化学脱氢制 的工艺,装置如图c,则
的工艺,装置如图c,则 生成
生成 的电极反应式为
的电极反应式为 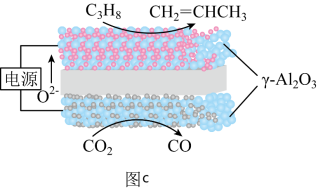
您最近一年使用:0次
8 . 苯基甲基乙炔(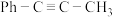 )可用作医药中间体,制备帕瑞昔布钠。一定条件下,苯基甲基乙炔可与HCl发生催化加成,反应过程如下:
)可用作医药中间体,制备帕瑞昔布钠。一定条件下,苯基甲基乙炔可与HCl发生催化加成,反应过程如下:

已知: ,下列说法正确的是
,下列说法正确的是
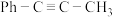 )可用作医药中间体,制备帕瑞昔布钠。一定条件下,苯基甲基乙炔可与HCl发生催化加成,反应过程如下:
)可用作医药中间体,制备帕瑞昔布钠。一定条件下,苯基甲基乙炔可与HCl发生催化加成,反应过程如下:
已知:
 ,下列说法正确的是
,下列说法正确的是A.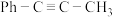 中最多4个碳原子共线 中最多4个碳原子共线 |
B.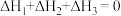 |
| C.产物Ⅱ比产物I稳定,两者互为立体异构体 |
| D.反应I的活化能大于反应Ⅱ |
您最近一年使用:0次
名校
解题方法
9 . 研究含氮元素物质的反应对生产、生活、科研等方面具有重要的意义.回答下列问题:
(1)已知: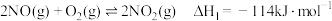 ;
;
 ;
;
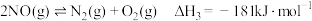 .
.
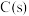 与
与 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为___________ 。
(2) 的排放主要来自于汽车尾气,包含
的排放主要来自于汽车尾气,包含 和
和 ,有人提出用活性炭对
,有人提出用活性炭对 进行吸收.对于反应:
进行吸收.对于反应: 时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时,借助传感器测得反应在不同时间点上各物质的浓度如下:
① 内,
内, 的平均反应速率
的平均反应速率
___________ ,当升高反应温度,该反应的平衡常数K___________ (选填“增大”“减小”或“不变”)。
② 后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是
后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是___________ (填字母)。
A.加入一定量的活性炭B.通入一定量的 C.适当缩小容器的体积D.加入合适的催化剂
C.适当缩小容器的体积D.加入合适的催化剂
(3)为避免汽车尾气中的氮氧化合物对大气的污染,需给汽车安装尾气净化装置.在净化装置中 和
和 发生反应
发生反应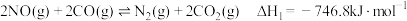 .实验测得:
.实验测得: ,其中
,其中 分别为正、逆反应速率常数,只与温度有关;p为气体分压(分压=物质的量分数×总压).
分别为正、逆反应速率常数,只与温度有关;p为气体分压(分压=物质的量分数×总压).
①达到平衡后,仅升高温度, 增大的倍数
增大的倍数___________ (选填“大于”、“小于”或“等于”) 增大的倍数。
增大的倍数。
②一定温度下在刚性密闭容器中充入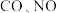 和
和 物质的量之比为
物质的量之比为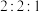 ,压强为
,压强为 .达平衡时压强为
.达平衡时压强为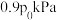 ,此时
,此时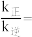
___________  。
。
(4)某研究小组在实验室以耐高温催化剂催化 转化为
转化为 ,测得
,测得 转化为
转化为 的转化率随温度变化情况如图所示.结合(1)中的反应,用平衡移动原理解释加入
的转化率随温度变化情况如图所示.结合(1)中的反应,用平衡移动原理解释加入 后,
后, 转化为
转化为 的转化率增大的原因:
的转化率增大的原因:____________________________ 。
(1)已知:
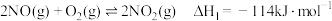 ;
; ;
;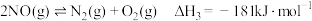 .
.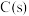 与
与 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为(2)
 的排放主要来自于汽车尾气,包含
的排放主要来自于汽车尾气,包含 和
和 ,有人提出用活性炭对
,有人提出用活性炭对 进行吸收.对于反应:
进行吸收.对于反应: 时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时,借助传感器测得反应在不同时间点上各物质的浓度如下:
| 0 | 10 | 20 | 30 | 40 | 50 |
| 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
 内,
内, 的平均反应速率
的平均反应速率
②
 后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是
后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是A.加入一定量的活性炭B.通入一定量的
 C.适当缩小容器的体积D.加入合适的催化剂
C.适当缩小容器的体积D.加入合适的催化剂(3)为避免汽车尾气中的氮氧化合物对大气的污染,需给汽车安装尾气净化装置.在净化装置中
 和
和 发生反应
发生反应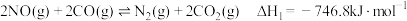 .实验测得:
.实验测得: ,其中
,其中 分别为正、逆反应速率常数,只与温度有关;p为气体分压(分压=物质的量分数×总压).
分别为正、逆反应速率常数,只与温度有关;p为气体分压(分压=物质的量分数×总压).①达到平衡后,仅升高温度,
 增大的倍数
增大的倍数 增大的倍数。
增大的倍数。②一定温度下在刚性密闭容器中充入
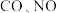 和
和 物质的量之比为
物质的量之比为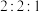 ,压强为
,压强为 .达平衡时压强为
.达平衡时压强为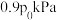 ,此时
,此时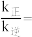
 。
。(4)某研究小组在实验室以耐高温催化剂催化
 转化为
转化为 ,测得
,测得 转化为
转化为 的转化率随温度变化情况如图所示.结合(1)中的反应,用平衡移动原理解释加入
的转化率随温度变化情况如图所示.结合(1)中的反应,用平衡移动原理解释加入 后,
后, 转化为
转化为 的转化率增大的原因:
的转化率增大的原因: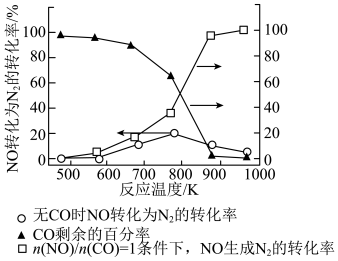
您最近一年使用:0次
2024-03-15更新
|
165次组卷
|
2卷引用:湖南省长沙市四区2023-2024学年高三下学期3月调研考试(一模)化学试卷
名校
解题方法
10 .  转化利用对化解全球环境生态危机、助力全球“碳达峰、碳中和”目标的实现具有重要意义。化学工作者致力于将
转化利用对化解全球环境生态危机、助力全球“碳达峰、碳中和”目标的实现具有重要意义。化学工作者致力于将 转化为各种化工原料。
转化为各种化工原料。
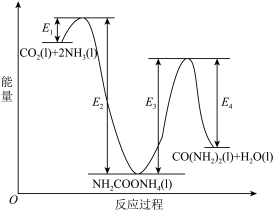
I.早在二十世纪初,工业上以 和
和 为原料在一定温度和压强下合成尿素。反应分两步:①
为原料在一定温度和压强下合成尿素。反应分两步:① 和
和 生成
生成 ;②
;② 分解生成尿素。
分解生成尿素。
(1)活化能:反应①_______ 反应②(填“>”“<”或“=”);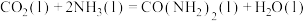

_______ (用含 、
、 、
、 、
、 的式子表示)。
的式子表示)。
Ⅱ.我国科学家研究 电池,取得了重大科研成果。
电池,取得了重大科研成果。 电池中,反应产物为
电池中,反应产物为 和单质碳,正极
和单质碳,正极 电还原后与锂离子结合形成
电还原后与锂离子结合形成 按以下4个步骤进行
按以下4个步骤进行
①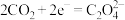
②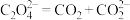
③_______
④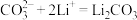
(2)写出步骤③中 与
与 反应的离子方程式:
反应的离子方程式:_______ 。
Ⅲ.利用 和
和 重整技术可获得合成气(主要成分为CO、
重整技术可获得合成气(主要成分为CO、 ),重整过程中反应的热化学方程式如下:
),重整过程中反应的热化学方程式如下:
反应i:
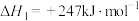
反应ii:

不同配比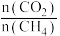 随温度变化对出口合成气中
随温度变化对出口合成气中 的影响如下图所示:
的影响如下图所示:
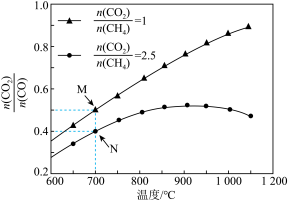
(3)对于反应i,试比较M点和N点 的转化率:M
的转化率:M_______ N(填“>”“<”或“=”,下同);平衡常数M_______ N。
(4)当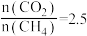 ,温度高于900℃,
,温度高于900℃, 减小的原因可能是
减小的原因可能是_______ 。
(5)在930℃、101kPa时,按投料比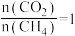 加入刚性密闭容器中,达平衡时,测得
加入刚性密闭容器中,达平衡时,测得 的转化率为90%,
的转化率为90%, 的转化率为95%,试计算反应ii的压强平衡常数
的转化率为95%,试计算反应ii的压强平衡常数
_______ (计算结果保留3位有效数字,用平衡分压代替平衡浓度,分压=总压×物质的量分数)。
 转化利用对化解全球环境生态危机、助力全球“碳达峰、碳中和”目标的实现具有重要意义。化学工作者致力于将
转化利用对化解全球环境生态危机、助力全球“碳达峰、碳中和”目标的实现具有重要意义。化学工作者致力于将 转化为各种化工原料。
转化为各种化工原料。
I.早在二十世纪初,工业上以
 和
和 为原料在一定温度和压强下合成尿素。反应分两步:①
为原料在一定温度和压强下合成尿素。反应分两步:① 和
和 生成
生成 ;②
;② 分解生成尿素。
分解生成尿素。(1)活化能:反应①
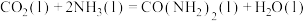

 、
、 、
、 、
、 的式子表示)。
的式子表示)。Ⅱ.我国科学家研究
 电池,取得了重大科研成果。
电池,取得了重大科研成果。 电池中,反应产物为
电池中,反应产物为 和单质碳,正极
和单质碳,正极 电还原后与锂离子结合形成
电还原后与锂离子结合形成 按以下4个步骤进行
按以下4个步骤进行①
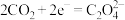
②
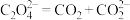
③_______
④
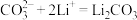
(2)写出步骤③中
 与
与 反应的离子方程式:
反应的离子方程式:Ⅲ.利用
 和
和 重整技术可获得合成气(主要成分为CO、
重整技术可获得合成气(主要成分为CO、 ),重整过程中反应的热化学方程式如下:
),重整过程中反应的热化学方程式如下:反应i:

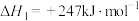
反应ii:


不同配比
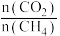 随温度变化对出口合成气中
随温度变化对出口合成气中 的影响如下图所示:
的影响如下图所示:
(3)对于反应i,试比较M点和N点
 的转化率:M
的转化率:M(4)当
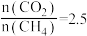 ,温度高于900℃,
,温度高于900℃, 减小的原因可能是
减小的原因可能是(5)在930℃、101kPa时,按投料比
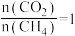 加入刚性密闭容器中,达平衡时,测得
加入刚性密闭容器中,达平衡时,测得 的转化率为90%,
的转化率为90%, 的转化率为95%,试计算反应ii的压强平衡常数
的转化率为95%,试计算反应ii的压强平衡常数
您最近一年使用:0次




