名校
解题方法
1 . 已知NaHCO3溶液与盐酸,反应生成CO2吸热,Na2CO3溶液与盐酸反应生成CO2放热。关于下列△H的判断正确的是


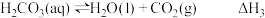
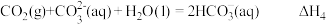


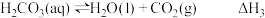
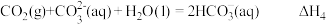
A. | B.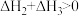 |
C.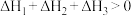 | D.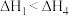 |
您最近一年使用:0次
2021-11-01更新
|
533次组卷
|
9卷引用:黑龙江省牡丹江市第一高级中学2021-2022学年高三上学期期中考试化学试题
黑龙江省牡丹江市第一高级中学2021-2022学年高三上学期期中考试化学试题浙江省杭州地区(含周边)重点中学2021-2022学年高三上学期期中考试化学试题(已下线)2021年6月浙江高考化学试题变式题21-25(已下线)解密08 化学反应与能量(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)一轮巩固卷4-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(浙江专用)浙江省杭州地区(含周边)重点中学2022-2023学年高二上学期期中考试化学试题浙江省永州市重点中学2022-2023学年高二上学期期中考试化学试题湖南省株洲市第四中学2022-2023学年高二上学期期中考试化学试题浙江省台州市路桥中学2023-2024学年高二上学期10月月考化学试题
解题方法
2 . 回答下列问题:
(1)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能量为E2,且E1>E2,则该反应为___ (填“吸热”或“放热”)反应。
②已知拆开1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为___ 。
(2)N2H4和H2O2混合可作火箭推进剂,已知:16g液态N2H4和足量氧气反应生成N2(g)和H2O(l),放出310.6kJ的热量;2H2O2(l)=O2(g)+2H2O(l) ΔH=-196.4kJ·mol-1。反应N2H4(l)+O2(g)=N2(g)+2H2O(l)的ΔH=___ kJ·mol-1。N2H4和H2O2反应生成N2(g)和H2O(l)的热化学方程式为___ 。
(3)向1L1mol/L的NaOH溶液中加入下列物质:①浓H2SO4;②稀硝酸;③稀醋酸,恰好完全反应的热效应为△H1、△H2、△H3,则三者由小到大顺序为___ 。
(1)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能量为E2,且E1>E2,则该反应为
②已知拆开1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为
(2)N2H4和H2O2混合可作火箭推进剂,已知:16g液态N2H4和足量氧气反应生成N2(g)和H2O(l),放出310.6kJ的热量;2H2O2(l)=O2(g)+2H2O(l) ΔH=-196.4kJ·mol-1。反应N2H4(l)+O2(g)=N2(g)+2H2O(l)的ΔH=
(3)向1L1mol/L的NaOH溶液中加入下列物质:①浓H2SO4;②稀硝酸;③稀醋酸,恰好完全反应的热效应为△H1、△H2、△H3,则三者由小到大顺序为
您最近一年使用:0次
名校
解题方法
3 . 100g碳燃烧所得气体中,CO占 、CO2占
、CO2占 体积,且
体积,且
C(S) + O2(g) = CO (g) △H = -110.35kJ·mol-1
O2(g) = CO (g) △H = -110.35kJ·mol-1
CO (g) + O2(g) =CO2(g) △H = - 282.57kJ·mol-1
O2(g) =CO2(g) △H = - 282.57kJ·mol-1
C(S) + O2(g) = CO2 (g) △H = -392.92kJ·mol-1
与这些碳完全燃烧相比较,损失的热量是
 、CO2占
、CO2占 体积,且
体积,且C(S) +
 O2(g) = CO (g) △H = -110.35kJ·mol-1
O2(g) = CO (g) △H = -110.35kJ·mol-1CO (g) +
 O2(g) =CO2(g) △H = - 282.57kJ·mol-1
O2(g) =CO2(g) △H = - 282.57kJ·mol-1C(S) + O2(g) = CO2 (g) △H = -392.92kJ·mol-1
与这些碳完全燃烧相比较,损失的热量是
| A.392.92kJ | B.2489.44kJ | C.784.92kJ | D.3274.3kJ |
您最近一年使用:0次
2021-10-26更新
|
100次组卷
|
2卷引用:黑龙江省牡丹江市海林市朝鲜族中学2021-2022学年上学期高二10月月考化学试题
9-10高二·山东·假期作业
名校
4 . 已知: ;
;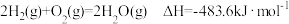 。现有0.2mol的碳粉和氢气组成的混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中C与H2的物质的量之比为
。现有0.2mol的碳粉和氢气组成的混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中C与H2的物质的量之比为
 ;
;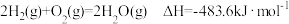 。现有0.2mol的碳粉和氢气组成的混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中C与H2的物质的量之比为
。现有0.2mol的碳粉和氢气组成的混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中C与H2的物质的量之比为| A.1∶1 | B.1∶2 | C.2∶3 | D.3∶2 |
您最近一年使用:0次
2021-10-26更新
|
958次组卷
|
37卷引用:黑龙江省七台河市勃利县高级中学2021-2022学年高三上学期期中考试化学试题
黑龙江省七台河市勃利县高级中学2021-2022学年高三上学期期中考试化学试题黑龙江省大兴安岭实验中学(西校区)2021-2022学年高二上学期第一次月考化学试题2015-2016学年黑龙江哈尔滨附属中学高二上期中化学试卷黑龙江省肇东市第一中学2016-2017学年高一下学期期中考试化学试题【全国百强校】黑龙江省双鸭山市第一中学2017-2018学年高一下学期期末考试化学试题黑龙江省双鸭山市第一中学2018-2019学年高一下学期期末考试化学试题甘肃省民勤县第一中学2021-2022学年高二上学期第一次月考化学试题河南省新乡县高级中学2021-2022学年高二上学期第一次月考化学试题山东省淄博市高青县第一中学2021-2022学年高二10月月考化学试题云南省昆明市官渡区第一中学2021-2022学年高二上学期期中考试化学试题(已下线)2010年安丘中学高二暑期练习化学卷(三)(已下线)2011-2012学年甘肃省白银市平川中恒学校高二上学期期末考试化学(理)试卷(已下线)2014-2015学年吉林延边二中高二9月阶段考试化学试卷2014-2015内蒙古满洲里市七中高二上学期第二次月考化学试卷2014-2015四川省雅安中学高二下学期开学考试化学试卷2015-2016学年山西太原五中高二上第一周考理科化学试卷2015-2016学年辽宁省实验中学分校高一下期中化学试卷2016-2017学年四川省成都开发区实验中学高二10月月考化学卷云南省临沧市第一中学2017-2018学年高二上学期第二次月考理综化学试题河北省邱县第一中学2017-2018学年高二上学期第一次月考化学试题河北省馆陶县第一中学2017-2018学年高二上学期第一次月考化学试题内蒙古杭锦后旗奋斗中学2017-2018学年高二上学期期末考试化学试题宁夏石嘴山市第三中学2017-2018学年高二下学期第一次月考化学试题【全国校级联考】山西省汾阳市第二高级中学、文水县第二高级中学2016-2017学年高二上学期第一次联考化学试题广东省广州市中山大学附属中学2018-2019学年高二上学期期中考试化学试题江西省九江市同文中学2018-2019学年高二上学期期中考试化学试题河北省临漳县第一中学2019-2020学年高二上学期期中考试化学试题安徽省芜湖市城南实验中学2019-2020学年高二上学期期中考试化学试题四川省广安市岳池县第一中学2019-2020学年高二上学期第一次月考化学试题浙江省湖州中学2019-2020学年高一下学期3月月考(普通班)化学试题(已下线)【南昌新东方】江西省九江市同文中学2018-2019学年高二上学期期中考试化学试题(已下线)第01章 化学反应的热效应(A卷基础强化篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)(已下线)第1章 章末检测-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)辽源市第五中学2019-2020学年高一下学期第二次月考化学试题重庆市复旦中学2020-2021学度高二上学期第一次段考化学试题湖北省黄冈市麻城第二中学2021-2022学年高一下学期4月月考化学试题云南省下关第一中学2023-2024学年高二上学期9月月考化学试题
名校
解题方法
5 . 回答下列问题:
(1)用50mL0.50mol·L-1的盐酸与50mL0.55mol·L-1的NaOH溶液在如下图所示的装置中进行中和反应,通过测定反应过程中放出的热量可计算中和反应反应热。回答下列问题:
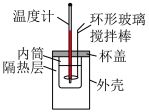
①若将杯盖改为薄铁板,求得的反应热数值将___ (填“偏大”“偏小”或“不变”)。
②若通过测定计算出产生的热量为1.42kJ,请写出该反应的热化学方程式:___ 。
(2)①已知:CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=+247.4kJ·mol-1
则CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为___ 。
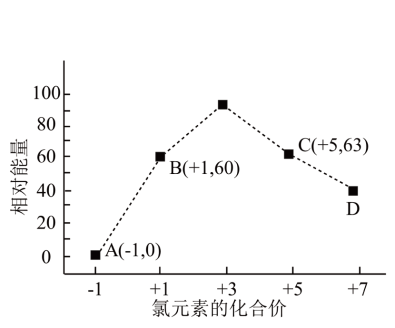
②一定条件下,水溶液中所含离子Cl-、ClO-、ClO 、ClO
、ClO 、ClO
、ClO 各1mol,其相对能量的大小如下图所示(各离子在图中用氯元素的相应化合价表示),则反应3ClO-(aq)=ClO
各1mol,其相对能量的大小如下图所示(各离子在图中用氯元素的相应化合价表示),则反应3ClO-(aq)=ClO (aq)+2Cl-(aq)的 △H=
(aq)+2Cl-(aq)的 △H=___ kJ·mol-1。
(1)用50mL0.50mol·L-1的盐酸与50mL0.55mol·L-1的NaOH溶液在如下图所示的装置中进行中和反应,通过测定反应过程中放出的热量可计算中和反应反应热。回答下列问题:

①若将杯盖改为薄铁板,求得的反应热数值将
②若通过测定计算出产生的热量为1.42kJ,请写出该反应的热化学方程式:
(2)①已知:CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=+247.4kJ·mol-1
则CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为
②一定条件下,水溶液中所含离子Cl-、ClO-、ClO
 、ClO
、ClO 、ClO
、ClO 各1mol,其相对能量的大小如下图所示(各离子在图中用氯元素的相应化合价表示),则反应3ClO-(aq)=ClO
各1mol,其相对能量的大小如下图所示(各离子在图中用氯元素的相应化合价表示),则反应3ClO-(aq)=ClO (aq)+2Cl-(aq)的 △H=
(aq)+2Cl-(aq)的 △H=
您最近一年使用:0次
2021-10-24更新
|
806次组卷
|
8卷引用:黑龙江省宾县第一中学2021-2022学年高二上学期第一次月考化学试题
名校
6 . 已知: ;
;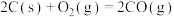
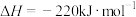 ;
;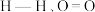 和
和 键的键能分别为436,496和
键的键能分别为436,496和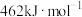 ,则a为
,则a为
 ;
;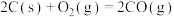
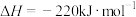 ;
;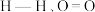 和
和 键的键能分别为436,496和
键的键能分别为436,496和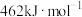 ,则a为
,则a为A.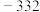 | B.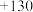 | C. | D.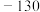 |
您最近一年使用:0次
2021-10-23更新
|
135次组卷
|
2卷引用:黑龙江省哈尔滨市依兰县高级中学2021-2022学年高二上学期第一次月考化学试题
7 . 回答下列问题
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g) NH2COONH4(s) ΔH1
NH2COONH4(s) ΔH1
反应Ⅱ:NH2COONH4(s) CO(NH2)2(s)+H2O(g) ΔH2=+72.49 kJ·mol-1
CO(NH2)2(s)+H2O(g) ΔH2=+72.49 kJ·mol-1
总反应:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) ΔH3=-86.98 kJ·mol-1
CO(NH2)2(s)+H2O(g) ΔH3=-86.98 kJ·mol-1
则反应Ⅰ的ΔH1=___________ kJ·mol-1。
(2)氢气可将CO2还原为甲烷,反应为CO2(g)+4H2(g) CH4(g)+2H2O(g)。ShyamKattel等结合实验与计算机模拟结果,研究了在Pt/SiO2催化剂表面上CO2与H2的反应历程,前三步历程如图所示,其中吸附在Pt/SiO2催化剂表面用“·”标注,Ts表示过渡态。物质吸附在催化剂表面,形成过渡态的过程会
CH4(g)+2H2O(g)。ShyamKattel等结合实验与计算机模拟结果,研究了在Pt/SiO2催化剂表面上CO2与H2的反应历程,前三步历程如图所示,其中吸附在Pt/SiO2催化剂表面用“·”标注,Ts表示过渡态。物质吸附在催化剂表面,形成过渡态的过程会___________ (填“放出热量”或“吸收热量”);反应历程中最小能垒步骤的化学方程式为___________ 。
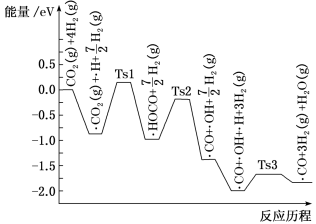
(3)已知CO(g)、CH4(g)、CH3CHO(l)的燃烧热分别为283.0 kJ·mol-1、890.31 kJ·mol-1、1167.9 kJ·mol-1,则乙醛的分解反应CH3CHO(l) CH4(g)+CO(g)的ΔH=
CH4(g)+CO(g)的ΔH=___________ 。
(4)已知断开1 mol H-H键、1 mol N-H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式是___________ 。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g)
 NH2COONH4(s) ΔH1
NH2COONH4(s) ΔH1反应Ⅱ:NH2COONH4(s)
 CO(NH2)2(s)+H2O(g) ΔH2=+72.49 kJ·mol-1
CO(NH2)2(s)+H2O(g) ΔH2=+72.49 kJ·mol-1总反应:2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) ΔH3=-86.98 kJ·mol-1
CO(NH2)2(s)+H2O(g) ΔH3=-86.98 kJ·mol-1则反应Ⅰ的ΔH1=
(2)氢气可将CO2还原为甲烷,反应为CO2(g)+4H2(g)
 CH4(g)+2H2O(g)。ShyamKattel等结合实验与计算机模拟结果,研究了在Pt/SiO2催化剂表面上CO2与H2的反应历程,前三步历程如图所示,其中吸附在Pt/SiO2催化剂表面用“·”标注,Ts表示过渡态。物质吸附在催化剂表面,形成过渡态的过程会
CH4(g)+2H2O(g)。ShyamKattel等结合实验与计算机模拟结果,研究了在Pt/SiO2催化剂表面上CO2与H2的反应历程,前三步历程如图所示,其中吸附在Pt/SiO2催化剂表面用“·”标注,Ts表示过渡态。物质吸附在催化剂表面,形成过渡态的过程会
(3)已知CO(g)、CH4(g)、CH3CHO(l)的燃烧热分别为283.0 kJ·mol-1、890.31 kJ·mol-1、1167.9 kJ·mol-1,则乙醛的分解反应CH3CHO(l)
 CH4(g)+CO(g)的ΔH=
CH4(g)+CO(g)的ΔH=(4)已知断开1 mol H-H键、1 mol N-H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式是
您最近一年使用:0次
名校
解题方法
8 . 化学反应所提供的能量大大促进了社会的发展。请回答下列问题:
(1)将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作火箭和导弹表面的耐高温材料: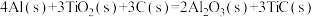
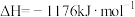 ,该反应过程中,每转移1 mol电子放出的热量为
,该反应过程中,每转移1 mol电子放出的热量为___________ 。
(2)键能可用于估算化学反应的反应热。已知白磷的燃烧热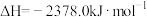 ,白磷完全燃烧的产物结构如图所示,下表是部分化学键的键能数据,其中X=
,白磷完全燃烧的产物结构如图所示,下表是部分化学键的键能数据,其中X=___________ 。
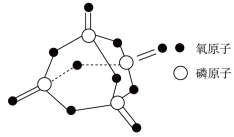
(3)我国科学家实现了在铜催化条件下将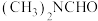 转化为
转化为 。计算机模拟
。计算机模拟单个分子 在铜催化剂表面的反应历程如图所示。
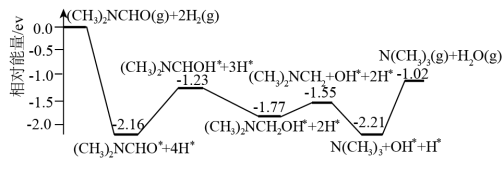
用相对能量 的变化来表示 ,写出该反应的热化学方程式
,写出该反应的热化学方程式___________ 。
(4)处理废水中的 可在微生物的作用下经过两步反应转化为
可在微生物的作用下经过两步反应转化为 ,两步反应的能量变化如图所示:
,两步反应的能量变化如图所示:
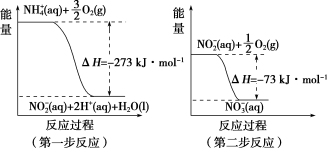
则1 mol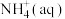 被氧化成
被氧化成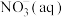 的热化学方程式是
的热化学方程式是___________ 。
(5)已知25℃和101 kPa下:
①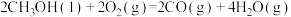
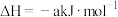
②
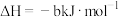
③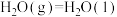

则表示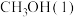 燃烧热的热化学方程式为
燃烧热的热化学方程式为___________ 。
(1)将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作火箭和导弹表面的耐高温材料:
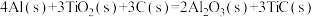
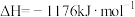 ,该反应过程中,每转移1 mol电子放出的热量为
,该反应过程中,每转移1 mol电子放出的热量为(2)键能可用于估算化学反应的反应热。已知白磷的燃烧热
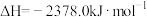 ,白磷完全燃烧的产物结构如图所示,下表是部分化学键的键能数据,其中X=
,白磷完全燃烧的产物结构如图所示,下表是部分化学键的键能数据,其中X=
| 化学键 | P-P | P-O | O=O | P=O |
键能/( ) ) | X | 335 | 498 | 470 |
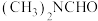 转化为
转化为 。计算机模拟
。计算机模拟
用
 ,写出该反应的热化学方程式
,写出该反应的热化学方程式(4)处理废水中的
 可在微生物的作用下经过两步反应转化为
可在微生物的作用下经过两步反应转化为 ,两步反应的能量变化如图所示:
,两步反应的能量变化如图所示:
则1 mol
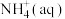 被氧化成
被氧化成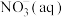 的热化学方程式是
的热化学方程式是(5)已知25℃和101 kPa下:
①
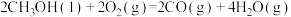
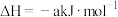
②

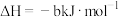
③
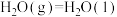

则表示
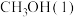 燃烧热的热化学方程式为
燃烧热的热化学方程式为
您最近一年使用:0次
名校
9 . 已知 溶液与盐酸反应生成
溶液与盐酸反应生成 吸热,
吸热, 溶液与盐酸反应生成
溶液与盐酸反应生成 放热。关于下列
放热。关于下列 的判断错误的是
的判断错误的是
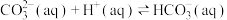

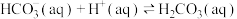

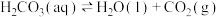

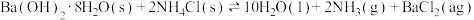

 溶液与盐酸反应生成
溶液与盐酸反应生成 吸热,
吸热, 溶液与盐酸反应生成
溶液与盐酸反应生成 放热。关于下列
放热。关于下列 的判断错误的是
的判断错误的是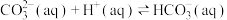

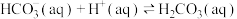

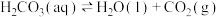

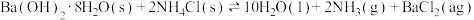

A. | B.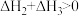 |
C. | D.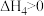 |
您最近一年使用:0次
2021-10-22更新
|
129次组卷
|
2卷引用:黑龙江省哈尔滨市第三中学2021-2022学年高二上学期10月阶段性测试化学试题
名校
10 . 碳及其化合物在生产、生活中广泛存在。请回答下列问题:
已知甲烷隔绝空气在不同温度下有可能发生如下两个裂解反应:
①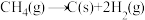
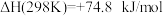
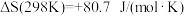
②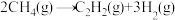
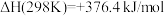
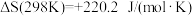
某同学为了得到用天然气制取炭黑的允许温度范围和最佳温度,在图书馆查到如下热力学数据:
(1)反应①属于___________ (填“高温”或“低温”)自发反应。反应①自发进行是由___________ (填“焓变”或“熵变”)决定的。
(2)已知:①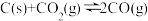
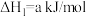 平衡常数K1
平衡常数K1
②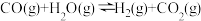
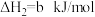 平衡常数K2
平衡常数K2
③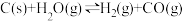
 平衡常数K3
平衡常数K3
写出K1表达式K1=___________ ;K1、K2、K3之间的关系是K3=___________ ;下列措施中能加快反应③速率,且增大H2产率的是___________ 。
A.向体系中加入碳 B.恒容充入惰性气体 C.恒压充入惰性气体 D.充入水蒸气
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气2L密闭容器中,发生如下反应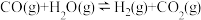 。该反应平衡常数随温度的变化如表所示:该反应的正反应方向是
。该反应平衡常数随温度的变化如表所示:该反应的正反应方向是___________ 反应(填“吸热”或“放热”)。
(4)若在500℃时进行,设起始时CO和H2O起始浓度均为0.02mol/L,在该条件下,CO的平衡转化率为___________ 。
(5)保持温度500℃不变,某一体积为1L的密闭容器中加入该反应中四种物质各2mol,则此时反应移动___________ (填“正向”、“逆向”或“不”),理由是:___________ 。
已知甲烷隔绝空气在不同温度下有可能发生如下两个裂解反应:
①
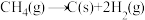
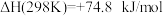
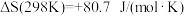
②
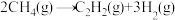
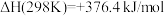
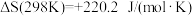
某同学为了得到用天然气制取炭黑的允许温度范围和最佳温度,在图书馆查到如下热力学数据:
(1)反应①属于
(2)已知:①
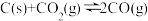
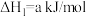 平衡常数K1
平衡常数K1②
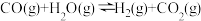
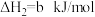 平衡常数K2
平衡常数K2③
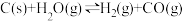
 平衡常数K3
平衡常数K3写出K1表达式K1=
A.向体系中加入碳 B.恒容充入惰性气体 C.恒压充入惰性气体 D.充入水蒸气
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气2L密闭容器中,发生如下反应
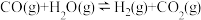 。该反应平衡常数随温度的变化如表所示:该反应的正反应方向是
。该反应平衡常数随温度的变化如表所示:该反应的正反应方向是| 温度/℃ | 400 | 500 | 800 |
| 平衡常数/K | 9.94 | 9 | 1 |
(5)保持温度500℃不变,某一体积为1L的密闭容器中加入该反应中四种物质各2mol,则此时反应移动
您最近一年使用:0次
2021-10-22更新
|
129次组卷
|
3卷引用:黑龙江省大庆中学2021-2022学年高二上学期第一次月考化学试题



