名校
1 . 已知热化学方程式: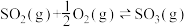
 ,向容器中充入4mol
,向容器中充入4mol 和4mol
和4mol ,当放出157.15kJ热量时,
,当放出157.15kJ热量时, 的转化率最接近于
的转化率最接近于
 ,向容器中充入4mol
,向容器中充入4mol 和4mol
和4mol ,当放出157.15kJ热量时,
,当放出157.15kJ热量时, 的转化率最接近于
的转化率最接近于| A.40% | B.50% | C.80% | D.90% |
您最近一年使用:0次
2 . SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:
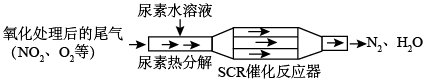
尿素[CO(NH2)2]水溶液热分解为NH3和CO2,请写出CO2的电子式___________ 。
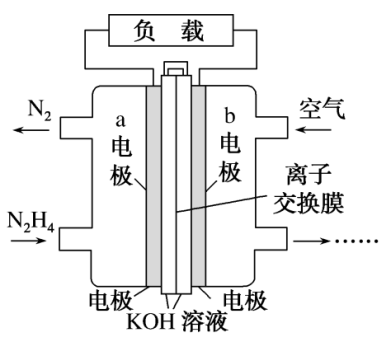
(2)肼(N2H4)可以用作燃料电池的原料。肼的结构式为___________ ;一种以液态肼为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。a电极是电极的___________ 极(填“正”或“负”),a电极的电极反应式为___________ 。
(3)已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ·mol-1
C(s)+O2(g)=CO2(g)△H2=-393.5kJ·mol-1
2C(s)+O2(g)=2CO(g)△H3=-221.0kJ·mol-1
若某反应的平衡常数表达式为K=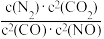 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式___________ 。
(4)已知植物光合作用发生的反应如下:6CO2(g)+6H2O(l)⇌C6H12O6(s)+6O2(g)△H=+669.62kJ/mol,该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是___________ 。
a.增大CO2的浓度b.取走一半C6H12O6c.加入催化剂d.适当升高温度
(5)N2O5的分解反应2N2O5(g)⇌4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
计算在0~2min时段,化学反应速率v(NO2)=___________ mol∙L-1∙min-1。
(1)SCR(选择性催化还原)工作原理:

尿素[CO(NH2)2]水溶液热分解为NH3和CO2,请写出CO2的电子式
(2)肼(N2H4)可以用作燃料电池的原料。肼的结构式为

(3)已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ·mol-1
C(s)+O2(g)=CO2(g)△H2=-393.5kJ·mol-1
2C(s)+O2(g)=2CO(g)△H3=-221.0kJ·mol-1
若某反应的平衡常数表达式为K=
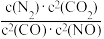 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式(4)已知植物光合作用发生的反应如下:6CO2(g)+6H2O(l)⇌C6H12O6(s)+6O2(g)△H=+669.62kJ/mol,该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是
a.增大CO2的浓度b.取走一半C6H12O6c.加入催化剂d.适当升高温度
(5)N2O5的分解反应2N2O5(g)⇌4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| C(N2O5)/(mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
计算在0~2min时段,化学反应速率v(NO2)=
您最近一年使用:0次
2021-11-19更新
|
105次组卷
|
2卷引用:黑龙江省龙东地区四校2021-2022学年高三上学期第一次联考化学试题
名校
3 . 工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
(1)已知: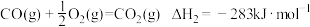

则表示1mol气态甲醇完全燃烧生成 和水蒸气时的热化学方程式为
和水蒸气时的热化学方程式为___________ 。
(2)CO和H2为原料合成甲醇,下列措施中有利于增大该反应的反应速率且利于反应正向进行的是___________(填字母)。
(3) 时,CO和H2为原料合成甲醇,在体积为2L的密闭容器中加入
时,CO和H2为原料合成甲醇,在体积为2L的密闭容器中加入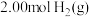 和
和 。CO(g)的物质的量随时间的变化如表:
。CO(g)的物质的量随时间的变化如表:
根据表中数据回答:
①氢气平衡转化率为___________ 。
② 时,该反应的平衡常数为
时,该反应的平衡常数为___________ 。
③保持其它条件不变,向平衡体系中充入1molCO(g)、 、
、 。此时
。此时
___________  (填“>”“<”或“=”)
(填“>”“<”或“=”)
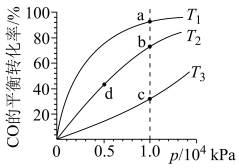
(4)CO和H2为原料合成甲醇,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示,下列说法正确的是___________

(1)已知:
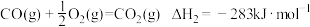

则表示1mol气态甲醇完全燃烧生成
 和水蒸气时的热化学方程式为
和水蒸气时的热化学方程式为(2)CO和H2为原料合成甲醇,下列措施中有利于增大该反应的反应速率且利于反应正向进行的是___________(填字母)。
| A.随时将CH3OH与反应混合物分离 | B.降低反应温度 |
| C.增大体系压强 | D.便用高效催化剂 |
 时,CO和H2为原料合成甲醇,在体积为2L的密闭容器中加入
时,CO和H2为原料合成甲醇,在体积为2L的密闭容器中加入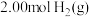 和
和 。CO(g)的物质的量随时间的变化如表:
。CO(g)的物质的量随时间的变化如表:| 时间/s | 0 | 2 | 5 | 10 | 20 | 40 | 80 |
| 物质的量(mol) | 1.00 | 0.50 | 0.375 | 0.25 | 0.20 | 0.20 | 0.20 |
根据表中数据回答:
①氢气平衡转化率为
②
 时,该反应的平衡常数为
时,该反应的平衡常数为③保持其它条件不变,向平衡体系中充入1molCO(g)、
 、
、 。此时
。此时
 (填“>”“<”或“=”)
(填“>”“<”或“=”)(4)CO和H2为原料合成甲醇,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示,下列说法正确的是___________

| A.温度:T1>T2>T3 |
| B.正反应速率:v(a)>v(c)、v(b)>v(d) |
| C.反应速率:v正(d)<v逆(c) |
| D.平均摩尔质量:M(a)>M(c)、M(b)<M(d) |
您最近一年使用:0次
名校
4 . 工业合成三氧化硫的反应为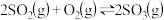

 ,反应过程可用下图模拟(
,反应过程可用下图模拟( 代表氧原子,
代表氧原子, 代表硫原子,
代表硫原子, 代表催化剂),下列说法正确的是
代表催化剂),下列说法正确的是

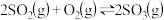

 ,反应过程可用下图模拟(
,反应过程可用下图模拟( 代表氧原子,
代表氧原子, 代表硫原子,
代表硫原子, 代表催化剂),下列说法正确的是
代表催化剂),下列说法正确的是
| A.过程II放热,过程III吸热 |
B.充入2mol 发生上述反应的逆反应,吸收的热量小于198kJ 发生上述反应的逆反应,吸收的热量小于198kJ |
C.催化剂可增大反应的活化分子百分数,使 减小 减小 |
| D.2molSO2和1molO2的总能量小于2molSO3的能量 |
您最近一年使用:0次
2021-11-13更新
|
82次组卷
|
2卷引用:黑龙江省双鸭山市第一中学2021-2022学年高二上学期期中考试化学试题
名校
5 . 按要求完成下列各题。
(1)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:
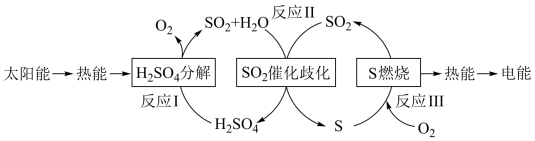
反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297kJ·mol-1
反应Ⅱ的热化学方程式:___ 。
(2)CH4超干重整CO2的催化转化如图1所示:
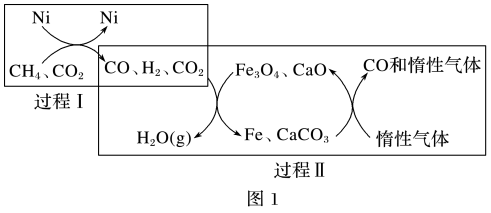
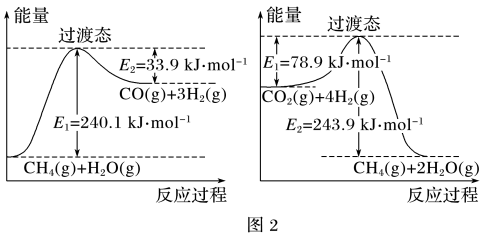
已知相关反应的能量变化如图2所示,过程Ⅰ的热化学方程式为___ 。
(3)关于上述过程Ⅱ的说法不正确的是___ (填字母)。
a.实现了含碳物质与含氢物质的分离 b.可表示为CO2+H2=H2O(g)+CO
c.CO未参与反应 d.Fe3O4、CaO为催化剂,降低了反应的ΔH
(4)利用如图所示装置测定中和反应反应热的实验步骤如下:
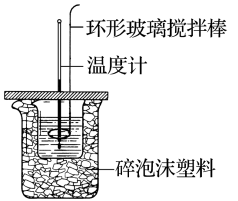
①用量筒量取50mL0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50mL0.55mol·L-1NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液的最高温度。回答下列问题:
Ⅰ.为什么所用NaOH溶液要稍过量?___ 。
Ⅱ.现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L1mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为___ 。
Ⅲ.假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热ΔH=___ (结果保留一位小数)。
(1)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:

反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297kJ·mol-1
反应Ⅱ的热化学方程式:
(2)CH4超干重整CO2的催化转化如图1所示:


已知相关反应的能量变化如图2所示,过程Ⅰ的热化学方程式为
(3)关于上述过程Ⅱ的说法不正确的是
a.实现了含碳物质与含氢物质的分离 b.可表示为CO2+H2=H2O(g)+CO
c.CO未参与反应 d.Fe3O4、CaO为催化剂,降低了反应的ΔH
(4)利用如图所示装置测定中和反应反应热的实验步骤如下:

①用量筒量取50mL0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50mL0.55mol·L-1NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液的最高温度。回答下列问题:
Ⅰ.为什么所用NaOH溶液要稍过量?
Ⅱ.现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L1mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为
Ⅲ.假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
| 序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.2 | 23.2 |
| 2 | 20.2 | 20.6 | 24.4 |
| 3 | 20.5 | 20.7 | 23.7 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=
您最近一年使用:0次
解题方法
6 . 已知下列热化学方程式:
①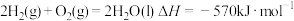
②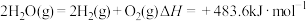
③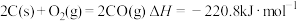
④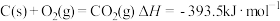
回答下列问题:
(1)上述反应中属于放热反应的是___________ (填写序号)。
(2) 的燃烧热为
的燃烧热为___________ 。
(3)燃烧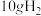 生成液态水,放出的热量为
生成液态水,放出的热量为___________ 。
(4) 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为___________ 。
(5)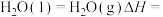
___________ 。
①
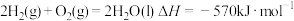
②
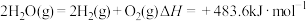
③
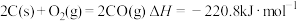
④
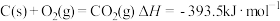
回答下列问题:
(1)上述反应中属于放热反应的是
(2)
 的燃烧热为
的燃烧热为(3)燃烧
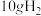 生成液态水,放出的热量为
生成液态水,放出的热量为(4)
 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为(5)
您最近一年使用:0次
2021-11-09更新
|
89次组卷
|
2卷引用:黑龙江省哈尔滨市依兰县高级中学2021-2022学年高二上学期第一次月考化学试题
名校
7 . 实验题
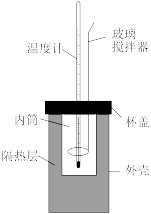
(1)用50mL0.50mol/L的盐酸与50mL0.55mol/L的 溶液在如下图所示的装置中进行中和反应,通过测定反应过程中放出的热量可计算中和反应反应热。
溶液在如下图所示的装置中进行中和反应,通过测定反应过程中放出的热量可计算中和反应反应热。
回答下列问题:(①②③填“偏大”“偏小”或“无影响”)。
①若将杯盖改为薄铁板,则求得的ΔH会___________
②混合酸、碱溶液时,动作缓慢,则求得的ΔH会___________
③若将盐酸改为醋酸,则求得的ΔH会___________
④实验中加入过量碱的原因是___________
⑤若通过测定计算出产生的热量为1.42kJ,请写出该反应的热化学方程式:___________ 。
(2)已知:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.2kJ/mol
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247.4kJ/mol
则CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为___________ 。
(3)SF6是一种优良的绝缘气体,分子结构中,只存在S-F键,已知1molS(s)转化为气态硫原子吸收能量280kJ,F-F键能为160kJ·mol-1,S-F键能为330kJ·mol-1,试写出S(s)和F2(g)反应生成SF6(g)的热化学方程式___________ 。
(1)用50mL0.50mol/L的盐酸与50mL0.55mol/L的
 溶液在如下图所示的装置中进行中和反应,通过测定反应过程中放出的热量可计算中和反应反应热。
溶液在如下图所示的装置中进行中和反应,通过测定反应过程中放出的热量可计算中和反应反应热。
回答下列问题:(①②③填“偏大”“偏小”或“无影响”)。
①若将杯盖改为薄铁板,则求得的ΔH会
②混合酸、碱溶液时,动作缓慢,则求得的ΔH会
③若将盐酸改为醋酸,则求得的ΔH会
④实验中加入过量碱的原因是
⑤若通过测定计算出产生的热量为1.42kJ,请写出该反应的热化学方程式:
(2)已知:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.2kJ/mol
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247.4kJ/mol
则CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为
(3)SF6是一种优良的绝缘气体,分子结构中,只存在S-F键,已知1molS(s)转化为气态硫原子吸收能量280kJ,F-F键能为160kJ·mol-1,S-F键能为330kJ·mol-1,试写出S(s)和F2(g)反应生成SF6(g)的热化学方程式
您最近一年使用:0次
2021-11-08更新
|
100次组卷
|
2卷引用:黑龙江省牡丹江市第三中学2021-2022学年高二上学期期中考试化学(理)试题
名校
解题方法
8 . 回答下列问题
(1)已知:①2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s) ΔH1=+234.1 kJ·mol-1
②C(s)+O2(g=CO2(g) ΔH2=-393.5 kJ·mol-1
则Fe和O2反应生成Fe2O3的热化学反应方程式为_______ 。
(2)①为了更好的表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG的定义为AG=lg 。25℃时,溶液的pH与AG的换算公式为AG=
。25℃时,溶液的pH与AG的换算公式为AG=_______ ,若溶液呈中性,则AG=_______ 。
②25℃时,将体积Va、pH=a的某一元强碱与体积为Vb、pH=b的某二元强酸混合;若所得溶液的pH=7,且已知Va>Vb,b=0.5a,b值可否等于4_______ (填“可”或“否”)。
(3)实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如表。
请完成下列填空:
①滴定达到终点的标志是_______ 。
②根据上述数据,可计算出该盐酸的浓度约为_______ (保留两位有效数字)。
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______ (填字母序号)。
A.滴定终点读数时俯视
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.称量NaOH固体中混有Na2CO3固体
E.碱式滴定管尖嘴部分有气泡,滴定后消失
(1)已知:①2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s) ΔH1=+234.1 kJ·mol-1
②C(s)+O2(g=CO2(g) ΔH2=-393.5 kJ·mol-1
则Fe和O2反应生成Fe2O3的热化学反应方程式为
(2)①为了更好的表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG的定义为AG=lg
 。25℃时,溶液的pH与AG的换算公式为AG=
。25℃时,溶液的pH与AG的换算公式为AG=②25℃时,将体积Va、pH=a的某一元强碱与体积为Vb、pH=b的某二元强酸混合;若所得溶液的pH=7,且已知Va>Vb,b=0.5a,b值可否等于4
(3)实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如表。
| 实验编号 | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
| 1 | 0.10 | 22.65 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.93 | 20.00 |
①滴定达到终点的标志是
②根据上述数据,可计算出该盐酸的浓度约为
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有
A.滴定终点读数时俯视
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.称量NaOH固体中混有Na2CO3固体
E.碱式滴定管尖嘴部分有气泡,滴定后消失
您最近一年使用:0次
10-11高二上·山西临汾·期中
名校
解题方法
9 . 已知热化学反应方程式:Zn(s)+ O2(g)=ZnO(s) ΔH=-351.5kJ·mol-1;Hg(l)+
O2(g)=ZnO(s) ΔH=-351.5kJ·mol-1;Hg(l)+ O2(g)=HgO(s) ΔH=-90.84kJ·mol-1,则热化学反应方程式:Zn(s)+HgO(s)=ZnO(s)+Hg(l)的ΔH为
O2(g)=HgO(s) ΔH=-90.84kJ·mol-1,则热化学反应方程式:Zn(s)+HgO(s)=ZnO(s)+Hg(l)的ΔH为
 O2(g)=ZnO(s) ΔH=-351.5kJ·mol-1;Hg(l)+
O2(g)=ZnO(s) ΔH=-351.5kJ·mol-1;Hg(l)+ O2(g)=HgO(s) ΔH=-90.84kJ·mol-1,则热化学反应方程式:Zn(s)+HgO(s)=ZnO(s)+Hg(l)的ΔH为
O2(g)=HgO(s) ΔH=-90.84kJ·mol-1,则热化学反应方程式:Zn(s)+HgO(s)=ZnO(s)+Hg(l)的ΔH为| A.ΔH=+260.66kJ·mol-1 | B.ΔH=+442.34kJ·mol-1 |
| C.ΔH=-442.34kJ·mol-1 | D.ΔH=-260.66kJ·mol-1 |
您最近一年使用:0次
2021-11-08更新
|
147次组卷
|
27卷引用:黑龙江省绥化地区肇东第四中学2020-2021学年高二上学期期末考试化学试题
黑龙江省绥化地区肇东第四中学2020-2021学年高二上学期期末考试化学试题湖南省常德市石门县第六中学2020-2021学年高二上学期期末考试(合格考)化学试题吉林省大安市第六中学2021-2022学年高二上学期第一次月考化学试题湖南省长沙铁路第一中学2021-2022学年高二上学期第一次阶段性考试化学试题海南省海口嘉勋高级中学2021-2022学年高二上学期10月月考化学试题(已下线)必考点01 化学反应的热效应-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)云南省红河县一中2021-2022学年高二上学期期中考试化学试题黑龙江省鸡西市第四中学2022-2023学年高二上学期第一次月考化学试题(已下线)2010年山西省临汾一中高二上学期期中考试化学试题(已下线)2011-2012学年江西省兴国县将军中学高二上学期期中考试化学试卷(已下线)2011-2012学年福建省厦门一中高二上学期期中考试化学试卷(已下线)2011-2012学年辽宁省抚顺县高级中学高一下学期期中考试化学试卷(已下线)2012-2013学年浙江省桐乡一中高二下学期期中考试化学试卷(已下线)2012-2013学年新疆兵团农二师华山中学高二上学期期末考试化学试卷(已下线)2014届贵州省六校联盟高三第一次联考化学试卷2015-2016学年吉林省吉林五十五中高二上学期期中(理)化学试卷2015-2016北京大学附中宇华教育集团高二12月化学卷2015-2016北京大学附中宇华教育集团高一12月化学卷2015-2016学年陕西省黄陵中学高二上学期期末考试化学试卷2015-2016学年安徽省安庆市怀宁县高河中学高二上期末化学试卷甘肃省武威第五中学2018-2019学年高二上学期期末考试化学试题宁夏青铜峡市高级中学(吴忠中学分校)2019-2020学年高二上学期第一次月考化学试题福建省华安一中、龙海二中2019-2020学年高二上学期第一次联考化学试题甘肃省古浪县第二中学2019-2020学年高二12月基础知识竞赛化学试题【懂做原理题】2020届高三化学选修4二轮专题练——盖斯定律的应用【选择提升24题】甘肃省天水市武山县三校2020-2021学年高二上学期期中联考化学试题 安徽省芜湖市无为襄安中学2022-2023高二上学期第一次月考化学试题
解题方法
10 . 回答下列问题:
(1)已知:
①P4(s、白磷)+5O2(g)=P4O10(s) ΔH 1=-2983.2 kJ/mol
②P(s、红磷)+ O2(g)=
O2(g)= P4O10(s) ΔH 2= -738.5 kJ/mol
P4O10(s) ΔH 2= -738.5 kJ/mol
试写出白磷转化为红磷的热化学方程式___________ 。
(2)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,该反应的中和热为___________ ,表示其中和热的热化学方程式为___________ 。
(3)已知水的比热容为c=4.18J·(g·℃)-1,10g 硫黄在 O2中完全燃烧生成气态SO2,放出的热量能使500g H2O温度由18℃升至62.4℃,则硫黄的燃烧热为___________ ,热化学方程式为___________ 。
(1)已知:
①P4(s、白磷)+5O2(g)=P4O10(s) ΔH 1=-2983.2 kJ/mol
②P(s、红磷)+
 O2(g)=
O2(g)= P4O10(s) ΔH 2= -738.5 kJ/mol
P4O10(s) ΔH 2= -738.5 kJ/mol试写出白磷转化为红磷的热化学方程式
(2)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,该反应的中和热为
(3)已知水的比热容为c=4.18J·(g·℃)-1,10g 硫黄在 O2中完全燃烧生成气态SO2,放出的热量能使500g H2O温度由18℃升至62.4℃,则硫黄的燃烧热为
您最近一年使用:0次



