名校
1 . 氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有若重要作用。
(1)如图是1molNO2(g)和ImolCO(g)反应生成1molCO2(g)和1molNO(g)过程中能量变化示意图。
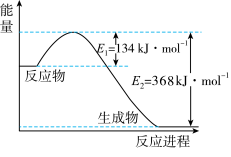
①该反应是___________ (填“吸热”或“放热”)反应。
②请写出反应的热化学方程式___________ 。
③若在反应体系中加入催化剂能使反应热___________ 。(填“增大”、“不变”或"减小")
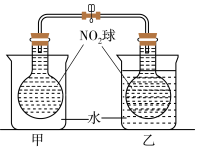
(2)已知,可逆反应2NO2(g) N2O4(g) △H =-56.9kJ/mol,在乙烧杯中投入一定量的CaO固体,此烧杯中NO2球的红棕色会
N2O4(g) △H =-56.9kJ/mol,在乙烧杯中投入一定量的CaO固体,此烧杯中NO2球的红棕色会______ (填“变深”、“不变”或“变浅”),能量发生这种变化的原因是______ 。
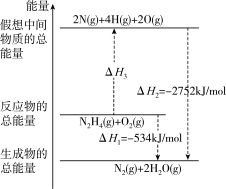
(3)肼(N2H4)是一种应用广泛的化工原料,可能量作为火箭发动机的燃料。已知断裂1mol化学键所需的能量:N≡N为942kJ、O=O为500kJ、N-N为154kJ,则断裂1molN-H键所需的能量是___________ kJ。
(1)如图是1molNO2(g)和ImolCO(g)反应生成1molCO2(g)和1molNO(g)过程中能量变化示意图。

①该反应是
②请写出反应的热化学方程式
③若在反应体系中加入催化剂能使反应热
(2)已知,可逆反应2NO2(g)
 N2O4(g) △H =-56.9kJ/mol,在乙烧杯中投入一定量的CaO固体,此烧杯中NO2球的红棕色会
N2O4(g) △H =-56.9kJ/mol,在乙烧杯中投入一定量的CaO固体,此烧杯中NO2球的红棕色会
(3)肼(N2H4)是一种应用广泛的化工原料,可能量作为火箭发动机的燃料。已知断裂1mol化学键所需的能量:N≡N为942kJ、O=O为500kJ、N-N为154kJ,则断裂1molN-H键所需的能量是

您最近一年使用:0次
名校
2 . 铜冶金技术以火法冶炼为主。
(1)火法炼铜的工艺流程如下:
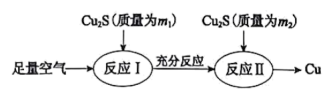
反应I:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) △H=-768.2kJ·mol-1
反应Ⅱ:2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g) △H=+116.0 kJ·mol-1
①在反应Ⅱ中,每生成1molSO2转移电子___________ mol。
②反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的△H=___________ kJ·mol-1 。
③理论上m1:m2=___________ 。
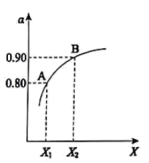
(2)炼铜的副产品SO2多用于制硫酸和石膏等化学产品。制硫酸中重要的一步反应是:2SO2(g)+O2(g) 2SO3(g) △H=-196kJ·mol-1。如图表示将2.0molSO2和1.0molO2置于1L密闭容器中,当其他条件一定时,SO2(g)的平衡转化率α随X的变化关系,X(X1、X2)代表压强或温度。X代表的物理量是
2SO3(g) △H=-196kJ·mol-1。如图表示将2.0molSO2和1.0molO2置于1L密闭容器中,当其他条件一定时,SO2(g)的平衡转化率α随X的变化关系,X(X1、X2)代表压强或温度。X代表的物理量是___________ 。A对应条件下平衡常数K=___________ 。
(3)工业硫酸中往往含有一定量SO2,测定过程如下:取mg工业硫酸配成100mL溶液,取出20.00mL溶液,加入1mL指示剂,用cmol·L-1I2标准溶液滴定,消耗的I2标准溶液VmL,工业硫酸中含有SO2的质量分数的计算式是___________ 。
(1)火法炼铜的工艺流程如下:

反应I:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) △H=-768.2kJ·mol-1
反应Ⅱ:2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g) △H=+116.0 kJ·mol-1
①在反应Ⅱ中,每生成1molSO2转移电子
②反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的△H=
③理论上m1:m2=
(2)炼铜的副产品SO2多用于制硫酸和石膏等化学产品。制硫酸中重要的一步反应是:2SO2(g)+O2(g)
 2SO3(g) △H=-196kJ·mol-1。如图表示将2.0molSO2和1.0molO2置于1L密闭容器中,当其他条件一定时,SO2(g)的平衡转化率α随X的变化关系,X(X1、X2)代表压强或温度。X代表的物理量是
2SO3(g) △H=-196kJ·mol-1。如图表示将2.0molSO2和1.0molO2置于1L密闭容器中,当其他条件一定时,SO2(g)的平衡转化率α随X的变化关系,X(X1、X2)代表压强或温度。X代表的物理量是
(3)工业硫酸中往往含有一定量SO2,测定过程如下:取mg工业硫酸配成100mL溶液,取出20.00mL溶液,加入1mL指示剂,用cmol·L-1I2标准溶液滴定,消耗的I2标准溶液VmL,工业硫酸中含有SO2的质量分数的计算式是
您最近一年使用:0次
名校
解题方法
3 . 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:
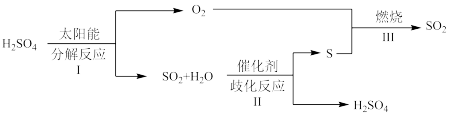
(1)反应Ⅰ由两步反应组成,写出②的化学方程式:
①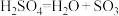 ;
;
②_______ 。
(2)反应Ⅱ: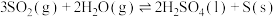 ∆H
∆H
①不同条件下, 达到相同的平衡转化率,温度越高,所需的压强越大,说明∆H
达到相同的平衡转化率,温度越高,所需的压强越大,说明∆H_______ 0。
②一定压强下, 与
与 的投料比[
的投料比[ ]对平衡体系中
]对平衡体系中 转化率影响如图:
转化率影响如图:
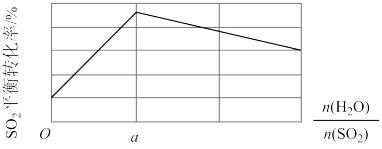
 时,解释
时,解释 平衡转化率随投料比增大而降低的原因:
平衡转化率随投料比增大而降低的原因:_______ 。
(3) 可以作为水溶液中
可以作为水溶液中 歧化反应(歧化反应生成硫酸与硫沉淀)的催化剂,可能的催化过程如下。将ⅱ补充完整
歧化反应(歧化反应生成硫酸与硫沉淀)的催化剂,可能的催化过程如下。将ⅱ补充完整_______
ⅰ.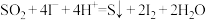
ⅱ.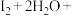 _______
_______ _______
_______ _______
_______
(4)探究ⅰ、ⅱ反应速率与 歧化反应速率的关系,实验如下:分别将18mL
歧化反应速率的关系,实验如下:分别将18mL 饱和溶液加入到2mL下列试剂中,密闭放置观察现象。(已知:
饱和溶液加入到2mL下列试剂中,密闭放置观察现象。(已知: 易溶解在KI溶液中)
易溶解在KI溶液中)
①B是A的对比实验,则a=_______ 。
②比较A、B、C,可得出的结论是_______ 。
③实验表明, 的歧化反应速率D>A,结合ⅰ、ⅱ反应速率解释原因:
的歧化反应速率D>A,结合ⅰ、ⅱ反应速率解释原因:_______ 。
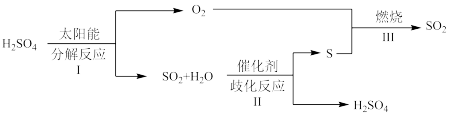
(1)反应Ⅰ由两步反应组成,写出②的化学方程式:
①
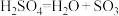 ;
;②
(2)反应Ⅱ:
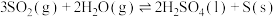 ∆H
∆H①不同条件下,
 达到相同的平衡转化率,温度越高,所需的压强越大,说明∆H
达到相同的平衡转化率,温度越高,所需的压强越大,说明∆H②一定压强下,
 与
与 的投料比[
的投料比[ ]对平衡体系中
]对平衡体系中 转化率影响如图:
转化率影响如图:
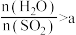 时,解释
时,解释 平衡转化率随投料比增大而降低的原因:
平衡转化率随投料比增大而降低的原因:(3)
 可以作为水溶液中
可以作为水溶液中 歧化反应(歧化反应生成硫酸与硫沉淀)的催化剂,可能的催化过程如下。将ⅱ补充完整
歧化反应(歧化反应生成硫酸与硫沉淀)的催化剂,可能的催化过程如下。将ⅱ补充完整ⅰ.
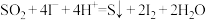
ⅱ.
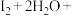 _______
_______ _______
_______ _______
_______
(4)探究ⅰ、ⅱ反应速率与
 歧化反应速率的关系,实验如下:分别将18mL
歧化反应速率的关系,实验如下:分别将18mL 饱和溶液加入到2mL下列试剂中,密闭放置观察现象。(已知:
饱和溶液加入到2mL下列试剂中,密闭放置观察现象。(已知: 易溶解在KI溶液中)
易溶解在KI溶液中)| 序号 | A | B | C | D |
| 试剂组成 | 0.4 KI KI | a KI,0.2 KI,0.2  | 0.2  | 0.2 KI,0.0002mol KI,0.0002mol  |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
②比较A、B、C,可得出的结论是
③实验表明,
 的歧化反应速率D>A,结合ⅰ、ⅱ反应速率解释原因:
的歧化反应速率D>A,结合ⅰ、ⅱ反应速率解释原因:
您最近一年使用:0次
名校
4 . 氢能是一种极具发展潜力的清洁能源,CH4-H2O催化重整是目前大规模制取氢气的重要方法。
(1)CH4-H2O催化重整:
反应I:CH4(g)+H2O(g) CO(g)+3H2(g) ∆H1=+210kJ•mol-1
CO(g)+3H2(g) ∆H1=+210kJ•mol-1
反应Ⅱ:CO(g)+H2O(g) CO2(g)+H2(g) ∆H2=-41kJ•mol-1
CO2(g)+H2(g) ∆H2=-41kJ•mol-1
①提高CH4平衡转化率的条件是____ 。
a.增大压强 b.加入催化剂 c.增大水蒸气浓度
②CH4、H2O催化重整生成CO2、H2的热化学方程式是____ 。
③在密闭容器中,将2.0molCO与8.0molH2O混合加热到800℃发生反应Ⅱ,达到平衡时CO的转化率是80%,其平衡常数为____ 。
(2)实验发现,其他条件不变,相同时间内,向催化重整体系中投入一定量的CaO可以明显提高H2的百分含量。做对比实验,结果如图所示:

①投入CaO时,H2百分含量增大的原因是:____ 。
②投入纳米CaO时,H2百分含量增大的原因是:____ 。
(3)对于反应I,以下相关图像正确的是____ 。
(1)CH4-H2O催化重整:
反应I:CH4(g)+H2O(g)
 CO(g)+3H2(g) ∆H1=+210kJ•mol-1
CO(g)+3H2(g) ∆H1=+210kJ•mol-1反应Ⅱ:CO(g)+H2O(g)
 CO2(g)+H2(g) ∆H2=-41kJ•mol-1
CO2(g)+H2(g) ∆H2=-41kJ•mol-1①提高CH4平衡转化率的条件是
a.增大压强 b.加入催化剂 c.增大水蒸气浓度
②CH4、H2O催化重整生成CO2、H2的热化学方程式是
③在密闭容器中,将2.0molCO与8.0molH2O混合加热到800℃发生反应Ⅱ,达到平衡时CO的转化率是80%,其平衡常数为
(2)实验发现,其他条件不变,相同时间内,向催化重整体系中投入一定量的CaO可以明显提高H2的百分含量。做对比实验,结果如图所示:

①投入CaO时,H2百分含量增大的原因是:
②投入纳米CaO时,H2百分含量增大的原因是:
(3)对于反应I,以下相关图像正确的是
A. | B. |
C. | D. |
您最近一年使用:0次
名校
解题方法
5 . 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。

(1)反应I:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551kJ•mol-1
反应III:S(s)+O2(g)=SO2(g) ΔH3=-297kJ•mol-1
反应II的热化学方程式:_____ 。
(2)对反应II,在同一投料比,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。p2____ p1(填“>”或“<”),得出该结论的理由是_____ 。

(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+SO2=____ +SO +2I-
+2I-

(1)反应I:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551kJ•mol-1
反应III:S(s)+O2(g)=SO2(g) ΔH3=-297kJ•mol-1
反应II的热化学方程式:
(2)对反应II,在同一投料比,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。p2

(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+SO2=
 +2I-
+2I-
您最近一年使用:0次
解题方法
6 . 煤的综合利用是合理利用资源,实现“绿色发展”的重要途径。图是某煤化工产业链的一部分
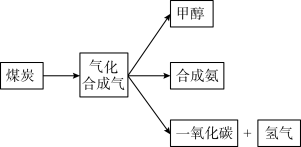
(1)已知:
a. C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
b. 2H2(g)+O2(g)=2H2O(g) ΔH=-484.0 kJ·mol-1
c. CO(g)+ O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
①计算反应a消耗24 g C(s)时,反应放出的热量为_______ kJ。
②为加快水煤气(CO和H2混合气)的生产速率可采取措施有_______ 。
A. 将煤炭粉碎 B. 降低温度 C. 增大反应容器体积 D. 使用催化剂
③根据已知,写出 C(s)与H2O(g)反应制备水煤气的热化学方程式是_______ 。
(2)煤气化后得到气体中的氢气是一种新型的绿色能源,根据如图,写出表示氢气燃烧热的热化学方程式为_______
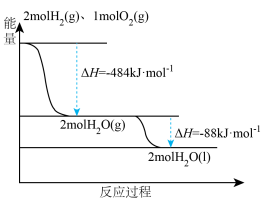
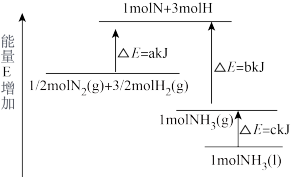
(3)工业合成氨用途广泛,其能量变化如图所示,根据图示,写出合成N2(g)和H2(g)合成液态氨的热化学方程式_______ 。

(1)已知:
a. C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
b. 2H2(g)+O2(g)=2H2O(g) ΔH=-484.0 kJ·mol-1
c. CO(g)+
 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1①计算反应a消耗24 g C(s)时,反应放出的热量为
②为加快水煤气(CO和H2混合气)的生产速率可采取措施有
A. 将煤炭粉碎 B. 降低温度 C. 增大反应容器体积 D. 使用催化剂
③根据已知,写出 C(s)与H2O(g)反应制备水煤气的热化学方程式是
(2)煤气化后得到气体中的氢气是一种新型的绿色能源,根据如图,写出表示氢气燃烧热的热化学方程式为

(3)工业合成氨用途广泛,其能量变化如图所示,根据图示,写出合成N2(g)和H2(g)合成液态氨的热化学方程式

您最近一年使用:0次
7 . Ⅰ:载人航天器中,利用萨巴蒂尔反应将航天员呼出的 转化为
转化为 ,再通过电解
,再通过电解 获得
获得 ,实现
,实现 的再生。
的再生。
已知:①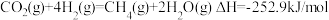
②
请回答:
(1)反应②属于_______ (填“吸热”或“放热”)反应。
(2)反应①消耗 时,反应
时,反应_______ (填“吸热”或“放热”)热量,其数值为_______ kJ。
(3)反应②热量变化为 时,生成
时,生成 的质量为
的质量为_______ 。
(4)反应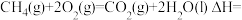
_______  。
。
Ⅱ: 资源化利用的方法之一是合成二甲醚
资源化利用的方法之一是合成二甲醚 。
。 催化加氢合成二甲醚的过程中主要发生下列反应:
催化加氢合成二甲醚的过程中主要发生下列反应:
反应Ⅰ:
反应Ⅱ:
(5)其中,反应Ⅱ:分以下①②两步完成,请写出反应①的热化学方程式。
①_______ 。
②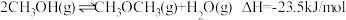
 转化为
转化为 ,再通过电解
,再通过电解 获得
获得 ,实现
,实现 的再生。
的再生。已知:①
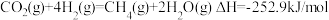
②

请回答:
(1)反应②属于
(2)反应①消耗
 时,反应
时,反应(3)反应②热量变化为
 时,生成
时,生成 的质量为
的质量为(4)反应
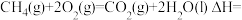
 。
。Ⅱ:
 资源化利用的方法之一是合成二甲醚
资源化利用的方法之一是合成二甲醚 。
。 催化加氢合成二甲醚的过程中主要发生下列反应:
催化加氢合成二甲醚的过程中主要发生下列反应:反应Ⅰ:

反应Ⅱ:

(5)其中,反应Ⅱ:分以下①②两步完成,请写出反应①的热化学方程式。
①
②
您最近一年使用:0次
名校
8 . 已知:① 2H2(g) + O2(g) = 2H2O(l) ΔH = -572 kJ/mol
② 2H2 (g) + SO2 (g) S (g) + 2H2O (g) ΔH =+ 90.4 kJ/mol
S (g) + 2H2O (g) ΔH =+ 90.4 kJ/mol
③ 2H2 (g) + CO (g) CH3OH (g) ΔH =-90.8 kJ/mol
CH3OH (g) ΔH =-90.8 kJ/mol
(1)上述变化过程中放出热量的是_______ (填序号,下同),吸收热量的是_______ 。
(2)反应①热量变化为57.2kJ,转化H2的质量是_______ g。
(3)反应②2 g H2 (g) 完全反应生成硫单质时,ΔH =_______ kJ/mol。
(4)反应③2molH2和1molCO放入密闭容器中充分反应,放出的热量_______ 90.8KJ(填“大于”或“小于”或“等于”)
② 2H2 (g) + SO2 (g)
 S (g) + 2H2O (g) ΔH =+ 90.4 kJ/mol
S (g) + 2H2O (g) ΔH =+ 90.4 kJ/mol③ 2H2 (g) + CO (g)
 CH3OH (g) ΔH =-90.8 kJ/mol
CH3OH (g) ΔH =-90.8 kJ/mol(1)上述变化过程中放出热量的是
(2)反应①热量变化为57.2kJ,转化H2的质量是
(3)反应②2 g H2 (g) 完全反应生成硫单质时,ΔH =
(4)反应③2molH2和1molCO放入密闭容器中充分反应,放出的热量
您最近一年使用:0次
2022-10-12更新
|
128次组卷
|
2卷引用:北京市顺义区第一中学2022-2023学年高二上学期10月月考化学试题
名校
解题方法
9 . 氢能是一种清洁能源,按照生产过程中的碳排放情况分为灰氢、蓝氢和绿氢。
(1)煤的气化制得灰氢 :C(s)+H2O(g)  CO(g)+H2(g)。该反应的平衡常数表达式K=
CO(g)+H2(g)。该反应的平衡常数表达式K=_______ 。该方法生产过程有CO2排放。
(2)甲烷水蒸气催化重整制得蓝氢 ,步骤如下。
I.H2的制取:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH>0
CO(g)+3H2(g) ΔH>0
①为提高CH4的平衡转化率,可采取的措施有_______ (写出两条即可)。
II.H2的富集:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0
CO2(g)+H2(g) ΔH<0
②已知830℃时,该反应的平衡常数K=1。在容积不变的的密闭容器中,将2molCO与8molH2O混合加热到830℃,反应达平衡时CO的转化率为_______ 。
III.用 吸收
吸收 实现低碳排放。
实现低碳排放。 消耗率随时间变化关系如图所示。
消耗率随时间变化关系如图所示。

③比较温度高低:T1_______ T2(填“>”或“<”)。
(3)热化学硫碘循环分解水制得绿氢 ,全程零碳排放。反应如下:
反应i:SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g) ∆H1=-82kJ·mol−1
反应ii:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) ∆H2=+544kJ·mol−1
反应iii:……
反应ⅰ~iii循环实现分解水:2H2O(g)=2H2(g)+O2(g) ∆H=+484kJ·mol−1。写出反应iii的热化学方程式_______ 。
(1)煤的气化制得
 CO(g)+H2(g)。该反应的平衡常数表达式K=
CO(g)+H2(g)。该反应的平衡常数表达式K=(2)甲烷水蒸气催化重整制得
I.H2的制取:CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH>0
CO(g)+3H2(g) ΔH>0①为提高CH4的平衡转化率,可采取的措施有
II.H2的富集:CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH<0
CO2(g)+H2(g) ΔH<0②已知830℃时,该反应的平衡常数K=1。在容积不变的的密闭容器中,将2molCO与8molH2O混合加热到830℃,反应达平衡时CO的转化率为
III.用
 吸收
吸收 实现低碳排放。
实现低碳排放。 消耗率随时间变化关系如图所示。
消耗率随时间变化关系如图所示。
③比较温度高低:T1
(3)热化学硫碘循环分解水制得
反应i:SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g) ∆H1=-82kJ·mol−1
反应ii:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) ∆H2=+544kJ·mol−1
反应iii:……
反应ⅰ~iii循环实现分解水:2H2O(g)=2H2(g)+O2(g) ∆H=+484kJ·mol−1。写出反应iii的热化学方程式
您最近一年使用:0次
2022-01-19更新
|
302次组卷
|
3卷引用:北京市朝阳区2021-2022学年高二上学期期末考试化学试题
21-22高三上·辽宁沈阳·阶段练习
10 . 双氧水(过氧化氢的水溶液)在工业生产和日常生活中应用广泛。
(1)双氧水的强氧化性使其对大多数病菌和病毒具有消杀功能。用3%医用双氧水对不传染病房喷洒消毒时,地板上有气泡冒出,该气体是__ 。
(2)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢。知0.4mol液态肼与足量的液态过氧化氢反应,生成氮气和水蒸气,并放出256.652kJ的热量。该反应的热化学方程式为__ 。
(3)双氧水能将碱性废水中的CN-转化成碳酸盐和一种对环境无污染的气体,CN-的电子式为__ ,写出该反应的离子方程式__ 。
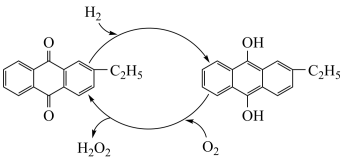
(4)如图是工业上制备过氧化氢最常见的方法,写出实际发生反应的总方程式___ 。
(5)如图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。

①Ir—Ru惰性电极吸附O2生成H2O2,其电极反应式是__ 。
②处理废氨水中溶质(以NH3计)的质量是34g,理论上电路中转移电子数为__ mol。
(1)双氧水的强氧化性使其对大多数病菌和病毒具有消杀功能。用3%医用双氧水对不传染病房喷洒消毒时,地板上有气泡冒出,该气体是
(2)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢。知0.4mol液态肼与足量的液态过氧化氢反应,生成氮气和水蒸气,并放出256.652kJ的热量。该反应的热化学方程式为
(3)双氧水能将碱性废水中的CN-转化成碳酸盐和一种对环境无污染的气体,CN-的电子式为
(4)如图是工业上制备过氧化氢最常见的方法,写出实际发生反应的总方程式

(5)如图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。

①Ir—Ru惰性电极吸附O2生成H2O2,其电极反应式是
②处理废氨水中溶质(以NH3计)的质量是34g,理论上电路中转移电子数为
您最近一年使用:0次



