解题方法
1 . CO2再生为“零碳甲醇”是实现碳中和的一种方式。
(1)CO2催化加氢可生成甲醇。
已知:i.2H2(g)+O2(g)=2H2O(g)ΔH=akJ·mol-1
ii.2CH3OH(g)+3O2(g) 2CO2(g)+4H2O(g)ΔH=bkJ·mol-1
2CO2(g)+4H2O(g)ΔH=bkJ·mol-1
①CO2和H2生成CH3OH和H2O的热化学方程式是___________ 。
②合成过程中选择高压条件的原因:___________ 。
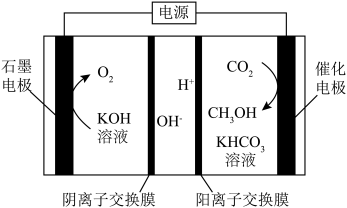
(2)电解还原法将CO2转化为甲醇的装置如图。 和选择性S的定义:
和选择性S的定义:
 (B)=
(B)= 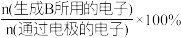
S(B)=
①电解过程中生成CH3OH的电极反应式:___________ 。
②当CO2完全消耗时,测得η(CH3OH)=33.3%,S(CH3OH)=25%。推测η(CH3OH)=33.3%的原因:
i.阴极有H2O放电。
ii.阴极有CO生成。
iii.……
a.通过检验电解产物判断推测i是否成立,需要检验的物质是___________ 。
b.假设放电的CO2一部分生成CH3OH,其余的CO2全部在阴极放电生成CO,则η(CO)=___________ 。
③研究CH3OH中的C来自于CO2还是KHCO3,方法如下:
方法I.其他条件不变,用N2代替CO2电解,无CH3OH产生。
方法II.其他条件不变,用14CO2代替CO2电解,有___________ 产生。
综上,证实CH3OH中的C来自于CO2
(1)CO2催化加氢可生成甲醇。
已知:i.2H2(g)+O2(g)=2H2O(g)ΔH=akJ·mol-1
ii.2CH3OH(g)+3O2(g)
 2CO2(g)+4H2O(g)ΔH=bkJ·mol-1
2CO2(g)+4H2O(g)ΔH=bkJ·mol-1①CO2和H2生成CH3OH和H2O的热化学方程式是
②合成过程中选择高压条件的原因:
(2)电解还原法将CO2转化为甲醇的装置如图。
 和选择性S的定义:
和选择性S的定义: (B)=
(B)= 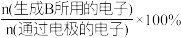
S(B)=

①电解过程中生成CH3OH的电极反应式:
②当CO2完全消耗时,测得η(CH3OH)=33.3%,S(CH3OH)=25%。推测η(CH3OH)=33.3%的原因:
i.阴极有H2O放电。
ii.阴极有CO生成。
iii.……
a.通过检验电解产物判断推测i是否成立,需要检验的物质是
b.假设放电的CO2一部分生成CH3OH,其余的CO2全部在阴极放电生成CO,则η(CO)=
③研究CH3OH中的C来自于CO2还是KHCO3,方法如下:
方法I.其他条件不变,用N2代替CO2电解,无CH3OH产生。
方法II.其他条件不变,用14CO2代替CO2电解,有
综上,证实CH3OH中的C来自于CO2
您最近一年使用:0次
名校
解题方法
2 . CO2在自然界碳循环中起着重要作用,合理利用CO2是当今科学研究的前沿。
(1)蓝色碳汇技术:利用海洋生物吸收大气中的CO2,将其固定在海洋中。

①海水的CO295%以 形式存在,写出CO2溶于水产生
形式存在,写出CO2溶于水产生 的方程式
的方程式__________ 。
②珊瑚虫是海洋中的一种腔肠动物,经钙化作用可以形成石灰石外壳,示意图如上。写出钙化作用的离子方程式____________________ 。
(2)用CO2生产绿色燃料甲醇:
①用CO2生产绿色燃料甲醇时发生反应A:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
已知:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) △H=-1365.0kJ/mol
H2(g)+ O2(g)=H2O(g) △H=-241.8kJ/mol
O2(g)=H2O(g) △H=-241.8kJ/mol
则反应A的热化学方程式为___________________________ 。
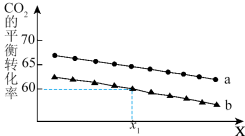
②在体积为1L的恒容密闭容器中发生反应A,下图为不同投料[n(CO2)和n(H2)分别为1mol,3mol;lmol,6mol]下,CO2平衡转化率随X(温度或压强)的变化曲线。
Ⅰ.曲线a对应的投料是___________ 。
Ⅱ.判断X代表的物理量是______ ,简述理由____________________ 。
Ⅲ.x1时,曲线b对应的化学平衡常数是______________ 。
Ⅳ.将CO2和H2按物质的量比1:3混合,以固定流速通过盛放Cu/Zn/Al/Zr催化剂的反应器,在相同时间内,不同温度下的实验数据如下图所示。
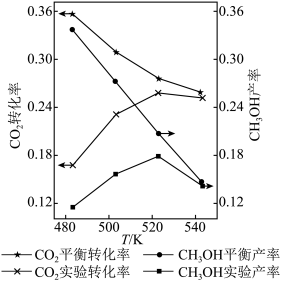
已知:CH3OH产率=
ⅰ.催化剂活性最好的温度为___ (填字母序号)。
a.483K b.503K c.523K d.543K
ⅱ.温度由523K升到543K,CO2的平衡转化率和CH3OH的实验产率均降低,解释原因:____________ 。
(1)蓝色碳汇技术:利用海洋生物吸收大气中的CO2,将其固定在海洋中。

①海水的CO295%以
 形式存在,写出CO2溶于水产生
形式存在,写出CO2溶于水产生 的方程式
的方程式②珊瑚虫是海洋中的一种腔肠动物,经钙化作用可以形成石灰石外壳,示意图如上。写出钙化作用的离子方程式
(2)用CO2生产绿色燃料甲醇:
①用CO2生产绿色燃料甲醇时发生反应A:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)已知:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) △H=-1365.0kJ/mol
H2(g)+
 O2(g)=H2O(g) △H=-241.8kJ/mol
O2(g)=H2O(g) △H=-241.8kJ/mol则反应A的热化学方程式为
②在体积为1L的恒容密闭容器中发生反应A,下图为不同投料[n(CO2)和n(H2)分别为1mol,3mol;lmol,6mol]下,CO2平衡转化率随X(温度或压强)的变化曲线。
Ⅰ.曲线a对应的投料是
Ⅱ.判断X代表的物理量是
Ⅲ.x1时,曲线b对应的化学平衡常数是

Ⅳ.将CO2和H2按物质的量比1:3混合,以固定流速通过盛放Cu/Zn/Al/Zr催化剂的反应器,在相同时间内,不同温度下的实验数据如下图所示。

已知:CH3OH产率=

ⅰ.催化剂活性最好的温度为
a.483K b.503K c.523K d.543K
ⅱ.温度由523K升到543K,CO2的平衡转化率和CH3OH的实验产率均降低,解释原因:
您最近一年使用:0次
名校
解题方法
3 . I.近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
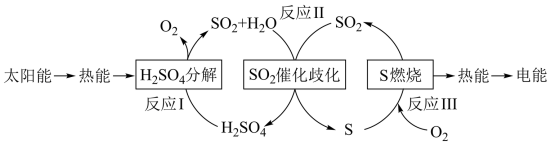
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:___________ 。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。

p2___________ p 1(填“>”或“<”),得出该结论的理由是___________ 。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.________
I2+2H2O+___________=___________+___________+2 I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
①B是A的对比实验,则a=___________ 。
②比较A、B、C,可得出的结论是___________ 。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:___________
(5)一定温度下,反应I2(g)+H2(g)⇌2Hl(g)在密闭容器中达到平衡时,测得c(I2)=0.11mmol•L-1,c(H2)=0.11mmol•L-1,c(HI)=0.78mmol•L-1.相同度温下,按下列4组初始浓度进行实验,反应逆向进行的是___________ 。
(注:1mmol•L-1=10-3mol•L-1)
Ⅱ.以银锰精矿(主要含Ag2S、MnS、FeS2)和氧化锰矿(主要含MnO2)为原料联合提取银和锰的一种流程示意图如下。
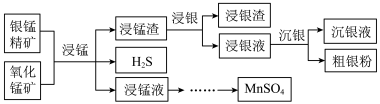
已知:酸性条件下,MnO2的氧化性强于Fe3+。
“浸银”时,使用过量FeCl3、HCl和CaCl2的混合液作为浸出剂,将Ag2S中的银以[AgCl2]-形式浸出。
(6)将“浸银”反应的离子方程式补充完整:_______
□Fe3+ + Ag2S + □ ___________ □ ___________ + 2[AgCl2]- + S
□ ___________ + 2[AgCl2]- + S
(7)结合平衡移动原理,解释浸出剂中Cl-、H+的作用:___________ 。

(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。

p2
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.
I2+2H2O+___________=___________+___________+2 I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
| 序号 | A | B | C | D |
| 试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
②比较A、B、C,可得出的结论是
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:
(5)一定温度下,反应I2(g)+H2(g)⇌2Hl(g)在密闭容器中达到平衡时,测得c(I2)=0.11mmol•L-1,c(H2)=0.11mmol•L-1,c(HI)=0.78mmol•L-1.相同度温下,按下列4组初始浓度进行实验,反应逆向进行的是
| A | B | C | D | |
| c(I2)/mmol•L-1 | 1.00 | 0.22 | 0.44 | 0.11 |
| c(H2)/mmol•L-1 | 1.00 | 0.22 | 0.44 | 0.44 |
| c(HI)/mmol•L-1 | 1.00 | 1.56 | 4.00 | 1.56 |
Ⅱ.以银锰精矿(主要含Ag2S、MnS、FeS2)和氧化锰矿(主要含MnO2)为原料联合提取银和锰的一种流程示意图如下。

已知:酸性条件下,MnO2的氧化性强于Fe3+。
“浸银”时,使用过量FeCl3、HCl和CaCl2的混合液作为浸出剂,将Ag2S中的银以[AgCl2]-形式浸出。
(6)将“浸银”反应的离子方程式补充完整:
□Fe3+ + Ag2S + □ ___________
 □ ___________ + 2[AgCl2]- + S
□ ___________ + 2[AgCl2]- + S(7)结合平衡移动原理,解释浸出剂中Cl-、H+的作用:
您最近一年使用:0次
名校
4 . 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
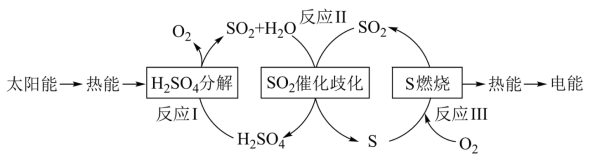
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
写出反应Ⅱ的化学方程式:___________ ,该步反应的ΔH2=___________ kJ·mol-1。
(2)对反应Ⅱ,在某一投料比时,一定压强 (p1)下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。

H2SO4在平衡体系中物质的量分数随温度的升高而下降,原因是___________ 。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+____=____+____+2I-,__________
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
①B是A的对比实验,则a=___________ 。
②比较A、B、C,可得出的结论是___________ 。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:___________ 。

(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
写出反应Ⅱ的化学方程式:
(2)对反应Ⅱ,在某一投料比时,一定压强 (p1)下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。

H2SO4在平衡体系中物质的量分数随温度的升高而下降,原因是
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+____=____+____+2I-,
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
| A | B | C | D | |
| 试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI与0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI与0.0002 mol I2 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
②比较A、B、C,可得出的结论是
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:
您最近一年使用:0次
名校
5 . 氮元素单质及其化合物在工农业生产生活中有着重要作用。
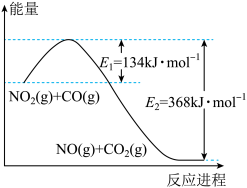
(1)根据下图,NO2和CO反应生成NO和CO2的ΔH =___________ kJ•mol-1。
(2)用NH3催化还原NOx还可以消除氮氧化物的污染。例如:

 ①
①

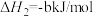 ②
②
若1mol NH3还原NO至N2,则该反应过程中的反应热ΔH3___________  (用含a、b的式子表示)。
(用含a、b的式子表示)。
(3)在固定体积的密闭容器中,进行如下化学反应:N2 (g)+3H2 (g) 2NH3 (g)
2NH3 (g)  ,其平衡常数K与温度T的关系如下表:
,其平衡常数K与温度T的关系如下表:
①该反应的平衡常数表达式:K ___________
②试判断K1___________ K2 (填写“>”“=”或“<”)
③一定温度下,在2L密闭容器中充入1mol N2和3mol H2并发生反应。若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则N2的转化率α(N2)=___________ ,以NH3表示该过程的反应速率v(NH3)=___________ 。
(1)根据下图,NO2和CO反应生成NO和CO2的ΔH =

(2)用NH3催化还原NOx还可以消除氮氧化物的污染。例如:

 ①
①
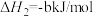 ②
②若1mol NH3还原NO至N2,则该反应过程中的反应热ΔH3
 (用含a、b的式子表示)。
(用含a、b的式子表示)。(3)在固定体积的密闭容器中,进行如下化学反应:N2 (g)+3H2 (g)
 2NH3 (g)
2NH3 (g)  ,其平衡常数K与温度T的关系如下表:
,其平衡常数K与温度T的关系如下表:| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1 106 106 | K1 | K2 |
②试判断K1
③一定温度下,在2L密闭容器中充入1mol N2和3mol H2并发生反应。若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则N2的转化率α(N2)=
您最近一年使用:0次
名校
6 . 零价纳米铁在环境修复中具有广泛应用,可用来处理地下水中的铼酸根离子( )。
)。
资料:零价纳米铁胶粒表面带正电,采用物理吸附和还原的共同作用,可将 固定,防止其随地下水的运动而迁移。
固定,防止其随地下水的运动而迁移。
(1)利用无机炭作为还原剂,在高温下通过氧化还原反应来制备零价纳米铁,涉及的反应有:
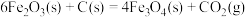



写出无机炭还原氧化铁制备纳米铁的热化学方程式___________ 。
(2)液相还原法也可用来制备零价纳米铁。
将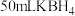 (B元素的化合价为+3)水溶液添加到
(B元素的化合价为+3)水溶液添加到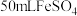 水溶液中,搅拌数秒钟,溶液变黑时停止搅拌,用磁铁分离沉淀,先用蒸馏水充分洗涤,再用无水乙醇洗涤3次,氮气保护下烘干,即得所需纳米铁。反应原理:
水溶液中,搅拌数秒钟,溶液变黑时停止搅拌,用磁铁分离沉淀,先用蒸馏水充分洗涤,再用无水乙醇洗涤3次,氮气保护下烘干,即得所需纳米铁。反应原理: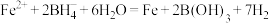
①氮气作用下烘干的目的是___________ 。
②每生成1molFe,转移电子数为___________
(3)零价纳米铁具有强的还原能力。某酸性样品溶液中含有 、
、 、
、 、
、 、
、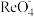 等离子。在酸性环境下,用零价纳米铁可将该样品溶液中的
等离子。在酸性环境下,用零价纳米铁可将该样品溶液中的 还原成固态的
还原成固态的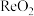 而除去,自身转化成
而除去,自身转化成 。
。
①写出反应的离子方程式___________ 。
②零价纳米铁对不同初始浓度的 的去除率如图所示。
的去除率如图所示。
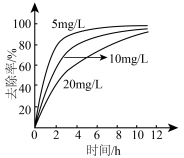
a. 初始浓度低,速率快的可能原因是
初始浓度低,速率快的可能原因是___________ 。
b. 最终去除率相近原因是
最终去除率相近原因是___________ 。
③研究表明pH过高或过低会使 的去除率降低,可能的原因分别是
的去除率降低,可能的原因分别是___________ 。
 )。
)。资料:零价纳米铁胶粒表面带正电,采用物理吸附和还原的共同作用,可将
 固定,防止其随地下水的运动而迁移。
固定,防止其随地下水的运动而迁移。(1)利用无机炭作为还原剂,在高温下通过氧化还原反应来制备零价纳米铁,涉及的反应有:
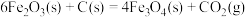



写出无机炭还原氧化铁制备纳米铁的热化学方程式
(2)液相还原法也可用来制备零价纳米铁。
将
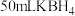 (B元素的化合价为+3)水溶液添加到
(B元素的化合价为+3)水溶液添加到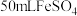 水溶液中,搅拌数秒钟,溶液变黑时停止搅拌,用磁铁分离沉淀,先用蒸馏水充分洗涤,再用无水乙醇洗涤3次,氮气保护下烘干,即得所需纳米铁。反应原理:
水溶液中,搅拌数秒钟,溶液变黑时停止搅拌,用磁铁分离沉淀,先用蒸馏水充分洗涤,再用无水乙醇洗涤3次,氮气保护下烘干,即得所需纳米铁。反应原理: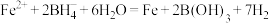
①氮气作用下烘干的目的是
②每生成1molFe,转移电子数为
(3)零价纳米铁具有强的还原能力。某酸性样品溶液中含有
 、
、 、
、 、
、 、
、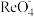 等离子。在酸性环境下,用零价纳米铁可将该样品溶液中的
等离子。在酸性环境下,用零价纳米铁可将该样品溶液中的 还原成固态的
还原成固态的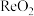 而除去,自身转化成
而除去,自身转化成 。
。①写出反应的离子方程式
②零价纳米铁对不同初始浓度的
 的去除率如图所示。
的去除率如图所示。
a.
 初始浓度低,速率快的可能原因是
初始浓度低,速率快的可能原因是b.
 最终去除率相近原因是
最终去除率相近原因是③研究表明pH过高或过低会使
 的去除率降低,可能的原因分别是
的去除率降低,可能的原因分别是
您最近一年使用:0次
名校
7 .  资源化利用是解决资源和能源短缺、减少碳排放的一种途径。
资源化利用是解决资源和能源短缺、减少碳排放的一种途径。
I. 制甲醇,过程如下:
制甲醇,过程如下:
i.催化剂活化:
ii. 与
与 在活化后的催化剂表面可逆的发生反应①,其反应历程如图1,同时伴随反应②:
在活化后的催化剂表面可逆的发生反应①,其反应历程如图1,同时伴随反应②:



(1)反应①每生成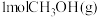 放热
放热 ,写出其热化学方程式:
,写出其热化学方程式:___________ 。
(2) 与
与 混合气体以不同的流速通过反应器,气体流速与
混合气体以不同的流速通过反应器,气体流速与 转化率、
转化率、 选择性的关系如图2。
选择性的关系如图2。
已知: 选择性=n(生成
选择性=n(生成 所用的
所用的 )/n(转化的
)/n(转化的 )。
)。
流速加快可减少产物中 的积累,减少反应
的积累,减少反应___________ (用化学方程式表示)的发生,减少催化剂的失活,提高甲醇选择性。
(3)对于以上 制甲醇的过程,以下描述正确的是
制甲醇的过程,以下描述正确的是___________ (填序号)。
A.反应中经历了 键的形成和断裂
键的形成和断裂
B.加压可以提高 的平衡转化率
的平衡转化率
C.升高温度可以提高甲醇在平衡时的选择性
Ⅱ.一种以甲醇和二氧化碳为原料,利用 和
和 纳米片
纳米片 作催化电极,电化学法制备甲酸(甲酸盐)的工作原理如图所示。
作催化电极,电化学法制备甲酸(甲酸盐)的工作原理如图所示。

(4)①b极为直流电源的___________ 极,阴极表面发生的电极反应式为___________ 。
②若有 通过质子交换膜时,生成
通过质子交换膜时,生成 和
和 共
共___________ mol。
 资源化利用是解决资源和能源短缺、减少碳排放的一种途径。
资源化利用是解决资源和能源短缺、减少碳排放的一种途径。I.
 制甲醇,过程如下:
制甲醇,过程如下:i.催化剂活化:

ii.
 与
与 在活化后的催化剂表面可逆的发生反应①,其反应历程如图1,同时伴随反应②:
在活化后的催化剂表面可逆的发生反应①,其反应历程如图1,同时伴随反应②:



(1)反应①每生成
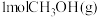 放热
放热 ,写出其热化学方程式:
,写出其热化学方程式:(2)
 与
与 混合气体以不同的流速通过反应器,气体流速与
混合气体以不同的流速通过反应器,气体流速与 转化率、
转化率、 选择性的关系如图2。
选择性的关系如图2。已知:
 选择性=n(生成
选择性=n(生成 所用的
所用的 )/n(转化的
)/n(转化的 )。
)。流速加快可减少产物中
 的积累,减少反应
的积累,减少反应(3)对于以上
 制甲醇的过程,以下描述正确的是
制甲醇的过程,以下描述正确的是A.反应中经历了
 键的形成和断裂
键的形成和断裂B.加压可以提高
 的平衡转化率
的平衡转化率C.升高温度可以提高甲醇在平衡时的选择性
Ⅱ.一种以甲醇和二氧化碳为原料,利用
 和
和 纳米片
纳米片 作催化电极,电化学法制备甲酸(甲酸盐)的工作原理如图所示。
作催化电极,电化学法制备甲酸(甲酸盐)的工作原理如图所示。
(4)①b极为直流电源的
②若有
 通过质子交换膜时,生成
通过质子交换膜时,生成 和
和 共
共
您最近一年使用:0次
2023-05-31更新
|
343次组卷
|
4卷引用:北京市朝阳区2023届高三下学期三模化学试题
名校
8 . 我国提出 2060 年前实现碳中和,为有效降低大气 CO2中的含量,以 CO2为原料制备甲烷、戊烷、甲醇等能源物质具有较好的发展前景。CO2在固体催化剂表面加氢合成甲烷过程中发生如下反应:
Ⅰ.主反应:CO2(g)+4H2(g) CH4(g)+2H2O(g) ∆H1=-156.9 kJ·mol-l
CH4(g)+2H2O(g) ∆H1=-156.9 kJ·mol-l
Ⅱ.副反应:CO2(g)+H2(g) CO(g)+H2O(g) ∆H2=+41.1 kJ·mol-l
CO(g)+H2O(g) ∆H2=+41.1 kJ·mol-l
(1)已知:Ⅲ.2H2(g)+O2(g)=2H2O(g) ∆H3=-395.6 kJ·mol-l
Ⅳ.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ∆H4=__________ 。
(2)CO2加氢合成甲烷时,通常控制温度为 500 °C 左右,其可能的原因为_______。
(3)500 °C 时,向 1 L 恒容密闭容器中充入 4 mol CO2和 12 mol H2,初始压强为 p,20 min 时主、副反应都达到平衡状态,测得 c(H2O)=5 mol·L-1,体系压强为3/4 p, 则 0~ 20 min 内 v(CH4)=________ ,平衡时 CH4选择性= ___________ (CH4选择性= × 100%, 计算保留三位有效数字)。
× 100%, 计算保留三位有效数字)。
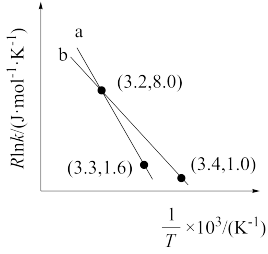
(4)以 CO2催化加氢合成的甲醇为原料,在催化剂作用下可以制取丙烯,反应的化学方程式为 3CH3OH(g) C3H6(g)+3H2O(g)。该反应的 Arrhenius 经验公式的实验数据如图中曲线 a 所示,已知 Arhenius 经验公式
C3H6(g)+3H2O(g)。该反应的 Arrhenius 经验公式的实验数据如图中曲线 a 所示,已知 Arhenius 经验公式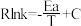 ,(Ea为活化能,k 为速率常数,R 和 C 为常数)。当改变外界条件时,实验数据如图中的曲线 b 所示,则实验可能改变的外界条件是
,(Ea为活化能,k 为速率常数,R 和 C 为常数)。当改变外界条件时,实验数据如图中的曲线 b 所示,则实验可能改变的外界条件是 __________ 。
Ⅰ.主反应:CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ∆H1=-156.9 kJ·mol-l
CH4(g)+2H2O(g) ∆H1=-156.9 kJ·mol-lⅡ.副反应:CO2(g)+H2(g)
 CO(g)+H2O(g) ∆H2=+41.1 kJ·mol-l
CO(g)+H2O(g) ∆H2=+41.1 kJ·mol-l(1)已知:Ⅲ.2H2(g)+O2(g)=2H2O(g) ∆H3=-395.6 kJ·mol-l
Ⅳ.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ∆H4=
(2)CO2加氢合成甲烷时,通常控制温度为 500 °C 左右,其可能的原因为_______。
| A.反应速率快 | B.平衡转化率高 |
| C.催化剂活性高 | D.主反应催化剂选择性好 |
 × 100%, 计算保留三位有效数字)。
× 100%, 计算保留三位有效数字)。(4)以 CO2催化加氢合成的甲醇为原料,在催化剂作用下可以制取丙烯,反应的化学方程式为 3CH3OH(g)
 C3H6(g)+3H2O(g)。该反应的 Arrhenius 经验公式的实验数据如图中曲线 a 所示,已知 Arhenius 经验公式
C3H6(g)+3H2O(g)。该反应的 Arrhenius 经验公式的实验数据如图中曲线 a 所示,已知 Arhenius 经验公式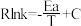 ,(Ea为活化能,k 为速率常数,R 和 C 为常数)。当改变外界条件时,实验数据如图中的曲线 b 所示,则实验可能改变的外界条件是
,(Ea为活化能,k 为速率常数,R 和 C 为常数)。当改变外界条件时,实验数据如图中的曲线 b 所示,则实验可能改变的外界条件是 
您最近一年使用:0次
名校
解题方法
9 . 近年来,随着聚酯工业的快速发展,将氯化氢转化为氯气的技术成为科学研究的热点。传统的Deacon直接氧化法,按下列催化过程进行:4HCl(g)+O2(g)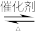 2Cl2(g)+2H2O(g)。
2Cl2(g)+2H2O(g)。
(1)写出上述反应的平衡常数表达式K=____ 。
(2)判断该反应在恒容密闭容器中发生,达到平衡的依据是____ (填序号)。
①4个H-Cl键断裂的同时,有4个O-H键断裂
②HCl、O2、Cl2、H2O的浓度都不再发生变化
③HCl减少的速率和Cl2减少的速率相等
④HCl、O2、Cl2、H2O的浓度都相等
⑤混合气体的颜色不再改变的状态
(3)生产过程中可使用CuCl2作催化剂,反应原理如下:
CuCl2(s)+ O2(g)=CuO(s)+Cl2(g) ΔH1=+63kJ•mol-1
O2(g)=CuO(s)+Cl2(g) ΔH1=+63kJ•mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH2=-121kJ•mol-1
则4HCl(g)+O2(g) 2Cl2(g)+2H2O(g)的ΔH=
2Cl2(g)+2H2O(g)的ΔH=____ kJ•mol-1。
(4)生产中反应温度通常控制在420℃左右,原因是____ 。在一定温度下,进一步提高HCl平衡转化率的方法是____ (写出2种)。
(5)420℃时,将一定量的O2和HCl通入4L的恒容密闭容器中,反应过程中氧气的变化量如图所示,则0~20min平均反应速率v(HCl)为____ mol•L-1•min-1。

 2Cl2(g)+2H2O(g)。
2Cl2(g)+2H2O(g)。(1)写出上述反应的平衡常数表达式K=
(2)判断该反应在恒容密闭容器中发生,达到平衡的依据是
①4个H-Cl键断裂的同时,有4个O-H键断裂
②HCl、O2、Cl2、H2O的浓度都不再发生变化
③HCl减少的速率和Cl2减少的速率相等
④HCl、O2、Cl2、H2O的浓度都相等
⑤混合气体的颜色不再改变的状态
(3)生产过程中可使用CuCl2作催化剂,反应原理如下:
CuCl2(s)+
 O2(g)=CuO(s)+Cl2(g) ΔH1=+63kJ•mol-1
O2(g)=CuO(s)+Cl2(g) ΔH1=+63kJ•mol-1CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH2=-121kJ•mol-1
则4HCl(g)+O2(g)
 2Cl2(g)+2H2O(g)的ΔH=
2Cl2(g)+2H2O(g)的ΔH=(4)生产中反应温度通常控制在420℃左右,原因是
(5)420℃时,将一定量的O2和HCl通入4L的恒容密闭容器中,反应过程中氧气的变化量如图所示,则0~20min平均反应速率v(HCl)为

您最近一年使用:0次
名校
解题方法
10 . 研究 的综合利用、实现
的综合利用、实现 资源化,是能源领域的重要发展方向。
资源化,是能源领域的重要发展方向。
(1)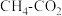 催化重整反应为
催化重整反应为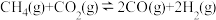 。
。
已知 ,
, 时,
时, 和
和 的燃烧热如下表:
的燃烧热如下表:
①该催化重整反应的
___________  。
。
②催化重整过程还存在积碳反应: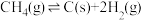 ,催化剂的活性会因积碳反应而降低。适当通入过量
,催化剂的活性会因积碳反应而降低。适当通入过量 可以有效缓解积碳,结合方程式解释其原因:
可以有效缓解积碳,结合方程式解释其原因:___________ 。
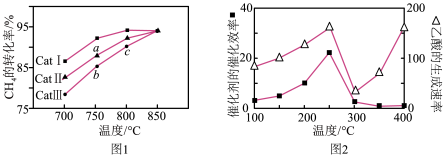
③相同时间内测得选用不同催化剂时 的转化率随反应温度的变化如图1所示:
的转化率随反应温度的变化如图1所示:
ⅰ、a点所处的状态___________ 化学平衡状态(填“是”或“不是”)。
ⅱ、 的转化率:
的转化率: ,原因是
,原因是___________ 。
(2)以二氧化钛表面覆盖的 为催化剂,可以将
为催化剂,可以将 和
和 直接转化成乙酸。
直接转化成乙酸。
①催化剂的催化效率与乙酸的生成速率随温度的变化关系如图2所示。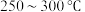 时,温度升高而乙酸的生成速率降低的原因是
时,温度升高而乙酸的生成速率降低的原因是___________ 。
②为了提高该反应中 的平衡转化率,可以采取的措施是
的平衡转化率,可以采取的措施是___________ (写出两种)。
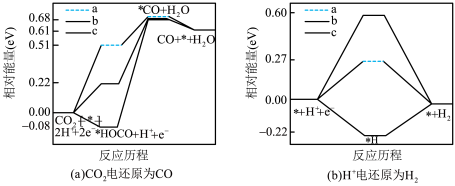
(3)在电解质水溶液中, 可被电化学还原为
可被电化学还原为 。在三种不同催化剂(a、b、c)上
。在三种不同催化剂(a、b、c)上 电还原为
电还原为 的反应进程中(
的反应进程中( 被还原为
被还原为 的反应可同时发生),相对能量变化如图。由此判断,
的反应可同时发生),相对能量变化如图。由此判断, 电还原为
电还原为 从易到难的顺序为
从易到难的顺序为___________ (用a、b、c字母排序)。
 的综合利用、实现
的综合利用、实现 资源化,是能源领域的重要发展方向。
资源化,是能源领域的重要发展方向。(1)
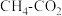 催化重整反应为
催化重整反应为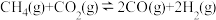 。
。已知
 ,
, 时,
时, 和
和 的燃烧热如下表:
的燃烧热如下表:| 可燃物 |  |  |  |
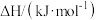 |  |  |  |

 。
。②催化重整过程还存在积碳反应:
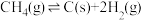 ,催化剂的活性会因积碳反应而降低。适当通入过量
,催化剂的活性会因积碳反应而降低。适当通入过量 可以有效缓解积碳,结合方程式解释其原因:
可以有效缓解积碳,结合方程式解释其原因:③相同时间内测得选用不同催化剂时
 的转化率随反应温度的变化如图1所示:
的转化率随反应温度的变化如图1所示:ⅰ、a点所处的状态
ⅱ、
 的转化率:
的转化率: ,原因是
,原因是
(2)以二氧化钛表面覆盖的
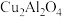 为催化剂,可以将
为催化剂,可以将 和
和 直接转化成乙酸。
直接转化成乙酸。①催化剂的催化效率与乙酸的生成速率随温度的变化关系如图2所示。
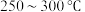 时,温度升高而乙酸的生成速率降低的原因是
时,温度升高而乙酸的生成速率降低的原因是②为了提高该反应中
 的平衡转化率,可以采取的措施是
的平衡转化率,可以采取的措施是(3)在电解质水溶液中,
 可被电化学还原为
可被电化学还原为 。在三种不同催化剂(a、b、c)上
。在三种不同催化剂(a、b、c)上 电还原为
电还原为 的反应进程中(
的反应进程中( 被还原为
被还原为 的反应可同时发生),相对能量变化如图。由此判断,
的反应可同时发生),相对能量变化如图。由此判断, 电还原为
电还原为 从易到难的顺序为
从易到难的顺序为
您最近一年使用:0次
2022-11-07更新
|
366次组卷
|
2卷引用:北京市第八十中学2022-2023学年高三上学期期末测试化学试题



