解题方法
1 . H2O2广泛应用于医疗卫生、化学合成等领域。
(1)已知2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ/mol,趣味实验“大象牙膏”的实验原理是H2O2溶液在KI催化作用下分解,反应的机理可表示为:
i.H2O2(l)+I-(aq)= H2O(l)+IO-(aq) △H1 = +a kJ/moL(a > 0)
ii.H2O2(l)+_______。
则ii中反应机理用热化学方程式表示为_______ 。
(2)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
Ⅰ.实验①和②的目的是_______ 。实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下 较稳定,不易分解,为达到实验目的,你对原方案的改进是
较稳定,不易分解,为达到实验目的,你对原方案的改进是_______ 。
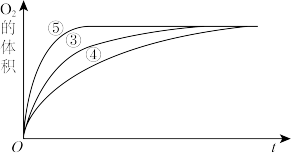
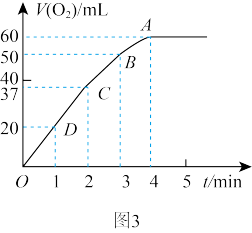
Ⅱ. 实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图,结合图分析实验,能够得出什么实验结论?
实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图,结合图分析实验,能够得出什么实验结论?_______ 。
Ⅲ.为比较 和
和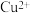 对
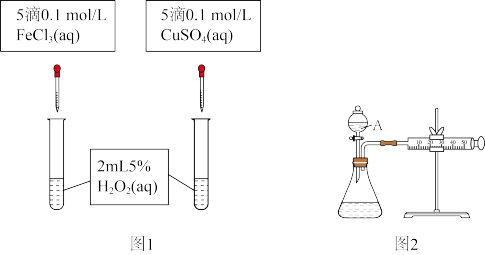
对 分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是
分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是
①写出 在
在 作用下发生反应的化学方程式:
作用下发生反应的化学方程式: _______ 
②利用图1实验,可通过观察产生气泡的快慢定性比较得出结论 有同学提出将
有同学提出将 改为
改为 更为合理,其理由是
更为合理,其理由是 _______ ,
③若利用图2实验可进行定理分析,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是_______ 。
④将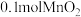 粉末加入50mL
粉末加入50mL  溶液中,在标准状况下放出气体的体积和时间的关系如图3所示,解释反应速率变化的原因:
溶液中,在标准状况下放出气体的体积和时间的关系如图3所示,解释反应速率变化的原因: _______ , 初始物质的量浓度为
初始物质的量浓度为 _______ (保留两位有效数字)。
(1)已知2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ/mol,趣味实验“大象牙膏”的实验原理是H2O2溶液在KI催化作用下分解,反应的机理可表示为:
i.H2O2(l)+I-(aq)= H2O(l)+IO-(aq) △H1 = +a kJ/moL(a > 0)
ii.H2O2(l)+_______。
则ii中反应机理用热化学方程式表示为
(2)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① |  溶液 溶液 | 无 |
| ② | 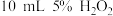 溶液 溶液 | 无 |
| ③ | 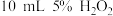 溶液 溶液 | 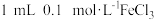 溶液 溶液 |
| ④ | 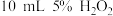 溶液 溶液 少量 HCl溶液 少量 HCl溶液 | 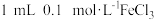 溶液 溶液 |
| ⑤ | 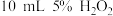 溶液 溶液 少量 NaOH溶液 少量 NaOH溶液 | 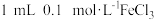 溶液 溶液 |
 较稳定,不易分解,为达到实验目的,你对原方案的改进是
较稳定,不易分解,为达到实验目的,你对原方案的改进是Ⅱ.
 实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图,结合图分析实验,能够得出什么实验结论?
实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图,结合图分析实验,能够得出什么实验结论?
Ⅲ.为比较
 和
和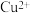 对
对 分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是
分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是
①写出
 在
在 作用下发生反应的化学方程式:
作用下发生反应的化学方程式: 
②利用图1实验,可通过观察产生气泡的快慢定性比较得出结论
 有同学提出将
有同学提出将 改为
改为 更为合理,其理由是
更为合理,其理由是 ③若利用图2实验可进行定理分析,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是
④将
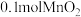 粉末加入50mL
粉末加入50mL  溶液中,在标准状况下放出气体的体积和时间的关系如图3所示,解释反应速率变化的原因:
溶液中,在标准状况下放出气体的体积和时间的关系如图3所示,解释反应速率变化的原因:  初始物质的量浓度为
初始物质的量浓度为 
您最近一年使用:0次
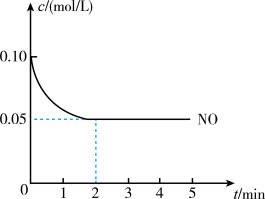
2 . 2NO(g) + O2(g) 2NO2(g) ∆H<0是制造硝酸的重要反应之一,在800℃时,向容积为2 L的密闭容器中充入0.20 mol NO和0.1 mol O2,反应过程中NO的浓度从随时间变化如图所示,
2NO2(g) ∆H<0是制造硝酸的重要反应之一,在800℃时,向容积为2 L的密闭容器中充入0.20 mol NO和0.1 mol O2,反应过程中NO的浓度从随时间变化如图所示,
请回答:
(1)2 min内,v(O2) =_______ mol/(L·min)。
(2)800℃时,该反应的化学平衡常数数值为_______ 。
(3)平衡时,NO的转化率是_______ 。
(4)下列能说明反应达平衡状态的是_______(填字母)。
(5)NO会造成大气污染,在工业上采用多种方法进行处理。
氧化法:烟气中的NO经O3预处理后转化为NO2,再用CaSO3悬浊液吸收NO2。
已知NO与O3反应过程的能量变化如下:
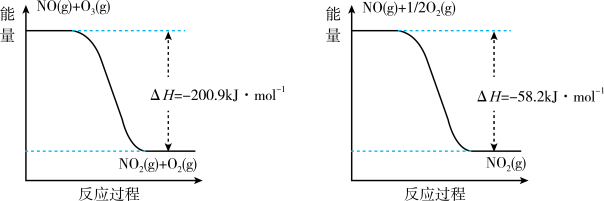
①请写出反应过程Ⅰ的热化学方程式_______ 。
②反应3NO(g) + O3(g)=3NO2(g) ΔH=_______ kJ•mol-1
③用CaSO3悬浊液吸收NO2,将其转化为HNO2,该反应的化学方程式为_______ 。
 2NO2(g) ∆H<0是制造硝酸的重要反应之一,在800℃时,向容积为2 L的密闭容器中充入0.20 mol NO和0.1 mol O2,反应过程中NO的浓度从随时间变化如图所示,
2NO2(g) ∆H<0是制造硝酸的重要反应之一,在800℃时,向容积为2 L的密闭容器中充入0.20 mol NO和0.1 mol O2,反应过程中NO的浓度从随时间变化如图所示,
请回答:
(1)2 min内,v(O2) =
(2)800℃时,该反应的化学平衡常数数值为
(3)平衡时,NO的转化率是
(4)下列能说明反应达平衡状态的是_______(填字母)。
| A.单位时间内生成a mol O2的同时生成2a mol NO2 |
| B.混合气体的颜色不再改变 |
| C.混合气体的密度不再改变 |
| D.混合气体的平均相对分子质量不再改变 |
氧化法:烟气中的NO经O3预处理后转化为NO2,再用CaSO3悬浊液吸收NO2。
已知NO与O3反应过程的能量变化如下:

①请写出反应过程Ⅰ的热化学方程式
②反应3NO(g) + O3(g)=3NO2(g) ΔH=
③用CaSO3悬浊液吸收NO2,将其转化为HNO2,该反应的化学方程式为
您最近一年使用:0次
名校
解题方法
3 . “绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。
Ⅰ.汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一、请回答下列问题:
(1)已知: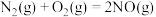
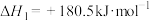

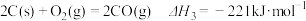
若某反应的平衡常数表达式为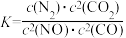 ,则此反应的热化学方程式为
,则此反应的热化学方程式为_______ 。
(2)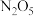 在一定条件下可发生分解:
在一定条件下可发生分解: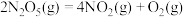 ,一定温度下,在恒容密闭容器中充入一定量
,一定温度下,在恒容密闭容器中充入一定量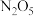 进行该反应,能判断反应已达到化学平衡状态的是
进行该反应,能判断反应已达到化学平衡状态的是_______ (填字母)。
a.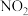 和
和 的浓度比保持不变 b.容器中压强不再变化
的浓度比保持不变 b.容器中压强不再变化
c.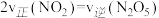 d.气体的密度保持不变
d.气体的密度保持不变
Ⅱ.甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。
(3)已知 CO2(g) + 3H2(g)⇌ CH3OH(g) + H2O(g),将 和
和 按物质的量之比1∶3充入体积为2.0 L的恒容密闭容器中反应生成
按物质的量之比1∶3充入体积为2.0 L的恒容密闭容器中反应生成 ,如图1表示压强为0.1 MPa和5.0 MPa下
,如图1表示压强为0.1 MPa和5.0 MPa下 转化率随温度的变化关系。
转化率随温度的变化关系。
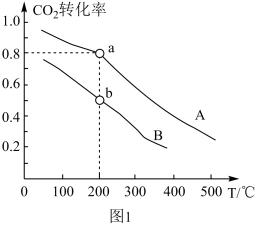
①a、b两点化学反应速率分别用Va、Vb,表示,则Va_______ Vb (填“大于”、“小于”或“等于”)。
②列出a点对应的平衡常数表达式K=_______ 。
(4)在1.0 L恒容密闭容器中投入1 mol CO2和2.75 mol H2发生反应:CO2(g) + 3H2(g)⇌CH3OH(g) + H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是_______ 。
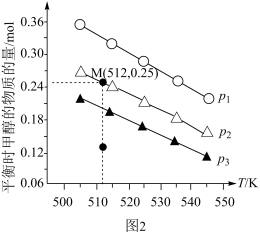
A.该反应的正反应为放热反应
B.压强大小关系为P1<P2<P3
C.M点对应的平衡常数K的值约为
D.在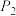 及512 K时,图中N点
及512 K时,图中N点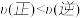
(5) 催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)⇌C2H5OH(g) + 3H2O(g)
催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)⇌C2H5OH(g) + 3H2O(g)  ;m代表起始时的投料比,即
;m代表起始时的投料比,即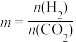 。
。
①图3中投料比相同,温度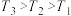 ,则该反应的焓变
,则该反应的焓变
_______ 0(填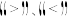 )。
)。

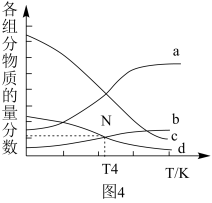
②m=3时,恒压条件下各物质的物质的量分数与温度的关系如图4所示,则曲线b代表的物质为_______ (填化学式)。
Ⅰ.汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一、请回答下列问题:
(1)已知:
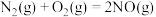
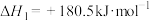

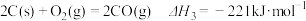
若某反应的平衡常数表达式为
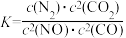 ,则此反应的热化学方程式为
,则此反应的热化学方程式为(2)
 在一定条件下可发生分解:
在一定条件下可发生分解: ,一定温度下,在恒容密闭容器中充入一定量
,一定温度下,在恒容密闭容器中充入一定量 进行该反应,能判断反应已达到化学平衡状态的是
进行该反应,能判断反应已达到化学平衡状态的是a.
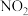 和
和 的浓度比保持不变 b.容器中压强不再变化
的浓度比保持不变 b.容器中压强不再变化c.
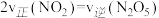 d.气体的密度保持不变
d.气体的密度保持不变Ⅱ.甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。
(3)已知 CO2(g) + 3H2(g)⇌ CH3OH(g) + H2O(g),将
 和
和 按物质的量之比1∶3充入体积为2.0 L的恒容密闭容器中反应生成
按物质的量之比1∶3充入体积为2.0 L的恒容密闭容器中反应生成 ,如图1表示压强为0.1 MPa和5.0 MPa下
,如图1表示压强为0.1 MPa和5.0 MPa下 转化率随温度的变化关系。
转化率随温度的变化关系。
①a、b两点化学反应速率分别用Va、Vb,表示,则Va
②列出a点对应的平衡常数表达式K=
(4)在1.0 L恒容密闭容器中投入1 mol CO2和2.75 mol H2发生反应:CO2(g) + 3H2(g)⇌CH3OH(g) + H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是

A.该反应的正反应为放热反应
B.压强大小关系为P1<P2<P3
C.M点对应的平衡常数K的值约为

D.在
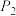 及512 K时,图中N点
及512 K时,图中N点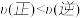
(5)
 催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)⇌C2H5OH(g) + 3H2O(g)
催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)⇌C2H5OH(g) + 3H2O(g)  ;m代表起始时的投料比,即
;m代表起始时的投料比,即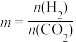 。
。①图3中投料比相同,温度
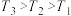 ,则该反应的焓变
,则该反应的焓变
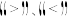 )。
)。
②m=3时,恒压条件下各物质的物质的量分数与温度的关系如图4所示,则曲线b代表的物质为

您最近一年使用:0次
2021-02-02更新
|
671次组卷
|
3卷引用:北京市密云二中2023-2024学年高二上学期10月月考化学试卷



