解题方法
1 . 目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数(K1、K2、K3)如下表所示:
请回答下列问题:
(1)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=___________ (用K1、K2表示);
(2)根据反应③判断熵变△S___________ 0(填“>”“=”或“<”),依据反应自发进行的判据:△G=△H-T△S<0时可自发进行,判断:在___________ (填“较高”或“较低”)温度下有利于该反应自发进行。
(3)500℃下,测得反应③在某时刻时,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.15 mol·L-1、0.2 mol·L-1、0.4 mol·L-1、0.25 mol·L-1,则此时v正___________ v逆(填“>”“=”或“<”)。
(4)要提高反应③的反应速率,同时增大CH3OH(g)的产率,可采取的措施有___________ (填字母代号)。
A.扩大反应容器的容积 B.使用合适的催化剂
C.缩小反应容器的容积 D.从平衡体系中及时分离出CH3OH(g)
| 化学反应 | 平衡常数 | 平衡常数 | ||
| 500℃ | 700℃ | 800℃ | ||
| ①2H2(g)+CO(g)=CH3OH(g) △H1 | K1 | 2.5 | 0.34 | 0.15 |
| ②CO2(g)+ H2(g)=CO(g)+H2O(g) △H2 | K2 | 1.0 | 1.70 | 2.52 |
| ③CO2(g)+ 3H2(g)=CH3OH(g)+H2O(g) △H3 | K3 |
请回答下列问题:
(1)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=
(2)根据反应③判断熵变△S
(3)500℃下,测得反应③在某时刻时,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.15 mol·L-1、0.2 mol·L-1、0.4 mol·L-1、0.25 mol·L-1,则此时v正
(4)要提高反应③的反应速率,同时增大CH3OH(g)的产率,可采取的措施有
A.扩大反应容器的容积 B.使用合适的催化剂
C.缩小反应容器的容积 D.从平衡体系中及时分离出CH3OH(g)
您最近一年使用:0次
名校
2 . 化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于吸热反应的是___________ (填字母)。
A.Na2O与水反应 B.甲烷的燃烧反应
C.Ba(OH)2·8H2O与氯化铵反应 D.锌与盐酸反应
(2)获取能量变化的途径
①通过化学键的键能计算。已知:
计算可得:H2(g)+Cl2(g)=2HCl(g) △H= ___________ kJ·mol-1
②通过盖斯定律可计算。已知在25℃、101 kPa时:
I.2Na(s)+ O2(g)=Na2O(s) △H=-414 kJ·mol-1
O2(g)=Na2O(s) △H=-414 kJ·mol-1
II.2Na(s)+O2(g)=Na2O2(s) △H=-511 kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式:___________ 。
(3)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。
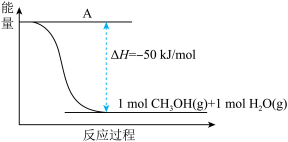
①补全上图:图中A处应填入___________ 。
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的△H___________ (填“变大”“变小”或“不变” )。
)。
③某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。
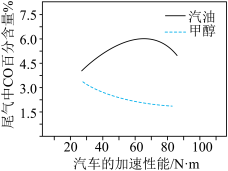
据图信息分析,与汽油相比,甲醇作为燃料的优点是___________ 。
(1)下列反应中,属于吸热反应的是
A.Na2O与水反应 B.甲烷的燃烧反应
C.Ba(OH)2·8H2O与氯化铵反应 D.锌与盐酸反应
(2)获取能量变化的途径
①通过化学键的键能计算。已知:
| 化学键种类 | H-H | Cl-Cl | H-Cl |
| 键能(kJ/mol) | 436 | 247 | 434 |
②通过盖斯定律可计算。已知在25℃、101 kPa时:
I.2Na(s)+
 O2(g)=Na2O(s) △H=-414 kJ·mol-1
O2(g)=Na2O(s) △H=-414 kJ·mol-1II.2Na(s)+O2(g)=Na2O2(s) △H=-511 kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式:
(3)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。

①补全上图:图中A处应填入
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的△H
 )。
)。③某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。

据图信息分析,与汽油相比,甲醇作为燃料的优点是
您最近一年使用:0次
2021-01-28更新
|
468次组卷
|
6卷引用:湖北省部分高中2020-2021学年高二上学期期中考试化学试题
名校
解题方法
3 . 根据要求填空
(1)打火机、运动会中的火炬一般采用丙烷(C3H8)为燃料。丙烷热值较高,污染较小,是一种优良的燃料。已知一定量丙烷完全燃烧生成CO2和1molH2O(l)过程中的能量变化如图,请写出表示丙烷燃烧热的热化学方程式:__ 。

(2)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如图:

①电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是__ (填“正极”或“负极”),c电极的反应方程式为___ 。
②用该燃料电池电解1L饱和食盐水(足量),当燃料电池消耗0.56L(标准状况下)氧气时,溶液pH=___ (不考虑溶液体积变化)。
(3)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式是__ ,该反应能设计成原电池的原因是__ 。A是__ (填物质名称)。

(1)打火机、运动会中的火炬一般采用丙烷(C3H8)为燃料。丙烷热值较高,污染较小,是一种优良的燃料。已知一定量丙烷完全燃烧生成CO2和1molH2O(l)过程中的能量变化如图,请写出表示丙烷燃烧热的热化学方程式:

(2)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如图:

①电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是
②用该燃料电池电解1L饱和食盐水(足量),当燃料电池消耗0.56L(标准状况下)氧气时,溶液pH=
(3)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式是

您最近一年使用:0次
2020-03-08更新
|
125次组卷
|
2卷引用:湖北省荆州市四县市2019-2020学年高二上学期期末考试化学试题
4 . 根据要求填空:
(1)FeSO4可转化为FeCO3,FeCO3在空气中加热可制得铁系氧化物材料,已知25℃,101KPa时:4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1648kJ/mol
C(s)+O2(g)=CO2(g) △H=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) △H=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式为___ 。
(2)某温度时水的离子积Kw=1.0×10-13,则该温度时纯水的pH__ 7(填“>”、“<”或“=”)。该温度下,pH=2的CH3COOH溶液中,c(OH-)=__ 。
(3)向2份0.1mol/LCH3COONa溶液中分别加入少量NH4NO3、Na2SO3固体(忽略体积变化),则CH3COO-浓度的变化依次为___ 、___ (填“减小”“增大”或“不变”)。
(4)同浓度的NaA和NaB两种溶液pH前者大于后者,比较两份溶液中所含阴离子总浓度大小为c(NaA)__ c(NaB)(填“>”、“<”或“=“)。
(5)25℃时,某溶液中Fe3+的浓度为0.010mol/L,使Fe3+恰好完全沉淀的pH为__ 。(已知:当离子浓度小于或等于10-5mol/L认为完全反应;Ksp[Fe(OH)3]=8×10-38,lg2=0.3)
(1)FeSO4可转化为FeCO3,FeCO3在空气中加热可制得铁系氧化物材料,已知25℃,101KPa时:4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1648kJ/mol
C(s)+O2(g)=CO2(g) △H=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) △H=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式为
(2)某温度时水的离子积Kw=1.0×10-13,则该温度时纯水的pH
(3)向2份0.1mol/LCH3COONa溶液中分别加入少量NH4NO3、Na2SO3固体(忽略体积变化),则CH3COO-浓度的变化依次为
(4)同浓度的NaA和NaB两种溶液pH前者大于后者,比较两份溶液中所含阴离子总浓度大小为c(NaA)
(5)25℃时,某溶液中Fe3+的浓度为0.010mol/L,使Fe3+恰好完全沉淀的pH为
您最近一年使用:0次
2020-03-02更新
|
83次组卷
|
2卷引用:湖北省鄂州市2019-2020学年高二上学期期末考试化学试题
解题方法
5 . (1)已知:①甲烷的燃烧热为 ΔH=—890.3 kJ/mol
②2H2(g)+O2(g)=2H2O(l) ΔH=—517.6 kJ/mol
③2CO(g)+O2(g)=2CO2(g) ΔH=—566kJ/mol
甲烷在一定条件下与CO2反应制备合成气(CO、H2),能实现变废为宝,减少CO2的排放,该反应的热化学方程式为_____________________________________________
(2)燃料电池是应用广泛的新型电池,分析下列燃料电池示意图,按要求书写出电极反应式

①正极的电极反应式____________________________________________ ;
②电解质溶液的pH_____________ (填“增大”、“减小”或“不变”);
③当电路中转移0.4mol电子时,理论上消耗标准状况下O2的体积为__________ L。
②2H2(g)+O2(g)=2H2O(l) ΔH=—517.6 kJ/mol
③2CO(g)+O2(g)=2CO2(g) ΔH=—566kJ/mol
甲烷在一定条件下与CO2反应制备合成气(CO、H2),能实现变废为宝,减少CO2的排放,该反应的热化学方程式为
(2)燃料电池是应用广泛的新型电池,分析下列燃料电池示意图,按要求书写出电极反应式

①正极的电极反应式
②电解质溶液的pH
③当电路中转移0.4mol电子时,理论上消耗标准状况下O2的体积为
您最近一年使用:0次



