11-12高二上·福建福州·阶段练习
名校
解题方法
1 . 肼(N2H4)是火箭发动机的燃料,它与N2O4反应生成氮气和水蒸气。已知:
①N2(g)+2O2(g)=N2O4(g) △H=+8.7 kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g) △H= - 534.0 kJ/mol
下列表示肼跟N2O4反应的热化学方程式正确的是
①N2(g)+2O2(g)=N2O4(g) △H=+8.7 kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g) △H= - 534.0 kJ/mol
下列表示肼跟N2O4反应的热化学方程式正确的是
| A.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H=-542.7 kJ/mol |
| B.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H=-1076.7 kJ/mol |
| C.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H=-2153.4 kJ/mol |
| D.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H=-1059.3 kJ/mol |
您最近一年使用:0次
2020-12-01更新
|
195次组卷
|
19卷引用:【全国百强校】黑龙江省哈尔滨市第六中学2019届高三上学期10月月考化学试题
【全国百强校】黑龙江省哈尔滨市第六中学2019届高三上学期10月月考化学试题黑龙江省安达市第七中学2019-2020学年高二3月月考化学试题(已下线)2011-2012年福建省福州市罗源一中高二上学期第一次月考化学试卷(已下线)2012-2013学年江苏省宿迁青华中学高二下学期期中考化学普通班试卷(已下线)2012-2013学年河北省存瑞中学高一下学期第三次月考化学试卷(已下线)2013-2014学年江苏省常州市某重点中学高二上学期期中考试化学试卷2014-2015浙江省台州书生中学高二上学期第三次月考化学试卷2015-2016学年福建省福州八中高二上学期期末化学试卷2015-2016学年河北省邢台一中高一下第一次月考化学试卷2016-2017学年河南省郸城中学高二上第一次考试化学卷2016-2017学年山东省济南市长清一中高二上第一次质检化学卷内蒙古杭锦后旗奋斗中学2018届高三上学期第三次月考化学试题湖北省仙桃市汉江高级中学2016-2017学年高一下学期期末考试化学试题【全国校级联考】山西省汾阳市第二高级中学、文水县第二高级中学2016-2017学年高二上学期第一次联考化学试题甘肃省岷县二中2018-2019学年高二上学期第一次月考化学试题(已下线)2018年12月21日 《每日一题》人教选修4-盖斯定律(已下线)2019年12月18日 《每日一题》化学人教版(选修4)——盖斯定律广东实验中学附属天河学校2020--2021学年高二上学期期中考试化学试题海南省北京师范大学万宁附中2020-2021学年高一下学期期中考试化学试题
解题方法
2 . 氮及其化合物在工农业生产、生活中有着重要作用。
(1)图I是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是______ (填“增大”“减小”或“不变”,下同),△H的变化是______ 。

(2)如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式_______ 。

(3)若已知下列数据:
试根据表中及图中数据计算N—H的键能:______ kJ·mol-1。
(4)用NH3催化还原NOx还可以消除氮氧化物的污染。已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)ΔH1=-akJ·mol-1①N2(g)+O2(g)=2NO(g)ΔH2=-bkJ·mol-1②,若1molNH3还原NO至N2,该反应ΔH3=_____ kJ·mol-1(用含a、b的式子表示)。
(5)目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g) (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g) NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g) 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
则ΔH3与ΔH1、ΔH2之间的关系是ΔH3=______ 。
(1)图I是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是

(2)如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式

(3)若已知下列数据:
| 化学键 | H—H | N N N |
| 键能/kJ•mol-1 | 435 | 943 |
试根据表中及图中数据计算N—H的键能:
(4)用NH3催化还原NOx还可以消除氮氧化物的污染。已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)ΔH1=-akJ·mol-1①N2(g)+O2(g)=2NO(g)ΔH2=-bkJ·mol-1②,若1molNH3还原NO至N2,该反应ΔH3=
(5)目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)
 (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1反应Ⅱ:NH3(l)+H2O(l)+CO2(g)
 NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)
 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3则ΔH3与ΔH1、ΔH2之间的关系是ΔH3=
您最近一年使用:0次
3 . 通过以下反应均可获取H2。下列有关说法正确的是( )
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+O2(g)ΔH1=+571.6kJ·mol-1
②焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g)ΔH2=+131.3kJ·mol-1
③甲烷与水制氢:CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH3=+206.1kJ·mol-1
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+O2(g)ΔH1=+571.6kJ·mol-1
②焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g)ΔH2=+131.3kJ·mol-1
③甲烷与水制氢:CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH3=+206.1kJ·mol-1
| A.反应①中电能转化为化学能 |
| B.反应②中反应物总能量一定高于生成物总能量 |
| C.反应③使用催化剂,ΔH3减小 |
| D.反应CH4(g)=C(s)+2H2(g)的ΔH=+74.8kJ·mol-1 |
您最近一年使用:0次
名校
解题方法
4 . (1)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+ O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为_______________ 。
(2)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。

可知水煤气变换的ΔH_____ 0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正= _____ eV,写出该步骤的化学方程式__________ 。
(3)如表所示是部分化学键的键能参数:
已知白磷的燃烧热为d kJ·mol-1,白磷及其完全燃烧的产物的结构如图所示,则表中x=________ kJ·mol-1(用含a、b、c、d的代表数式表示)。

(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1176 kJ/mol,则反应过程中,每转移1 mol电子放出的热量为________ 。
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+
 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1又知③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为
(2)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。

可知水煤气变换的ΔH
(3)如表所示是部分化学键的键能参数:
| 化学键 | P—P | P—O | O=O | P=O |
| 键能/kJ·mol-1 | a | b | c | x |

(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1176 kJ/mol,则反应过程中,每转移1 mol电子放出的热量为
您最近一年使用:0次
2020-11-30更新
|
270次组卷
|
4卷引用:黑龙江省八校2021届高三摸底考试化学试题
解题方法
5 . 设NA为阿伏加德罗常数的值。已知反应:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH1=-a kJ·mol-1
②CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH2=-b kJ·mol-1
其他数据如下表:
下列说法正确的是( )
①CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH1=-a kJ·mol-1
②CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH2=-b kJ·mol-1
其他数据如下表:
| 化学键 | C=O | O=O | C-H | O-H |
| 键能/(kJ·mol-1) | 798 | x | 413 | 463 |
| A.b<a,且甲烷的燃烧热为b kJ·mol-1 |
B.上表中x=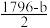 |
| C.H2O(g)=H2O(l) ΔH=-(a-b)kJ·mol-1 |
| D.当有4NA个C—H键断裂时,该反应放出热量一定为b kJ |
您最近一年使用:0次
6 . 研究发现,氮氧化物和硫氧化物是雾霾的主要成分。回答下列问题:
(1)有下列反应:①N2(g)+O2(g)=2NO(g) ΔH=+180.5 kJ·mol-1
②C(s)+O2(g)= CO2(g) ΔH = -393.5 kJ·mol-1
③2C(s)+O2(g)=2CO(g) ΔH = - 221.0 kJ·mol-1
已知某反应的平衡常数K= ,该反应的热化学方程式为
,该反应的热化学方程式为______ 。
(2)往1L恒容密闭容器中充入一定最的NO2,在三种不同条件下发生反应:2NO2(g) 2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表所示(不考现NO2生成N2O4的反应)。
2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表所示(不考现NO2生成N2O4的反应)。
①下列说法正确的是____ (填标号)。
A.平衡时,实验2容器内气体压强比实验1的小
B.由实验2和实验3可判断该反应是放热反应
C.实验1比实验3的平衡常数大
D.实验2使用了比实验1效率更高的催化剂
E.在0~10 min内,实验2的反应速率 (O2)=0.015 mol·L-1·min-1
(O2)=0.015 mol·L-1·min-1
②不能判断该反应已达到化学平衡状态的是____ (填标号)。
A.容器内的气体压强保持不变
B.2 正(NO2)=
正(NO2)=  逆(O2)
逆(O2)
C.气体的平均相对分子质量保持不变
D.NO2和NO的浓度比保持不变
③已知容器内的起始压强为p0kPa,在800 ℃温度下该反应的平衡常数Kp=_____ kPa(用平衡分压代替平衡浓度计算,平衡时分压=平衡时总压 ×平衡时物质的量分数)。在该温度下达到平衡后,再向容器中加入NO2和NO各2 mol,平衡将_____ (填“向正反应方向移动 ”或“向逆反应方向移动”或“不移动”)。
(3)为了减少雾霾中的SO2,工业尾气中SO2可用饱和Na2SO3溶液吸收,该反应的化学方程式为_____ 。 25 ℃时,若用1 mol·L-1Na2SO3溶液吸收SO2,当恰好完全反应时,溶液中各离子浓度由大到小的顺序为_________ (已知:常温下H2SO3的电离常数K1=1.3 ×10-2,K2=6.2×10-8)。
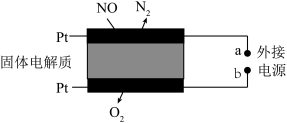
(4)电化学催化净化NO是一种新颍的处理氮氧化物的方法。原理如下图,固体电解质起到传导O2-的作用,则通入NO的电极反应式为__________ 。
(1)有下列反应:①N2(g)+O2(g)=2NO(g) ΔH=+180.5 kJ·mol-1
②C(s)+O2(g)= CO2(g) ΔH = -393.5 kJ·mol-1
③2C(s)+O2(g)=2CO(g) ΔH = - 221.0 kJ·mol-1
已知某反应的平衡常数K=
 ,该反应的热化学方程式为
,该反应的热化学方程式为(2)往1L恒容密闭容器中充入一定最的NO2,在三种不同条件下发生反应:2NO2(g)
 2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表所示(不考现NO2生成N2O4的反应)。
2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表所示(不考现NO2生成N2O4的反应)。 | 0 | 10 | 20 | 30 | 40 | 50 |
| 实验1/800 | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 . | 0.50. |
| 实骑2/800 | 1.00 | 0.70 | 0.50 | 0.50 | 0.50 | 0.50 |
| 实验3/850 | 1.00 | 0.50 | 0.40 | 0.35 | 0.35 | 0.35 |
A.平衡时,实验2容器内气体压强比实验1的小
B.由实验2和实验3可判断该反应是放热反应
C.实验1比实验3的平衡常数大
D.实验2使用了比实验1效率更高的催化剂
E.在0~10 min内,实验2的反应速率
 (O2)=0.015 mol·L-1·min-1
(O2)=0.015 mol·L-1·min-1②不能判断该反应已达到化学平衡状态的是
A.容器内的气体压强保持不变
B.2
 正(NO2)=
正(NO2)=  逆(O2)
逆(O2)C.气体的平均相对分子质量保持不变
D.NO2和NO的浓度比保持不变
③已知容器内的起始压强为p0kPa,在800 ℃温度下该反应的平衡常数Kp=
(3)为了减少雾霾中的SO2,工业尾气中SO2可用饱和Na2SO3溶液吸收,该反应的化学方程式为
(4)电化学催化净化NO是一种新颍的处理氮氧化物的方法。原理如下图,固体电解质起到传导O2-的作用,则通入NO的电极反应式为

您最近一年使用:0次
7 . 目前我国分别在治理大气污染和新能源使用上都取得长足的进步。
(1)在大气污染治理上,目前我国计划在“十二五”期间用甲烷还原氮氧化物(NOx),使其排放量减少10%。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为_________ 。
(2)在新能源使用上,正在研究利用甲烷合成甲醇这个清洁能源。该反应为:CH4(g) + H2O(g) CH3OH(g) + H2(g) △H > 0
CH3OH(g) + H2(g) △H > 0
将一定量的CH4和一定量H2O(g)通入10L容器中,若改变起始量,CH4的平衡转化率如图所示:
①假设100 ℃时若按甲投料反应达到平衡所需的时间为5min,则用甲烷表示该反应的平均反应速率为____ 。
②在不改变其他外界条件下α1、α2、α3的相对大小顺序为:___ 。
③欲提高CH4转化率且不改变该反应的平衡常数的方法是___ (填字母序号)。
A c(CH4)增大 B 分离出产品CH3OH
C 升高温度 D 比值增大 E 容器体积缩小一半
比值增大 E 容器体积缩小一半
④下列图像对该反应表达正确的是:___ 。

(3)清洁能源的研发是世界能源研究的热点,比如锂电池的高速发展促使了电动汽车的快速发展,如特斯拉使用了钴酸锂电池,比亚迪使用了磷酸铁锂电池。其中磷酸铁锂电池工作原理:FePO4+Li LiFePO4
LiFePO4
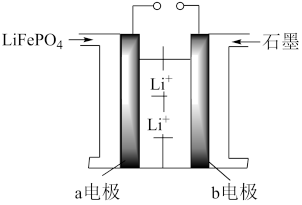
①该电池的充电时a电极应与电源的___ 相连;
②该极放电时的电极反应式为______ 。
(1)在大气污染治理上,目前我国计划在“十二五”期间用甲烷还原氮氧化物(NOx),使其排放量减少10%。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为
(2)在新能源使用上,正在研究利用甲烷合成甲醇这个清洁能源。该反应为:CH4(g) + H2O(g)
 CH3OH(g) + H2(g) △H > 0
CH3OH(g) + H2(g) △H > 0将一定量的CH4和一定量H2O(g)通入10L容器中,若改变起始量,CH4的平衡转化率如图所示:
甲 | 乙 | 丙 | ||
起始物质的量 | n(CH4)/ mol | 5 | 4 | 10 |
n(H2O)/ mol | 10 | 8 | 10 | |
CH4的平衡转化率 / % | α1=50 | α2 | α3 | |
②在不改变其他外界条件下α1、α2、α3的相对大小顺序为:
③欲提高CH4转化率且不改变该反应的平衡常数的方法是
A c(CH4)增大 B 分离出产品CH3OH
C 升高温度 D
 比值增大 E 容器体积缩小一半
比值增大 E 容器体积缩小一半④下列图像对该反应表达正确的是:

(3)清洁能源的研发是世界能源研究的热点,比如锂电池的高速发展促使了电动汽车的快速发展,如特斯拉使用了钴酸锂电池,比亚迪使用了磷酸铁锂电池。其中磷酸铁锂电池工作原理:FePO4+Li
 LiFePO4
LiFePO4
①该电池的充电时a电极应与电源的
②该极放电时的电极反应式为
您最近一年使用:0次
2020-11-27更新
|
409次组卷
|
2卷引用:安徽省蚌埠第三中学2019-2020学年高二上学期期中考试化学试题
名校
8 . 甲醇在工业生产中有重要作用。工业上利用 CO 和 H2在催化剂的作用下合成甲醇: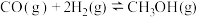 ΔH,下表是该反应在不同温度下的化学平衡常数(K)
ΔH,下表是该反应在不同温度下的化学平衡常数(K)
(1)该反应的△H _______ 0(填“>”“<”或“=”),在一密闭容器中发生上述反应并达到平衡后, 保持其他条件不变,对容器增大压强,此反应的化学反应平衡常数_____ (填“变大”“变小”或“不变”)。
(2)某温度下,在容积为2L的密闭容器中充入1molCO与2mol H2充分反应合成甲醇。
①2s后达到平衡,测得平衡时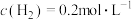 ,则 CO 的反应速率为
,则 CO 的反应速率为 ____ 。
②该反应达到平衡时,反应物转化率(α)的关系是α(CO)___ α(H2)。(填“>”“<”或“=”)
③在温度、容积不变的情况下,向该密闭容器中再增加 1molCO与2molH2,达到新平衡时,CH3OH 的百分含量___ (填“增大”“减小”或“不变”)。
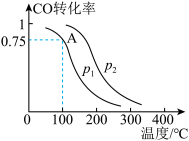
④一定条件下,该反应平衡转化率与温度、压强的关系如图所示:p1____ p2(填“>”“<”或“=”)。
(3)已知在常温常压下:
①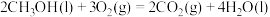 ΔH1=-Q1 kJ·mol−1
ΔH1=-Q1 kJ·mol−1
② ΔH2=-Q2 kJ·mol−1
ΔH2=-Q2 kJ·mol−1
③H2O(g)=H2O(l) ΔH3=-Q3 kJ·mol−1
请写出液态甲醇发生不完全燃烧生成一氧化碳和气态水的热化学方程式:_______ 。
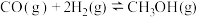 ΔH,下表是该反应在不同温度下的化学平衡常数(K)
ΔH,下表是该反应在不同温度下的化学平衡常数(K)| 温度 | 250℃ | 300℃ | 350℃ |
| 平衡常数(K) | 2.041 | 0.270 | 0.012 |
(2)某温度下,在容积为2L的密闭容器中充入1molCO与2mol H2充分反应合成甲醇。
①2s后达到平衡,测得平衡时
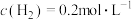 ,则 CO 的反应速率为
,则 CO 的反应速率为 ②该反应达到平衡时,反应物转化率(α)的关系是α(CO)
③在温度、容积不变的情况下,向该密闭容器中再增加 1molCO与2molH2,达到新平衡时,CH3OH 的百分含量
④一定条件下,该反应平衡转化率与温度、压强的关系如图所示:p1

(3)已知在常温常压下:
①
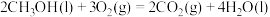 ΔH1=-Q1 kJ·mol−1
ΔH1=-Q1 kJ·mol−1 ②
 ΔH2=-Q2 kJ·mol−1
ΔH2=-Q2 kJ·mol−1 ③H2O(g)=H2O(l) ΔH3=-Q3 kJ·mol−1
请写出液态甲醇发生不完全燃烧生成一氧化碳和气态水的热化学方程式:
您最近一年使用:0次
名校
解题方法
9 . (1)已知稀溶液中,1molH2SO4与2molNaOH恰好完全反应时,放出114.6kJ热量,写出表示H2SO4与NaOH反应的中和反应反应热的热化学方程式:_____________ 。
(2)碳的燃烧热为393.5kJ·mol-1,写出表示碳的燃烧热的热化学方程式:________ 。
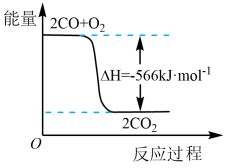
(3)已知CO(g)转化成CO2(g)的能量变化如图所示。写出该反应的热化学方程式:____________ 。
(4)25℃、10lkPa条件下充分燃烧一定量的丁烷气体,放出的热量为QkJ,经测定,将生成的CO2通入足量澄清石灰水中产生25g白色沉淀,写出表示丁烷燃烧热的热化学方程式:__________________ 。
(5)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ/mol
②C(s)+O2(g)═CO2(g)△H2=-393.5kJ/mol
③H2(g)+ O2(g)═H2O(l)△H3=-285.8kJ/mol写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式:
O2(g)═H2O(l)△H3=-285.8kJ/mol写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式:_______________ 。
(2)碳的燃烧热为393.5kJ·mol-1,写出表示碳的燃烧热的热化学方程式:
(3)已知CO(g)转化成CO2(g)的能量变化如图所示。写出该反应的热化学方程式:

(4)25℃、10lkPa条件下充分燃烧一定量的丁烷气体,放出的热量为QkJ,经测定,将生成的CO2通入足量澄清石灰水中产生25g白色沉淀,写出表示丁烷燃烧热的热化学方程式:
(5)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ/mol
②C(s)+O2(g)═CO2(g)△H2=-393.5kJ/mol
③H2(g)+
 O2(g)═H2O(l)△H3=-285.8kJ/mol写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式:
O2(g)═H2O(l)△H3=-285.8kJ/mol写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式:
您最近一年使用:0次
2020-11-23更新
|
726次组卷
|
8卷引用:广东省阳东广雅学校2017-2018学年高二11月月考化学试题
名校
解题方法
10 . 白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
(1)已知298K时白磷、红磷完全燃烧的热化学方程式分别为P4(白磷,s)+5O2(g)=P4O10(s) ΔH1=-2983.2kJ·mol-1,P(红磷,s)+ O2(g)=
O2(g)=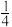 P4O10(s)ΔH2=-738.5kJ·mol-1。则该温度下白磷转化为红磷的热化学方程式为
P4O10(s)ΔH2=-738.5kJ·mol-1。则该温度下白磷转化为红磷的热化学方程式为___ 。
(2)已知298K时白磷不完全燃烧的热化学方程式为P4(白磷,s)+3O2(g)=P4O6(s) ΔH=-1638kJ·mol-1。在某密闭容器中加入62g白磷和50.4L氧气(标准状况),恰好完全反应,则所得到的P4O10与P4O6的物质的量之比为___ ,反应过程中放出的热量为____ 。
(3)已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P198,Cl—Cl243,P—Cl331。

则反应P4(白磷,s)+6Cl2(g)=4PCl3(s)的反应热ΔH=___ 。
(4)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2、和CO的燃烧热(△H)分别为-890.2kJ•mol-1、-285.8kJ•mol-1和-283.0kJ•mol-1,则生成1molCO所需热量为___ 。
(1)已知298K时白磷、红磷完全燃烧的热化学方程式分别为P4(白磷,s)+5O2(g)=P4O10(s) ΔH1=-2983.2kJ·mol-1,P(红磷,s)+
 O2(g)=
O2(g)=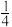 P4O10(s)ΔH2=-738.5kJ·mol-1。则该温度下白磷转化为红磷的热化学方程式为
P4O10(s)ΔH2=-738.5kJ·mol-1。则该温度下白磷转化为红磷的热化学方程式为(2)已知298K时白磷不完全燃烧的热化学方程式为P4(白磷,s)+3O2(g)=P4O6(s) ΔH=-1638kJ·mol-1。在某密闭容器中加入62g白磷和50.4L氧气(标准状况),恰好完全反应,则所得到的P4O10与P4O6的物质的量之比为
(3)已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P198,Cl—Cl243,P—Cl331。

则反应P4(白磷,s)+6Cl2(g)=4PCl3(s)的反应热ΔH=
(4)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2、和CO的燃烧热(△H)分别为-890.2kJ•mol-1、-285.8kJ•mol-1和-283.0kJ•mol-1,则生成1molCO所需热量为
您最近一年使用:0次



