1 . Ⅰ.(1) P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是______
a.NH3 b.HI c.SO2 d.CO2
(2)工业生产甲醇的常用方法是:CO(g)+2H2(g) CH3OH(g) △H1 = —90.8kJ/mol。
CH3OH(g) △H1 = —90.8kJ/mol。
已知:2H2(g)+O2(g)=2H2O(l) △H2 = -571.6kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H3= -566.0kJ/mol
计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H4 =___________ 。
(3)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4 + 3Zn ="=" Fe2O3 +ZnO +2K2ZnO2
该电池正极发生的反应的电极反应式为____________________________ 。
II.用如图所示装置进行实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
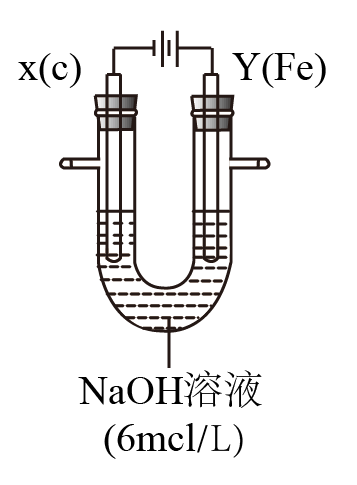
(4)电解过程中,X极区溶液的pH____________ (填“增大” 、“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为Fe - 6e- + 8OH-=FeO42- + 4H2O和___________________ 。
(6)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少___________ g。
a.NH3 b.HI c.SO2 d.CO2
(2)工业生产甲醇的常用方法是:CO(g)+2H2(g)
 CH3OH(g) △H1 = —90.8kJ/mol。
CH3OH(g) △H1 = —90.8kJ/mol。已知:2H2(g)+O2(g)=2H2O(l) △H2 = -571.6kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H3= -566.0kJ/mol
计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H4 =
(3)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4 + 3Zn ="=" Fe2O3 +ZnO +2K2ZnO2
该电池正极发生的反应的电极反应式为
II.用如图所示装置进行实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。

(4)电解过程中,X极区溶液的pH
(5)电解过程中,Y极发生的电极反应为Fe - 6e- + 8OH-=FeO42- + 4H2O和
(6)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少
您最近一年使用:0次
2016-12-09更新
|
122次组卷
|
3卷引用:2016届黑龙江双鸭山第一中学高三上学期期中测试化学试卷
名校
2 . 按要求书写下列表达式。
(1)用次氯酸钠除去氨氮的原理如图所示。该图示的总反应化学方程式为_________ 。

(2)已知:
反应Ⅰ N2(g)+O2(g)=2NO(g) ΔH1=a kJ·mol-1
反应Ⅱ 2NO(g)+O2(g)=2NO2(g) ΔH2=b kJ·mol-1
反应Ⅲ 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH3=c kJ·mol-1
写出NO2和NH3反应生成N2和液态水的热化学反应方程式_________ 。
(3)用压强传感器探究生铁在pH=2和pH=4的醋酸溶液中发生的腐蚀装置及得到的图象如图。


①溶液的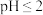 时,生铁发生电化学腐蚀的正极反应式为
时,生铁发生电化学腐蚀的正极反应式为_________ 。
②溶液的pH=4时,生铁发生_________ 腐蚀。
(4)用KOH做电解质的CO碱性燃料电池(如图)作电源,用惰性电极电解含CN-的酸性废水,将CN-彻底氧化为无害气体,以净化废水。该电池的负极反应式为_________ ;电解CN-废水的阳极反应式为_______ 。

(1)用次氯酸钠除去氨氮的原理如图所示。该图示的总反应化学方程式为

(2)已知:
反应Ⅰ N2(g)+O2(g)=2NO(g) ΔH1=a kJ·mol-1
反应Ⅱ 2NO(g)+O2(g)=2NO2(g) ΔH2=b kJ·mol-1
反应Ⅲ 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH3=c kJ·mol-1
写出NO2和NH3反应生成N2和液态水的热化学反应方程式
(3)用压强传感器探究生铁在pH=2和pH=4的醋酸溶液中发生的腐蚀装置及得到的图象如图。


①溶液的
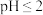 时,生铁发生电化学腐蚀的正极反应式为
时,生铁发生电化学腐蚀的正极反应式为②溶液的pH=4时,生铁发生
(4)用KOH做电解质的CO碱性燃料电池(如图)作电源,用惰性电极电解含CN-的酸性废水,将CN-彻底氧化为无害气体,以净化废水。该电池的负极反应式为

您最近一年使用:0次
3 . 燃料的使用和防污染是社会发展中一个无法回避的矛盾话题。
(1)我国北方冬季烧煤供暖所产生的废气是雾霾的主要来源之一。经研究发现将煤炭在O2/CO2的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为:
2NO(g)+2CO(g)═N2(g)+2CO2(g) △H
若①N2(g)+O2(g)═2NO(g) △H1=+180.5kJ·mol-1
②2CO(g)═2C(s)+O2(g) △H2=+221kJ·mol-1
③C(s)+O2(g)═CO2(g) △H3=﹣393.5kJ·mol-1
则△H=_______________ kJ·mol-1。
(2)为了提高燃料的利用率,可以将甲醇设计为燃料电池,写出熔融K2CO3做电解质时,甲醇燃料电池的负极反应式:___________________ ;该电池负极与水库的铁闸相连时,可以保护铁闸不被腐蚀,这种方法叫做________________ 。
(3)含有甲醇的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:___________________ 。
(4)机动车的尾气也是雾霾形成的原因之一。
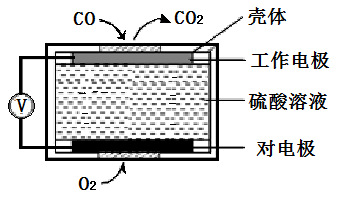
①近几年有人提出在催化剂条件下,利用汽油中挥发出来的C3H6催化还原尾气中的NO气体生成三种无污染的物质。请写出该过程的化学方程式:________________ ;
②电化学气敏传感器法是测定汽车尾气常用的方法之一。其中CO传感器的工作原理如上图所示,则对电极的电极反应式为______________________ 。
(1)我国北方冬季烧煤供暖所产生的废气是雾霾的主要来源之一。经研究发现将煤炭在O2/CO2的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为:
2NO(g)+2CO(g)═N2(g)+2CO2(g) △H
若①N2(g)+O2(g)═2NO(g) △H1=+180.5kJ·mol-1
②2CO(g)═2C(s)+O2(g) △H2=+221kJ·mol-1
③C(s)+O2(g)═CO2(g) △H3=﹣393.5kJ·mol-1
则△H=
(2)为了提高燃料的利用率,可以将甲醇设计为燃料电池,写出熔融K2CO3做电解质时,甲醇燃料电池的负极反应式:
(3)含有甲醇的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:
(4)机动车的尾气也是雾霾形成的原因之一。

①近几年有人提出在催化剂条件下,利用汽油中挥发出来的C3H6催化还原尾气中的NO气体生成三种无污染的物质。请写出该过程的化学方程式:
②电化学气敏传感器法是测定汽车尾气常用的方法之一。其中CO传感器的工作原理如上图所示,则对电极的电极反应式为
您最近一年使用:0次
名校
4 . 社会在飞速发展,环境问题也备受关注,如何减少污染,寻求清洁能源是现代学者研究的方向。
Ⅰ、为了模拟汽车尾气在催化转化器内的工作情况
(1)控制条件,让反应在恒容密闭容器中进行如下反应:2NO(g)+2CO(g) N2(g)+2CO2(g),用传感器测得不同时间NO和CO的浓度如下表:
N2(g)+2CO2(g),用传感器测得不同时间NO和CO的浓度如下表:
前2s内的平均反应速率v(N2)=_______
(2)用氨气催化氧化还原法脱硝(NOx)
①根据下图 (纵坐标是脱硝效率、横坐标为氨氮物质的量之比),判断提高脱硝效率的最佳条件是:___ 。

②已知: N2(g)+O2(g)=2NO(g)△H=+akJ/mol
N2(g)+3H2(g) 2NH3(g)△H=-bk/mol
2NH3(g)△H=-bk/mol
2H2(g)+O2(g)=2H2O(g)△H=-ckJ/mol其中a、b、c均为大于0。
则放热反应:4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g)△H=
4N2(g)+6H2O(g)△H=________ 。
Ⅱ、甲醇是一种很好的燃料
(1)在压强为0.1MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)⇌CH3OH(l) △H<0 。为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了下面的实验设计表中.
表中剩余的实验数据:n=________ ,m=________ .
(2)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。下列说法正确的是______________ (填序号)。
①电池放电时通入空气的电极为负极
②电池放电时,电解质溶液的碱性逐渐减弱
③电池放电时每消耗6.4 g CH3OH转移1.2 mol电子
④负极反应式为CH3OH+8OH--6e-=CO32-+6H2O
Ⅰ、为了模拟汽车尾气在催化转化器内的工作情况
(1)控制条件,让反应在恒容密闭容器中进行如下反应:2NO(g)+2CO(g)
 N2(g)+2CO2(g),用传感器测得不同时间NO和CO的浓度如下表:
N2(g)+2CO2(g),用传感器测得不同时间NO和CO的浓度如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)(10-3mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
(2)用氨气催化氧化还原法脱硝(NOx)
①根据下图 (纵坐标是脱硝效率、横坐标为氨氮物质的量之比),判断提高脱硝效率的最佳条件是:

②已知: N2(g)+O2(g)=2NO(g)△H=+akJ/mol
N2(g)+3H2(g)
 2NH3(g)△H=-bk/mol
2NH3(g)△H=-bk/mol2H2(g)+O2(g)=2H2O(g)△H=-ckJ/mol其中a、b、c均为大于0。
则放热反应:4NO(g)+4NH3(g)+O2(g)
 4N2(g)+6H2O(g)△H=
4N2(g)+6H2O(g)△H=Ⅱ、甲醇是一种很好的燃料
(1)在压强为0.1MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)⇌CH3OH(l) △H<0 。为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了下面的实验设计表中.
| 实验编号 | T(℃) | n(CO)/n(H2) | P(MPa) |
| ① | 180 | 2:3 | 0.1 |
| ② | n | 2:3 | 5 |
| ③ | 350 | m | 5 |
(2)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。下列说法正确的是
①电池放电时通入空气的电极为负极
②电池放电时,电解质溶液的碱性逐渐减弱
③电池放电时每消耗6.4 g CH3OH转移1.2 mol电子
④负极反应式为CH3OH+8OH--6e-=CO32-+6H2O
您最近一年使用:0次
名校
解题方法
5 . (1)氨气还原氮氧化物的反应为:
①N2(g)+O2(g)=2NO(g) △H1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H2
则4NH3(g)+6NO(g)=5N2(g)+6H2O(1) △H=___ 。(用含△H1、△H2的式子表示)
依据反应②,将氨气设计成燃料电池,用KOH溶液作电解质溶液,写出负极电极反应式:____ 。
(2)一定温度下,向2L恒容密闭容器中充4.0molNO2和4.0mol CO,在催化剂作用下发生反应4CO(g)+2NO2(g)⇌N2(g)+4CO2(g) △H<0,测得相关数据如表:
①0∼5min,用NO2的浓度变化表示的反应速率为______ 。
②以下表述能说明该反应已达到平衡状态的是_____ 。
A.2v(NO2)正=v(N2)逆 B.气体密度不再变化
C.气体平均相对分子质量不再变化 D.N2与CO2的物质的量之比保持不变
③20min时,保持温度不变,继续向该容器中加入1.0molNO2和1.0molCO,反应再次达到平衡时,NO2的转化率比原平衡___ (填“增大”、“减小”或“不变)。
④该温度下反应的化学平衡常数K=____ 。
(3)湿法脱硝:采用NaClO2溶液作为吸收剂可对烟气进行脱硝。323K下,向足量碱性NaClO2溶液中通入含NO的烟气,充分反应后,溶液中离子浓度的分析结果如表:
①NaClO2溶液显碱性,用离子方程式解释原因_____ 。
②依据表中数据,写出NaClO2溶液脱硝过程中发生总反应的离子方程式_____
①N2(g)+O2(g)=2NO(g) △H1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H2
则4NH3(g)+6NO(g)=5N2(g)+6H2O(1) △H=
依据反应②,将氨气设计成燃料电池,用KOH溶液作电解质溶液,写出负极电极反应式:
(2)一定温度下,向2L恒容密闭容器中充4.0molNO2和4.0mol CO,在催化剂作用下发生反应4CO(g)+2NO2(g)⇌N2(g)+4CO2(g) △H<0,测得相关数据如表:
| 0min | 5min | 10min | 15min | 20min | |
| c(NO2)/mol⋅L−1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
| c(N2)/mol⋅L−1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①0∼5min,用NO2的浓度变化表示的反应速率为
②以下表述能说明该反应已达到平衡状态的是
A.2v(NO2)正=v(N2)逆 B.气体密度不再变化
C.气体平均相对分子质量不再变化 D.N2与CO2的物质的量之比保持不变
③20min时,保持温度不变,继续向该容器中加入1.0molNO2和1.0molCO,反应再次达到平衡时,NO2的转化率比原平衡
④该温度下反应的化学平衡常数K=
(3)湿法脱硝:采用NaClO2溶液作为吸收剂可对烟气进行脱硝。323K下,向足量碱性NaClO2溶液中通入含NO的烟气,充分反应后,溶液中离子浓度的分析结果如表:
| 离子 | NO3− | NO2− | Cl− |
| c/(mol⋅L−1) | 2.0×10−4 | 1.0×10−4 | 1.75×10−4 |
①NaClO2溶液显碱性,用离子方程式解释原因
②依据表中数据,写出NaClO2溶液脱硝过程中发生总反应的离子方程式
您最近一年使用:0次
名校
解题方法
6 . 碳、氮、硫的化合物在生产生活中广泛存在。请回答:
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-l59.5kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) ΔH=-160.5kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式__ 。
(2)T温度时在容积为2L的恒容密闭容器中只充入1.00molNO2气体发生反应:2NO(g)+O2(g) 2NO2(g) ∆H<0。不同时刻测得容器中n(NO2)如下表:
2NO2(g) ∆H<0。不同时刻测得容器中n(NO2)如下表:
①升高温度K值___ (增大、减小),T温度时化学平衡常数K=___ mol-1·L
②从0~2s该反应的平均速率v(NO2)=___ 。
③对可逆反应2NO(g)+O2(g) 2NO2(g) ∆H<0。恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是
2NO2(g) ∆H<0。恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是___ 。
A.混合气体的密度不再变化
B.混合气体的压强不再变化
C.氧气的转化率不再变化
D.N2、O2、NO的物质的量之比为1:1:2
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是___ (写出主要反应的离子方程式),该溶液中,c(Na+)___ 2c(SO32-)+c(HSO3-)(填“>”“<”或“=”)。
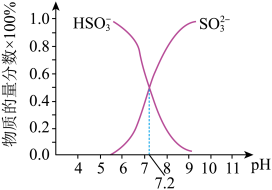
②在某NaHSO3、Na2SO3混合溶液中HSO3-、SO32-物质的量分数随pH变化曲线如图所示(部分),根据图示,则SO32-的第一步水解平衡常数=____ 。
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-l59.5kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) ΔH=-160.5kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式
(2)T温度时在容积为2L的恒容密闭容器中只充入1.00molNO2气体发生反应:2NO(g)+O2(g)
 2NO2(g) ∆H<0。不同时刻测得容器中n(NO2)如下表:
2NO2(g) ∆H<0。不同时刻测得容器中n(NO2)如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO2)/mol | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
①升高温度K值
②从0~2s该反应的平均速率v(NO2)=
③对可逆反应2NO(g)+O2(g)
 2NO2(g) ∆H<0。恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是
2NO2(g) ∆H<0。恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是A.混合气体的密度不再变化
B.混合气体的压强不再变化
C.氧气的转化率不再变化
D.N2、O2、NO的物质的量之比为1:1:2
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是
②在某NaHSO3、Na2SO3混合溶液中HSO3-、SO32-物质的量分数随pH变化曲线如图所示(部分),根据图示,则SO32-的第一步水解平衡常数=

您最近一年使用:0次
2020-04-30更新
|
73次组卷
|
2卷引用:吉林省长春市第二十九中学2020届高三上学期期末考试化学试题
名校
解题方法
7 . 高炉煤气是炼铁厂排放的尾气,含有H2、N2、CO、CO2及O2,其中N2约为55%、CO约为25%、CO2约为15%、O2约为1.64% (均为体积分数)。某科研小组对尾气的应用展开研究:
I.直接作燃料
已知:C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
2C(s)+O2(g)=2CO (g) △H=-221kJ/mol
(1)CO燃烧热的热化学方程式为____________________________________________________________________________ 。
II.生产合成氨的原料
高炉煤气经过下列步骤可转化为合成氨的原料气:

在脱氧过程中仅吸收了O2;交换过程中发生的反应如下,这两个反应均为吸热反应:CO2+CH4 CO+H2CO+H2O
CO+H2CO+H2O CO2+ H2
CO2+ H2
(2)气体通过微波催化交换炉需要较高温度,试根据该反应特征,解释采用较高温度的原因:____________________________________________________________________________ 。
(3)通过铜催化交换炉后,所得气体中V(H2):V(N2)=______________ 。
III.合成氨后的气体应用研究
(4)氨气可用于生产硝酸,该过程中会产生大气污染物NOx。为了研究对NOx的治理,该科研小组在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2,发生如下反应:2NO(g)+Cl2(g) 2ClNO(g) △H<0。10min时反应达平衡,测得10min内v (ClNO)=7.5
2ClNO(g) △H<0。10min时反应达平衡,测得10min内v (ClNO)=7.5 10-3mol/(L·min),则平衡后n(Cl2)=
10-3mol/(L·min),则平衡后n(Cl2)=_________ mol。
设此时NO的转化率为α1,若其它条件不变,上述反应在恒压条件下进行,平衡时NO的转化率为α2,则α1____ α2(填“>”、“<”或“=”);平衡常数K____ (填增大”“减小”或“不变”)
(5)氨气还可用于制备NCl3,NCl3发生水解产物之一具有强氧化性,该水解产物能将稀盐酸中的NaClO2氧化成ClO2,该反应的离子方程式为_____________________________ 。
I.直接作燃料
已知:C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
2C(s)+O2(g)=2CO (g) △H=-221kJ/mol
(1)CO燃烧热的热化学方程式为
II.生产合成氨的原料
高炉煤气经过下列步骤可转化为合成氨的原料气:

在脱氧过程中仅吸收了O2;交换过程中发生的反应如下,这两个反应均为吸热反应:CO2+CH4
 CO+H2CO+H2O
CO+H2CO+H2O CO2+ H2
CO2+ H2(2)气体通过微波催化交换炉需要较高温度,试根据该反应特征,解释采用较高温度的原因:
(3)通过铜催化交换炉后,所得气体中V(H2):V(N2)=
III.合成氨后的气体应用研究
(4)氨气可用于生产硝酸,该过程中会产生大气污染物NOx。为了研究对NOx的治理,该科研小组在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2,发生如下反应:2NO(g)+Cl2(g)
 2ClNO(g) △H<0。10min时反应达平衡,测得10min内v (ClNO)=7.5
2ClNO(g) △H<0。10min时反应达平衡,测得10min内v (ClNO)=7.5 10-3mol/(L·min),则平衡后n(Cl2)=
10-3mol/(L·min),则平衡后n(Cl2)=设此时NO的转化率为α1,若其它条件不变,上述反应在恒压条件下进行,平衡时NO的转化率为α2,则α1
(5)氨气还可用于制备NCl3,NCl3发生水解产物之一具有强氧化性,该水解产物能将稀盐酸中的NaClO2氧化成ClO2,该反应的离子方程式为
您最近一年使用:0次
2018-01-15更新
|
385次组卷
|
2卷引用:黑龙江省哈尔滨市第三中学2018届高三第四次测试(期末)理综化学试题
解题方法
8 . 化工行业的发展必须符合国家节能减排的总体要求。请回答下列问题:
(1)已知C(s)+H2O(g) CO(g)+H2(g),则该反应的平衡常数表达式为
CO(g)+H2(g),则该反应的平衡常数表达式为_______ 。
(2)已知在一定温度下,
C(s)+CO2(g) 2CO(g) △H1
2CO(g) △H1
CO(g)+H2O(g) H2(g)+CO2(g) △H2
H2(g)+CO2(g) △H2
C(s)+H2O(g) CO(g)+H2(g) △H3
CO(g)+H2(g) △H3
则△H1、△H2、△H3之间的关系是:_____________ 。
(3)通过研究不同温度下平衡常数可以解决某些实际问题。已知等体积的一氧化碳和水蒸气进入反应时,会发生如下反应: CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示。
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示。
则该反应的正反应方向是_______ 反应(填“吸热”或“放热”),在500℃时,若设起始时CO和H2O的起始浓度均为0.020mol/L,则CO的平衡转化率为_________ 。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对反应N2O4(g) 2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是_________ :
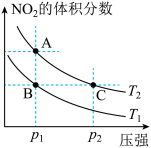
A. A、C两点的反应速率:A>C
B. A、C两点气体的颜色:A深,C浅
C. A、C两点的气体的平均相对分子质量:A<C
D.由状态A到状态B,可以用加热的方法
E.A、C两点的化学平衡常数:A=C
(5)某小组利用H2C2O4溶液和硫酸酸化的KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性KMnO4溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:
①表中V1=______ mL
②探究温度对化学反应速率影响的实验编号是_____ (填编号)
③KMnO4溶液与H2C2O4溶液反应的离子方程式_________
④实验③测得KMnO4溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=___ mol·L-1·min-1。
(1)已知C(s)+H2O(g)
 CO(g)+H2(g),则该反应的平衡常数表达式为
CO(g)+H2(g),则该反应的平衡常数表达式为(2)已知在一定温度下,
C(s)+CO2(g)
 2CO(g) △H1
2CO(g) △H1CO(g)+H2O(g)
 H2(g)+CO2(g) △H2
H2(g)+CO2(g) △H2C(s)+H2O(g)
 CO(g)+H2(g) △H3
CO(g)+H2(g) △H3则△H1、△H2、△H3之间的关系是:
(3)通过研究不同温度下平衡常数可以解决某些实际问题。已知等体积的一氧化碳和水蒸气进入反应时,会发生如下反应: CO(g)+H2O(g)
 H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示。
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示。| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
则该反应的正反应方向是
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对反应N2O4(g)
 2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
A. A、C两点的反应速率:A>C
B. A、C两点气体的颜色:A深,C浅
C. A、C两点的气体的平均相对分子质量:A<C
D.由状态A到状态B,可以用加热的方法
E.A、C两点的化学平衡常数:A=C
(5)某小组利用H2C2O4溶液和硫酸酸化的KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性KMnO4溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:
| 实验 编号 | 0.1mol/L酸性KMnO4溶液的体积/mL | 0.6mol/LH2C2O4溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液褪色所需时间/min |
| ① | 10 | V1 | 35 | 25 | |
| ② | 10 | 10 | 30 | 25 | |
| ③ | 10 | 10 | V2 | 50 |
①表中V1=
②探究温度对化学反应速率影响的实验编号是
③KMnO4溶液与H2C2O4溶液反应的离子方程式
④实验③测得KMnO4溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=
您最近一年使用:0次
名校
9 . 氮及其化合物与人类各方面有着密切的联系。目前,消除氮氧化物污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
③H2O(g)= H2O(l) △H=-44kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g) 、CO2(g)和H2O ( l ) 的热化学方程式____________________ 。
(2)用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g)⇌N2(g)+CO2(g)。
某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下:
①不能作为判断反应达到化学平衡状态的依据是_______ ;(选填字母代号)
A.容器内CO2的浓度保持不变 B.容器内压强保持不变
C.单位时间内生成NA个N2,同时生成2NA个NO
D.混合气体的密度保持不变 E.混合气体的平均相对分子质量保持不变
②前20分钟,平均反应速率v(NO)=_________________ 。
③在T0C时,该反应的平衡常数表达式为_______________________________ ;
④在30 min,改变某一条件反应重新达到平衡,则改变的条件是______________________________ 。
(3)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为:

2NO+2CO 2CO2+N2 ΔH<0。
2CO2+N2 ΔH<0。
如图P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1mol NO(g)和2mol(g)CO,向B容器中充入1.2 mol NO(g)和2.4 mol(g) CO。已知起始时容器A和B的体积均为a L,反应到到平衡时容器B的体积为0.9 a L,容器B中NO的转化率为_____________ ;
(4)亚硝酸(HNO2)是弱酸电离平衡常数 Ka=5.0×10 -4(298K), NH3.H2O的电离平衡常数为
K=2.0×10 -5常温下,用氨水吸收亚硝酸可得到NH4NO2,NH4NO2溶液显_____ (填“酸性”“中性”或“碱性”);请计算NH4+ + NO2- + H2O⇌HNO2 + NH3.H2O的平衡常数K =_________ 。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
③H2O(g)= H2O(l) △H=-44kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g) 、CO2(g)和H2O ( l ) 的热化学方程式
(2)用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g)⇌N2(g)+CO2(g)。
某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下:

①不能作为判断反应达到化学平衡状态的依据是
A.容器内CO2的浓度保持不变 B.容器内压强保持不变
C.单位时间内生成NA个N2,同时生成2NA个NO
D.混合气体的密度保持不变 E.混合气体的平均相对分子质量保持不变
②前20分钟,平均反应速率v(NO)=
③在T0C时,该反应的平衡常数表达式为
④在30 min,改变某一条件反应重新达到平衡,则改变的条件是
(3)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为:

2NO+2CO
 2CO2+N2 ΔH<0。
2CO2+N2 ΔH<0。如图P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1mol NO(g)和2mol(g)CO,向B容器中充入1.2 mol NO(g)和2.4 mol(g) CO。已知起始时容器A和B的体积均为a L,反应到到平衡时容器B的体积为0.9 a L,容器B中NO的转化率为
(4)亚硝酸(HNO2)是弱酸电离平衡常数 Ka=5.0×10 -4(298K), NH3.H2O的电离平衡常数为
K=2.0×10 -5常温下,用氨水吸收亚硝酸可得到NH4NO2,NH4NO2溶液显
您最近一年使用:0次
名校
10 . 乙烯的分子式为C2H4,是一种重要的化工原料和清洁能源,研究乙烯的制备和综合利用具有重要意义。请回答下列问题:
(1)乙烯的制备:工业上常利用反应C2H6(g) C2H4(g)+H2(g) △H制备乙烯。
C2H4(g)+H2(g) △H制备乙烯。
已知:Ⅰ.C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) △H1=-1556.8kJ·mol-1;
Ⅱ.H2(g)+ O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
Ⅲ.C2H6(g)+ O2(g)=2CO2(g)+3H2O(l) △H3=-1559.9kJ·mol-1。
O2(g)=2CO2(g)+3H2O(l) △H3=-1559.9kJ·mol-1。
则△H=___ kJ·mol-1。
(2)乙烯可用于制备乙醇:C2H4(g)+H2O(g) C2H5OH(g)。向某恒容密闭容器中充入a mol C2H4(g)和 a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:
C2H5OH(g)。向某恒容密闭容器中充入a mol C2H4(g)和 a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:

①该反应为____ 热反应(填“吸”或“放”),理由为____ 。
②A点时容器中气体的总物质的量为____ 。已知分压=总压×气体物质的量分数,用气体分压替代浓度计算的平衡常数叫压强平衡常数(KP),测得300℃时,反应达到平衡时该容器内的压强为b MPa,则A点对应温度下的KP=____ MPa-1(用含b的分数表示)。
③已知:C2H4(g)+H2O(g) C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是
C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是___ (填选项字母)。
A.k正增大,k逆减小 B.k正减小,k逆增大
C.k正增大的倍数大于k逆 D.k正增大的倍数小于k逆
④若保持其他条件不变,将容器改为恒压密闭容器,则300℃时,C2H4(g)的平衡转化率__ 10%(填“>”“<”或“=”)。
(3)乙烯可以被氧化为乙醛(CH3CHO),电解乙醛的酸性水溶液可以制备出乙醇和乙酸,则生成乙酸的电极为_____ 极(填“阴”或“阳”),对应的电极反应式为___ 。
(1)乙烯的制备:工业上常利用反应C2H6(g)
 C2H4(g)+H2(g) △H制备乙烯。
C2H4(g)+H2(g) △H制备乙烯。已知:Ⅰ.C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) △H1=-1556.8kJ·mol-1;
Ⅱ.H2(g)+
 O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
O2(g)=H2O(1) △H2=-285.5kJ·mol-1;Ⅲ.C2H6(g)+
 O2(g)=2CO2(g)+3H2O(l) △H3=-1559.9kJ·mol-1。
O2(g)=2CO2(g)+3H2O(l) △H3=-1559.9kJ·mol-1。则△H=
(2)乙烯可用于制备乙醇:C2H4(g)+H2O(g)
 C2H5OH(g)。向某恒容密闭容器中充入a mol C2H4(g)和 a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:
C2H5OH(g)。向某恒容密闭容器中充入a mol C2H4(g)和 a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:
①该反应为
②A点时容器中气体的总物质的量为
③已知:C2H4(g)+H2O(g)
 C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是
C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是A.k正增大,k逆减小 B.k正减小,k逆增大
C.k正增大的倍数大于k逆 D.k正增大的倍数小于k逆
④若保持其他条件不变,将容器改为恒压密闭容器,则300℃时,C2H4(g)的平衡转化率
(3)乙烯可以被氧化为乙醛(CH3CHO),电解乙醛的酸性水溶液可以制备出乙醇和乙酸,则生成乙酸的电极为
您最近一年使用:0次
2019-09-17更新
|
793次组卷
|
6卷引用:黑龙江省大庆铁人中学2020届高三考前模拟训练(一)理科综合化学试题
黑龙江省大庆铁人中学2020届高三考前模拟训练(一)理科综合化学试题河南省顶级名校2020届高三上学期开学摸底考试化学试题辽宁省凤城市第一中学2020届高三12月月考化学试题山东省日照一中2020届高三新高考3月份自测化学试题宁夏石嘴山市第三中学2020届高三一模考试理综化学试题(已下线)《2020年新高考政策解读与配套资源》2020年山东新高考化学全真模拟卷(二)



