2010·宁夏银川·一模
1 . 运用化学反应原理研究碳的氧化物的性质具有重要意义。
(1)CO2是一种重要的物质,但其过量排放,可能导致全球气温升高。下列措施不能够有效控制CO2所导致的温室效应的是___________ (填序号)
①大力发展低碳产业,提倡低碳生活,依法控制CO2的过量排放
②禁止滥砍滥伐,植树造林,恢复生态
③开发利用各种新型能源代替煤、石油、天然气等化石能源
④提倡使用脱硫煤、无铅汽油等清洁燃料
(2)常温下,碳酸在水中的电离常数Ka1=4.2×10-7,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka=4.7×10-8.写出84消毒液露置在空气中发生反应的离子方程式___________ 。
(3)CO具有还原性,某同学设计图示装置(固定装置及胶管略去)验证CO气体能否与Na2O2反应。

已知:H2C2O4 CO2↑+CO↑+H2O,则实验选择的最简单的装置接口连接顺序为
CO2↑+CO↑+H2O,则实验选择的最简单的装置接口连接顺序为___________ ;若CO能够与Na2O2发生反应,则预测反应产物为___________ 。实验后用球形干燥管中的固体进行验证可选择的试剂是___________ 。
(4)已知C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1;CO(g)+ O2(g)=CO2(g) ΔH=-283.0kJ·mol-1,写出CO2和C(s)反应的热化学方程式
O2(g)=CO2(g) ΔH=-283.0kJ·mol-1,写出CO2和C(s)反应的热化学方程式___________ 。以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸盐,放电时负极反应式为___________ 。若使用该电池电解饱和食盐水制取1molNaClO,则理论上需要氧气的体积为(标准状况下)___________ L。
(1)CO2是一种重要的物质,但其过量排放,可能导致全球气温升高。下列措施不能够有效控制CO2所导致的温室效应的是
①大力发展低碳产业,提倡低碳生活,依法控制CO2的过量排放
②禁止滥砍滥伐,植树造林,恢复生态
③开发利用各种新型能源代替煤、石油、天然气等化石能源
④提倡使用脱硫煤、无铅汽油等清洁燃料
(2)常温下,碳酸在水中的电离常数Ka1=4.2×10-7,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka=4.7×10-8.写出84消毒液露置在空气中发生反应的离子方程式
(3)CO具有还原性,某同学设计图示装置(固定装置及胶管略去)验证CO气体能否与Na2O2反应。

已知:H2C2O4
 CO2↑+CO↑+H2O,则实验选择的最简单的装置接口连接顺序为
CO2↑+CO↑+H2O,则实验选择的最简单的装置接口连接顺序为(4)已知C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1;CO(g)+
 O2(g)=CO2(g) ΔH=-283.0kJ·mol-1,写出CO2和C(s)反应的热化学方程式
O2(g)=CO2(g) ΔH=-283.0kJ·mol-1,写出CO2和C(s)反应的热化学方程式
您最近一年使用:0次
名校
2 . (1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为__________ 、_______ 。
(2)用甲烷制取氢气的两步反应的能量变化如下图所示:
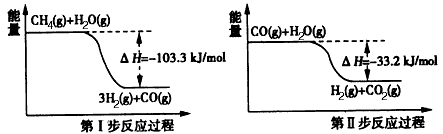
甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是________________ 。
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5KJ/mol
②NH2CO2NH4(s)= CO(NH2)2(s) +H2O(g) △H=+116.5KJ/mol
③H2O(l)=H2O(g) △H=+44KJ/mol
写出CO2与NH3合成尿素和液态水的热化学方程式__________________ 。
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为_________________ 。
(2)用甲烷制取氢气的两步反应的能量变化如下图所示:

甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5KJ/mol
②NH2CO2NH4(s)= CO(NH2)2(s) +H2O(g) △H=+116.5KJ/mol
③H2O(l)=H2O(g) △H=+44KJ/mol
写出CO2与NH3合成尿素和液态水的热化学方程式
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为
您最近一年使用:0次
2017-09-07更新
|
205次组卷
|
2卷引用:宁夏银川市六盘山高级中学2017-2018学年高二上学期第一次月考化学试题
名校
3 . 丙烯(C3H6)用以生产合成树脂、合成橡胶及多种精细化学品等多种重要有机化工原料。丙烷直接脱氢制丙烯发生的主要反应及能量变化如图1所示。
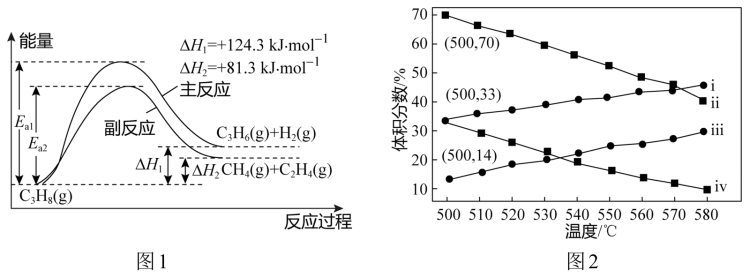
已知:丙烷直接脱氢制丙烯必须在高温下进行,但温度越高副反应进行程度越大,同时还会降低催化剂的活性和选择性。
回答下列问题:
(1)为提供反应所需热量,若恒压时向原料气中掺入高温水蒸气,则主反应的平衡常数K_____ (填“增大”、“减小”或“不变”)。温度升高,副反应更容易发生的主要原因是__________ 。
(2)图2为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分别为1×104 Pa和1×105 Pa)。
①1×104 Pa时,图2中表示丙烯的曲线是________ (填“ⅰ”、“ⅱ”、“ⅲ”或“ⅳ”)。
②1×105Pa、500℃时,若只发生上述主反应和副反应,则达平衡时,丙烷转化为丙烯的转化率为_____ 。
(3)为克服丙烷直接脱氢法的缺点,科学家探索出在相对适中的温度下,在无机膜反应器中进行丙烷脱氢制丙烯的技术。在膜反应器中,利用特定功能膜将生成的氢气从反应区一侧有选择性地及时移走。与丙烷直接脱氢法相比,该方法的优点是______ 。
(4)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图3。已知: CO和H2的燃烧热分别为△H=﹣283.0 kJ/mol、△H=﹣285.8 kJ/mol。
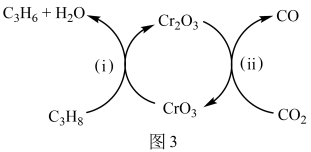
①反应(i)的化学方程式为___________ 。
②25℃时,该工艺总反应的热化学方程式为____________ 。
③该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是______ 。

已知:丙烷直接脱氢制丙烯必须在高温下进行,但温度越高副反应进行程度越大,同时还会降低催化剂的活性和选择性。
回答下列问题:
(1)为提供反应所需热量,若恒压时向原料气中掺入高温水蒸气,则主反应的平衡常数K
(2)图2为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分别为1×104 Pa和1×105 Pa)。
①1×104 Pa时,图2中表示丙烯的曲线是
②1×105Pa、500℃时,若只发生上述主反应和副反应,则达平衡时,丙烷转化为丙烯的转化率为
(3)为克服丙烷直接脱氢法的缺点,科学家探索出在相对适中的温度下,在无机膜反应器中进行丙烷脱氢制丙烯的技术。在膜反应器中,利用特定功能膜将生成的氢气从反应区一侧有选择性地及时移走。与丙烷直接脱氢法相比,该方法的优点是
(4)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图3。已知: CO和H2的燃烧热分别为△H=﹣283.0 kJ/mol、△H=﹣285.8 kJ/mol。

①反应(i)的化学方程式为
②25℃时,该工艺总反应的热化学方程式为
③该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是
您最近一年使用:0次
名校
4 . 乙烯的分子式为C2H4,是一种重要的化工原料和清洁能源,研究乙烯的制备和综合利用具有重要意义。请回答下列问题:
(1)乙烯的制备:工业上常利用反应C2H6(g) C2H4(g)+H2(g) △H制备乙烯。
C2H4(g)+H2(g) △H制备乙烯。
已知:Ⅰ.C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) △H1=-1556.8kJ·mol-1;
Ⅱ.H2(g)+ O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
Ⅲ.C2H6(g)+ O2(g)=2CO2(g)+3H2O(l) △H3=-1559.9kJ·mol-1。
O2(g)=2CO2(g)+3H2O(l) △H3=-1559.9kJ·mol-1。
则△H=___ kJ·mol-1。
(2)乙烯可用于制备乙醇:C2H4(g)+H2O(g) C2H5OH(g)。向某恒容密闭容器中充入a mol C2H4(g)和 a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:
C2H5OH(g)。向某恒容密闭容器中充入a mol C2H4(g)和 a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:

①该反应为____ 热反应(填“吸”或“放”),理由为____ 。
②A点时容器中气体的总物质的量为____ 。已知分压=总压×气体物质的量分数,用气体分压替代浓度计算的平衡常数叫压强平衡常数(KP),测得300℃时,反应达到平衡时该容器内的压强为b MPa,则A点对应温度下的KP=____ MPa-1(用含b的分数表示)。
③已知:C2H4(g)+H2O(g) C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是
C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是___ (填选项字母)。
A.k正增大,k逆减小 B.k正减小,k逆增大
C.k正增大的倍数大于k逆 D.k正增大的倍数小于k逆
④若保持其他条件不变,将容器改为恒压密闭容器,则300℃时,C2H4(g)的平衡转化率__ 10%(填“>”“<”或“=”)。
(3)乙烯可以被氧化为乙醛(CH3CHO),电解乙醛的酸性水溶液可以制备出乙醇和乙酸,则生成乙酸的电极为_____ 极(填“阴”或“阳”),对应的电极反应式为___ 。
(1)乙烯的制备:工业上常利用反应C2H6(g)
 C2H4(g)+H2(g) △H制备乙烯。
C2H4(g)+H2(g) △H制备乙烯。已知:Ⅰ.C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) △H1=-1556.8kJ·mol-1;
Ⅱ.H2(g)+
 O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
O2(g)=H2O(1) △H2=-285.5kJ·mol-1;Ⅲ.C2H6(g)+
 O2(g)=2CO2(g)+3H2O(l) △H3=-1559.9kJ·mol-1。
O2(g)=2CO2(g)+3H2O(l) △H3=-1559.9kJ·mol-1。则△H=
(2)乙烯可用于制备乙醇:C2H4(g)+H2O(g)
 C2H5OH(g)。向某恒容密闭容器中充入a mol C2H4(g)和 a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:
C2H5OH(g)。向某恒容密闭容器中充入a mol C2H4(g)和 a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:
①该反应为
②A点时容器中气体的总物质的量为
③已知:C2H4(g)+H2O(g)
 C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是
C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是A.k正增大,k逆减小 B.k正减小,k逆增大
C.k正增大的倍数大于k逆 D.k正增大的倍数小于k逆
④若保持其他条件不变,将容器改为恒压密闭容器,则300℃时,C2H4(g)的平衡转化率
(3)乙烯可以被氧化为乙醛(CH3CHO),电解乙醛的酸性水溶液可以制备出乙醇和乙酸,则生成乙酸的电极为
您最近一年使用:0次
2019-09-17更新
|
793次组卷
|
6卷引用:宁夏石嘴山市第三中学2020届高三一模考试理综化学试题
宁夏石嘴山市第三中学2020届高三一模考试理综化学试题河南省顶级名校2020届高三上学期开学摸底考试化学试题辽宁省凤城市第一中学2020届高三12月月考化学试题山东省日照一中2020届高三新高考3月份自测化学试题(已下线)《2020年新高考政策解读与配套资源》2020年山东新高考化学全真模拟卷(二)黑龙江省大庆铁人中学2020届高三考前模拟训练(一)理科综合化学试题



