名校
解题方法
1 . 绿水青山是习总书记构建美丽中国的伟大设想,研究碳、氮、硫等大气污染物和水污染物的处理对建设美丽中国有重要意义。
(1)汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①2NO(g)+O2(g)=2NO2(g) ΔH1=-112.4 kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) ΔH2=-234 kJ·mol-1
③N2(g)+O2(g)=2NO(g) ΔH3=+179.2 kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式_______________________ 。
(2)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g) N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
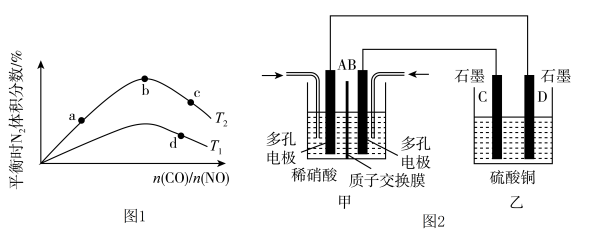
①b点时,平衡体系中C、N原子个数之比接近________________ ;
②a、b、c三点CO的转化率从大到小的顺序为_____________________ ;
③a、c、d三点的平衡常数从大到小的顺序为_________________ 。
④若n(CO)/n(NO)=0.8,反应达平衡时,N2的体积分数为25%,则CO的转化率为________ 。
(3)若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极的电极反应式为___________________ 。
(4)已知:25 ℃时,H2C2O4的电离常数Ka1=5.9×10-2,Ka2=6.4×10-5,25 ℃时,0.1 mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为________________________ ,若向该溶液中加入一定量NaOH固体,使c(HC2O4- )=c(C2O42- ),则此时溶液呈________ (填“酸性”“碱性”或“中性”)。
(1)汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①2NO(g)+O2(g)=2NO2(g) ΔH1=-112.4 kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) ΔH2=-234 kJ·mol-1
③N2(g)+O2(g)=2NO(g) ΔH3=+179.2 kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式
(2)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)
 N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
①b点时,平衡体系中C、N原子个数之比接近
②a、b、c三点CO的转化率从大到小的顺序为
③a、c、d三点的平衡常数从大到小的顺序为
④若n(CO)/n(NO)=0.8,反应达平衡时,N2的体积分数为25%,则CO的转化率为
(3)若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极的电极反应式为
(4)已知:25 ℃时,H2C2O4的电离常数Ka1=5.9×10-2,Ka2=6.4×10-5,25 ℃时,0.1 mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为
您最近一年使用:0次
解题方法
2 . (I)A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
(1)若B是淡黄色固体,②③反应均用到同一种液态氢化物。D物质常用于食品工业。写出④反应的化学方程式___________________________ 。
(2)若B是气态氢化物。C、D是氧化物且会造成光化学烟雾污染。写出③反应的化学方程式______________ 。
(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出④反应离子方程式________________________ 。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式________________________ 。
(5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。写出④反应的离子方程式______________________________________________ 。
(II)在温度相同、体积均为1 L的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。已知:2SO2(g)+O2(g) 2SO3(g) ΔH =-98.3kJ·mol-1。
2SO3(g) ΔH =-98.3kJ·mol-1。
则:α1+α2=_________________ ,p=________________ mol,b+c="_______________ kJ" 。
(III)HA、H2B、H3C三种弱酸,根据“较强酸+较弱酸盐=较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:A.HA+HC2-(少量)=A-+H2C- B.H2B(少量)+2A-=B2-+2HA
C.H2B(少量)+H2C-=HB-+H3C
回答下列问题:
(1)相同条件下,HA、H2B、H3C三种酸中,酸性最强的是_____________ 。
(2)A-、B2-、C3-、HB-、H2C-、HC2-六种离子中,最易结合质子(H+)的是_________ ,最难结合质子的是____________ 。
(3)完成下列反应的离子方程式HA(过量)+C3-:________________________________ 。
(IV)在25下,将a mol/L的氨水与0.01 mol/L的盐酸等体积混合,反应平衡时溶液中c(NH4+) = c(Cl-),则溶液显______________ (填“酸”、“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离常数Kb=_____________ 。

(1)若B是淡黄色固体,②③反应均用到同一种液态氢化物。D物质常用于食品工业。写出④反应的化学方程式
(2)若B是气态氢化物。C、D是氧化物且会造成光化学烟雾污染。写出③反应的化学方程式
(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出④反应离子方程式
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式
(5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。写出④反应的离子方程式
(II)在温度相同、体积均为1 L的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。已知:2SO2(g)+O2(g)
 2SO3(g) ΔH =-98.3kJ·mol-1。
2SO3(g) ΔH =-98.3kJ·mol-1。| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2 mol SO2、1 mol O2 | 2 mol SO3 | m mol SO2、n mol O2、p mol SO3 |
| c(SO3) /mol·L-1 | 1.4 | 1.4 | 1.4 |
| 能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| SO2或SO3的转化率 | α1 | α2 | 12.5% |
则:α1+α2=
(III)HA、H2B、H3C三种弱酸,根据“较强酸+较弱酸盐=较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:A.HA+HC2-(少量)=A-+H2C- B.H2B(少量)+2A-=B2-+2HA
C.H2B(少量)+H2C-=HB-+H3C
回答下列问题:
(1)相同条件下,HA、H2B、H3C三种酸中,酸性最强的是
(2)A-、B2-、C3-、HB-、H2C-、HC2-六种离子中,最易结合质子(H+)的是
(3)完成下列反应的离子方程式HA(过量)+C3-:
(IV)在25下,将a mol/L的氨水与0.01 mol/L的盐酸等体积混合,反应平衡时溶液中c(NH4+) = c(Cl-),则溶液显
您最近一年使用:0次
名校
解题方法
3 . 氢气在工业合成中广泛应用。
(1)通过下列反应可以制备甲醇:
CO(g)+2H2(g) CH3OH(g) ΔH=-90.8kJ/mol,
CH3OH(g) ΔH=-90.8kJ/mol,
CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41.3kJ/mol
CO(g)+H2O(g) ΔH=+41.3kJ/mol
请写出由CO2和H2制取甲醇的热化学方程式______________ 。
(2)已知合成氨的反应为:N2+3H2 2NH3 △H<0。某温度度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:
2NH3 △H<0。某温度度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:
①图中代表反应在恒容绝热容器中进行的曲线是________ (用a、b、c表示)。
②曲线a条件下该反应的平衡常数K=_____________ 。
③b容器中M点,v(正)________ v(逆)(填“大于”、“小于”或“等于”)。
(3)利用氨气可以设计成高能环保燃料电池,用该电池电解含有NO2-的碱性工业废水,在阴极产生N2。阴极电极反应式为________ ;标准状况下,当阴极收集到11.2LN2时,理论上消耗NH3的体积为_____________ 。
(4)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中c(NH4+)____ c(HCO3-) (填“>”、“<”或“=”);反应NH4++HCO3-+H2O NH3•H2O+H2CO3的平衡常数K=
NH3•H2O+H2CO3的平衡常数K=_______ 。
(已知常温下NH3•H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7, K2=4×10-11)
(1)通过下列反应可以制备甲醇:
CO(g)+2H2(g)
 CH3OH(g) ΔH=-90.8kJ/mol,
CH3OH(g) ΔH=-90.8kJ/mol,CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH=+41.3kJ/mol
CO(g)+H2O(g) ΔH=+41.3kJ/mol请写出由CO2和H2制取甲醇的热化学方程式
(2)已知合成氨的反应为:N2+3H2
 2NH3 △H<0。某温度度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:
2NH3 △H<0。某温度度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题: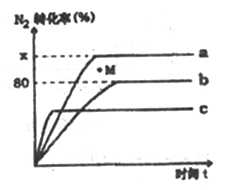
①图中代表反应在恒容绝热容器中进行的曲线是
②曲线a条件下该反应的平衡常数K=
③b容器中M点,v(正)
(3)利用氨气可以设计成高能环保燃料电池,用该电池电解含有NO2-的碱性工业废水,在阴极产生N2。阴极电极反应式为
(4)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中c(NH4+)
 NH3•H2O+H2CO3的平衡常数K=
NH3•H2O+H2CO3的平衡常数K=(已知常温下NH3•H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7, K2=4×10-11)
您最近一年使用:0次
2017-04-23更新
|
593次组卷
|
2卷引用:2017届辽宁省部分重点中学协作体高三考前模拟考试理综化学试卷
解题方法
4 . 苯乙烯是工业上是合成树脂、离子交换树脂及合成橡胶等的重要单体,工业上可用乙苯催化脱氢方法制备苯乙烯: (g)
(g) (g)+H2(g) △H=+QkJ·mol-1
(g)+H2(g) △H=+QkJ·mol-1
请回答下列问题:
(1)已知乙苯(g)、苯乙烯(g)的燃烧热分别为a kJ·mol-1、bkJ·mol-1,则氢气的燃烧热为_____ kJ·mol-1(用含有Q、b、c的表达式表示,其中Q、b、c均大于0)。
(2)673 K时,在一恒容密闭容器中充入5 mol乙苯(g),反应达到平衡后容器内气体的压强为p1;若再充入amol的乙苯(g),重新达到平衡后容器内气体的压强为2p1,则a____________ 5。
(3)在实际生产中,在恒压条件下常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),此时乙苯的平衡转化率与水蒸气的用量、压强(p)的关系如图所示。
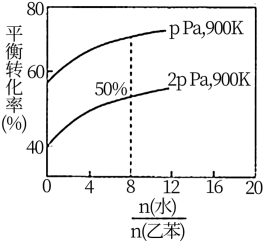
①加入水蒸气稀释剂能提高乙苯转化率的原因是________________________________ 。
②在实际生产过程中,当控制反应温度为900 K时生产效率最佳,选用此温度进行生产的原因为________ (答两点)。
③用平衡分压代替平衡浓度计算,其中,分压=总压×物质的量分数,则900K时的平衡常数Kp=_______ 。
④改变下列条件,能使乙苯的反应速率和转化率一定增大的是________ (填标号)。
A.恒容时加入稀释剂水蒸气 B.压强不变下,温度升至1500 K
C.在容积和温度不变下充入Ar D.选用催化效果更好的催化剂
(4)已知苯乙烯可催化氧化生成苯乙醛: (g) + 2O2→
(g) + 2O2→ + CO2 + H2O,若把该反应设计为酸性燃料电池,则电池负极的电极反应式为
+ CO2 + H2O,若把该反应设计为酸性燃料电池,则电池负极的电极反应式为___________________ ,若该电池消耗标准状况下11.2 L的O2,则外电路中理论上应转移电子的物质的量为________ mol。
 (g)
(g) (g)+H2(g) △H=+QkJ·mol-1
(g)+H2(g) △H=+QkJ·mol-1请回答下列问题:
(1)已知乙苯(g)、苯乙烯(g)的燃烧热分别为a kJ·mol-1、bkJ·mol-1,则氢气的燃烧热为
(2)673 K时,在一恒容密闭容器中充入5 mol乙苯(g),反应达到平衡后容器内气体的压强为p1;若再充入amol的乙苯(g),重新达到平衡后容器内气体的压强为2p1,则a
(3)在实际生产中,在恒压条件下常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),此时乙苯的平衡转化率与水蒸气的用量、压强(p)的关系如图所示。

①加入水蒸气稀释剂能提高乙苯转化率的原因是
②在实际生产过程中,当控制反应温度为900 K时生产效率最佳,选用此温度进行生产的原因为
③用平衡分压代替平衡浓度计算,其中,分压=总压×物质的量分数,则900K时的平衡常数Kp=
④改变下列条件,能使乙苯的反应速率和转化率一定增大的是
A.恒容时加入稀释剂水蒸气 B.压强不变下,温度升至1500 K
C.在容积和温度不变下充入Ar D.选用催化效果更好的催化剂
(4)已知苯乙烯可催化氧化生成苯乙醛:
 (g) + 2O2→
(g) + 2O2→ + CO2 + H2O,若把该反应设计为酸性燃料电池,则电池负极的电极反应式为
+ CO2 + H2O,若把该反应设计为酸性燃料电池,则电池负极的电极反应式为
您最近一年使用:0次
名校
5 . 乙烯的分子式为C2H4,是一种重要的化工原料和清洁能源,研究乙烯的制备和综合利用具有重要意义。请回答下列问题:
(1)乙烯的制备:工业上常利用反应C2H6(g) C2H4(g)+H2(g) △H制备乙烯。
C2H4(g)+H2(g) △H制备乙烯。
已知:Ⅰ.C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) △H1=-1556.8kJ·mol-1;
Ⅱ.H2(g)+ O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
Ⅲ.C2H6(g)+ O2(g)=2CO2(g)+3H2O(l) △H3=-1559.9kJ·mol-1。
O2(g)=2CO2(g)+3H2O(l) △H3=-1559.9kJ·mol-1。
则△H=___ kJ·mol-1。
(2)乙烯可用于制备乙醇:C2H4(g)+H2O(g) C2H5OH(g)。向某恒容密闭容器中充入a mol C2H4(g)和 a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:
C2H5OH(g)。向某恒容密闭容器中充入a mol C2H4(g)和 a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:

①该反应为____ 热反应(填“吸”或“放”),理由为____ 。
②A点时容器中气体的总物质的量为____ 。已知分压=总压×气体物质的量分数,用气体分压替代浓度计算的平衡常数叫压强平衡常数(KP),测得300℃时,反应达到平衡时该容器内的压强为b MPa,则A点对应温度下的KP=____ MPa-1(用含b的分数表示)。
③已知:C2H4(g)+H2O(g) C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是
C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是___ (填选项字母)。
A.k正增大,k逆减小 B.k正减小,k逆增大
C.k正增大的倍数大于k逆 D.k正增大的倍数小于k逆
④若保持其他条件不变,将容器改为恒压密闭容器,则300℃时,C2H4(g)的平衡转化率__ 10%(填“>”“<”或“=”)。
(3)乙烯可以被氧化为乙醛(CH3CHO),电解乙醛的酸性水溶液可以制备出乙醇和乙酸,则生成乙酸的电极为_____ 极(填“阴”或“阳”),对应的电极反应式为___ 。
(1)乙烯的制备:工业上常利用反应C2H6(g)
 C2H4(g)+H2(g) △H制备乙烯。
C2H4(g)+H2(g) △H制备乙烯。已知:Ⅰ.C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) △H1=-1556.8kJ·mol-1;
Ⅱ.H2(g)+
 O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
O2(g)=H2O(1) △H2=-285.5kJ·mol-1;Ⅲ.C2H6(g)+
 O2(g)=2CO2(g)+3H2O(l) △H3=-1559.9kJ·mol-1。
O2(g)=2CO2(g)+3H2O(l) △H3=-1559.9kJ·mol-1。则△H=
(2)乙烯可用于制备乙醇:C2H4(g)+H2O(g)
 C2H5OH(g)。向某恒容密闭容器中充入a mol C2H4(g)和 a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:
C2H5OH(g)。向某恒容密闭容器中充入a mol C2H4(g)和 a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:
①该反应为
②A点时容器中气体的总物质的量为
③已知:C2H4(g)+H2O(g)
 C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是
C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是A.k正增大,k逆减小 B.k正减小,k逆增大
C.k正增大的倍数大于k逆 D.k正增大的倍数小于k逆
④若保持其他条件不变,将容器改为恒压密闭容器,则300℃时,C2H4(g)的平衡转化率
(3)乙烯可以被氧化为乙醛(CH3CHO),电解乙醛的酸性水溶液可以制备出乙醇和乙酸,则生成乙酸的电极为
您最近一年使用:0次
2019-09-17更新
|
793次组卷
|
6卷引用:辽宁省凤城市第一中学2020届高三12月月考化学试题
辽宁省凤城市第一中学2020届高三12月月考化学试题河南省顶级名校2020届高三上学期开学摸底考试化学试题山东省日照一中2020届高三新高考3月份自测化学试题宁夏石嘴山市第三中学2020届高三一模考试理综化学试题(已下线)《2020年新高考政策解读与配套资源》2020年山东新高考化学全真模拟卷(二)黑龙江省大庆铁人中学2020届高三考前模拟训练(一)理科综合化学试题



