名校
1 . 水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C(s) + H2O(g) CO(g) +H2(g) △H=+131.3 kJ·mol-1。
CO(g) +H2(g) △H=+131.3 kJ·mol-1。
(1)该反应的平衡常数K随温度的升高而___________ (选填“增大”“ 减小”或“不变”)
(2)上述反应达到平衡后,将体系中的C(s)部分移走,平衡____________ (选填“向左移”“向右移”或“不移动”)。
(3)下列事实能说明该反应在一定条件下已达到平衡状态的有___________ (填序号)。
A.单位体积内每消耗1 mol CO的同时生成1molH2
B.混合气体总物质的量保持不变
C.生成H2O(g)的速率与消耗CO的速率相等
D.H2O(g)、CO、H2的浓度相等
(4)某温度下,将4.0 mol H2O(g)和足量的炭充入2 L的密闭容器中,发生如下反应,C(s)+ H2O(g) CO(g)+H2(g),达到平衡时测得K=1,则此温度下H2O(g)的转化率为
CO(g)+H2(g),达到平衡时测得K=1,则此温度下H2O(g)的转化率为_____ 。
(5)已知:① C(s)+H2O(l) =CO(g)+H2(g) △H1
② 2CO(g)+O2(g)=2CO2(g) △H2
③ H2O (l)=H2(g)+1/2 O2(g) △H3
则C(s)+O2(g)=CO2(g)的△H=_____________________ 。
(6)若设计以一氧化碳为燃料的碱性燃料电池,则正极为通入_______ (填化学式)的一极,其电极反应式是:__________________________________________________ 。
 CO(g) +H2(g) △H=+131.3 kJ·mol-1。
CO(g) +H2(g) △H=+131.3 kJ·mol-1。(1)该反应的平衡常数K随温度的升高而
(2)上述反应达到平衡后,将体系中的C(s)部分移走,平衡
(3)下列事实能说明该反应在一定条件下已达到平衡状态的有
A.单位体积内每消耗1 mol CO的同时生成1molH2
B.混合气体总物质的量保持不变
C.生成H2O(g)的速率与消耗CO的速率相等
D.H2O(g)、CO、H2的浓度相等
(4)某温度下,将4.0 mol H2O(g)和足量的炭充入2 L的密闭容器中,发生如下反应,C(s)+ H2O(g)
 CO(g)+H2(g),达到平衡时测得K=1,则此温度下H2O(g)的转化率为
CO(g)+H2(g),达到平衡时测得K=1,则此温度下H2O(g)的转化率为(5)已知:① C(s)+H2O(l) =CO(g)+H2(g) △H1
② 2CO(g)+O2(g)=2CO2(g) △H2
③ H2O (l)=H2(g)+1/2 O2(g) △H3
则C(s)+O2(g)=CO2(g)的△H=
(6)若设计以一氧化碳为燃料的碱性燃料电池,则正极为通入
您最近一年使用:0次
名校
2 . 硫元素在自然界中通常以硫化物、硫酸盐或单质的形式存在,其单质和化合物在工农业生产中有着重要的作用。
(1)硫元素在周期表中的位置为___________ ,其最简单气态氢化物的电子式为_________ 。
(2)在工业上SO2可以用于制备H2SO4。
已知SO2(g)+ O2(g)+H2O(g)=H2SO4(l) △H1=-272.5kJ·mol-1
O2(g)+H2O(g)=H2SO4(l) △H1=-272.5kJ·mol-1
H2O(g)=H2O(l) △H2=-44kJ·mol-1
SO3(g)+H2O(l)=H2SO4(l) △H3=-130kJ·mol-1
则2SO2(g)+O2(g)=2SO3(g) △H=_____________ kJ·mol-1
(3)某兴趣小组同学探究SO2的还原性,使用的药品和装置如图所示:
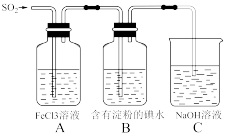
A瓶中发生反应的离子方程式为_______________________ 。B瓶中出现的现象为________ 。若要证明A、B的反应中SO2均显现还原性被氧化为SO42—,可以采取的操作和现象是_______________________________________ 。
(4)硫的氧化物排放到大气中会造成空气污染,常温常压下用如图所示传感器可以检测空气中SO2的含量。下列关于该传感器的叙述正确的是__________ (填序号)。
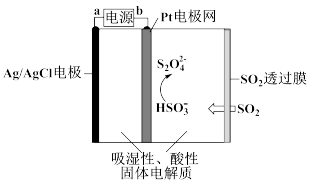
A. a为电源的正极
B. Pt电极网上发生氧化反应
C.当电路中电子转移0.5mol时,进入传感器的SO2为11.2L
D.阴极的电极反应是2HSO3—+2H+-2e—=S2O42—+2H2O
(1)硫元素在周期表中的位置为
(2)在工业上SO2可以用于制备H2SO4。
已知SO2(g)+
 O2(g)+H2O(g)=H2SO4(l) △H1=-272.5kJ·mol-1
O2(g)+H2O(g)=H2SO4(l) △H1=-272.5kJ·mol-1H2O(g)=H2O(l) △H2=-44kJ·mol-1
SO3(g)+H2O(l)=H2SO4(l) △H3=-130kJ·mol-1
则2SO2(g)+O2(g)=2SO3(g) △H=
(3)某兴趣小组同学探究SO2的还原性,使用的药品和装置如图所示:

A瓶中发生反应的离子方程式为
(4)硫的氧化物排放到大气中会造成空气污染,常温常压下用如图所示传感器可以检测空气中SO2的含量。下列关于该传感器的叙述正确的是

A. a为电源的正极
B. Pt电极网上发生氧化反应
C.当电路中电子转移0.5mol时,进入传感器的SO2为11.2L
D.阴极的电极反应是2HSO3—+2H+-2e—=S2O42—+2H2O
您最近一年使用:0次
3 . 大气污染是由于人类活动或自然过程引起某些物质进入大气中,呈现出足够的浓度,达到足够的时间,并因此危害了人体的舒适、健康、福利和环境的现象。大气污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。
(1)汽车尾气中的CO、NOx、碳氢化合物是大气污染物。
①使用稀土等催化剂能将CO、NOx转化成无毒物质。
已知:N2(g)+O2(g)=2NO(g) △H1=a kJ/mol
2C(s)+O2(g)=2CO(g) △H2=b kJ/mol
C(s)+O2(g)=CO2(g) △H3= c kJ/mol
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式________ 。
(2)汽车尾气中常含有NO,是因为高温下N2和O2发生反应,N2(g)+O2(g)⇌2NO(g)。
①如图是在T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图象,据此回答下列问题:N2(g)+O2(g)⇌2NO(g)为_____ (填“吸热"或“放热”)反应。

②2000℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2mol,则此刻反应的平衡常数K=___ 。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________ 。
(3)O3、醛类、PAN(过氧硝酸乙酰)等污染物气体和颗粒物所形成的烟买称为光化学烟雾。来研究性学习小组为模拟光化学烟雾的形成,用紫外线照射装在密闭容器内的被污染空气样品,所得物质的浓度随时间的变化如图所示。

则下列说法正确的是________ (填序号)
A. O3具有强氧化性
B.200 min左右O3生成PAN的反应速率最快
C.二次污染物只有醛类物质
D.NO的消失速率比烃类快
(4)TiO2在紫外线照射下会使空气中的某些分子产生活性自由基OH,OH能将NO、NO2氧化,如图所示,OH与NO2的反应为NO2+OH=HNO3。请根据图中给出的信息,写出OH与NO反应的化学方程式:________ 。

(5)如图所示的装置能吸收和转化NO2、NO和SO2。
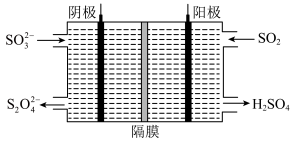
则阳极区的电极反应式为____________ ,产生的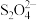 可以用于吸收NO2。
可以用于吸收NO2。
(1)汽车尾气中的CO、NOx、碳氢化合物是大气污染物。
①使用稀土等催化剂能将CO、NOx转化成无毒物质。
已知:N2(g)+O2(g)=2NO(g) △H1=a kJ/mol
2C(s)+O2(g)=2CO(g) △H2=b kJ/mol
C(s)+O2(g)=CO2(g) △H3= c kJ/mol
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式
(2)汽车尾气中常含有NO,是因为高温下N2和O2发生反应,N2(g)+O2(g)⇌2NO(g)。
①如图是在T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图象,据此回答下列问题:N2(g)+O2(g)⇌2NO(g)为

②2000℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2mol,则此刻反应的平衡常数K=
(3)O3、醛类、PAN(过氧硝酸乙酰)等污染物气体和颗粒物所形成的烟买称为光化学烟雾。来研究性学习小组为模拟光化学烟雾的形成,用紫外线照射装在密闭容器内的被污染空气样品,所得物质的浓度随时间的变化如图所示。

则下列说法正确的是
A. O3具有强氧化性
B.200 min左右O3生成PAN的反应速率最快
C.二次污染物只有醛类物质
D.NO的消失速率比烃类快
(4)TiO2在紫外线照射下会使空气中的某些分子产生活性自由基OH,OH能将NO、NO2氧化,如图所示,OH与NO2的反应为NO2+OH=HNO3。请根据图中给出的信息,写出OH与NO反应的化学方程式:

(5)如图所示的装置能吸收和转化NO2、NO和SO2。

则阳极区的电极反应式为
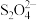 可以用于吸收NO2。
可以用于吸收NO2。
您最近一年使用:0次
4 . Ⅰ.当前环境问题是一个全球重视的问题,引起环境问题的气体常见的有温室气体CO2、污染性气体NOx、SOx等。如果对这些气体加以利用就可以成为重要的能源,既解决了对环境的污染,又解决了部分能源危机问题。
(1)二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇,甲醇是汽车燃料电池的重要燃料。 CH3OH在酸性介质中的电极反应式为__________________________ 。
(2)用稀硝酸吸收NOx,得到HNO3和HNO2(弱酸)的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:________________________ 。
(3)在高温下一氧化碳可将二氧化硫还原为单质硫。
已知:①C(s)+O2(g)===CO2(g)ΔH1=-393.5 kJ·mol-1
②CO2(g)+C(s)===2CO(g)ΔH2=+172.5 kJ·mol-1
③S(s)+O2(g)===SO2(g)ΔH3=-296.0 kJ·mol-1
请写出CO与SO2反应的热化学方程式__________________________
Ⅱ.(1)Na2CO3溶液去油污的原因:_____________________ 。(用化学用语表示)
(2)已知部分弱酸的电离平衡常数如下表:
则该温度下CH3COONa的pH_______ (填‘大于’、‘等于’或‘小于’)NaHCO3的pH。
(3)25 ℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈________ (填“酸性”“中性”或“碱性”)。
(4)0.1mol/L NH4 Cl溶液中, c(NH4+)+c(NH3•H2O) =________ mol/L 。
(1)二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇,甲醇是汽车燃料电池的重要燃料。 CH3OH在酸性介质中的电极反应式为
(2)用稀硝酸吸收NOx,得到HNO3和HNO2(弱酸)的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:
(3)在高温下一氧化碳可将二氧化硫还原为单质硫。
已知:①C(s)+O2(g)===CO2(g)ΔH1=-393.5 kJ·mol-1
②CO2(g)+C(s)===2CO(g)ΔH2=+172.5 kJ·mol-1
③S(s)+O2(g)===SO2(g)ΔH3=-296.0 kJ·mol-1
请写出CO与SO2反应的热化学方程式
Ⅱ.(1)Na2CO3溶液去油污的原因:
(2)已知部分弱酸的电离平衡常数如下表:
| 弱酸 | CH3COOH | H2CO3 |
| 25℃ | K=1.77×10﹣4 | K1=4.3×10﹣7 K2=5.6×10﹣11 |
则该温度下CH3COONa的pH
(3)25 ℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈
(4)0.1mol/L NH4 Cl溶液中, c(NH4+)+c(NH3•H2O) =
您最近一年使用:0次
名校
5 . (1)已知H—H键键能(化学键断裂时吸收或形成时释放的能量)为436 kJ/mol,N—H键键能为391 kJ/mol,根据热化学方程式:N2(g)+3H2(g)===2NH3(g)ΔH=-92.4 kJ/mol,可知 键的键能是
键的键能是______________ kJ/mol
(2)碳(s)在氧气供应不充足时,生成CO同时还部分生成CO2,因此无法通过实验直接测得反应:C(s)+1/2O2(g)===CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有________
(3)运动会中的火炬一般采用丙烷(C3H8)为燃料。丙烷热值较高,污染较小,是一种优良的燃料。试回答下列问题:
①如图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图,图中的括号内应填入___ (“+”或“-”)。
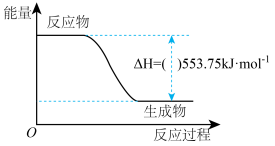
②写出表示丙烷燃烧热的热化学方程式:___________________________ 。
(4)高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
由以上表格中数据判断以下说法不正确的是__________ 。
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中酸性最强的酸
C.在冰醋酸中硫酸的电离方程式为: H2SO4 = 2H++S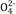
D.水对这四种酸的强弱没有区分能力,但冰醋酸可以区分这四种酸的强弱
(5)常温下,0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数值变大的是________________ 。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(CH3COO-) D.c(CH3COOH)
 键的键能是
键的键能是(2)碳(s)在氧气供应不充足时,生成CO同时还部分生成CO2,因此无法通过实验直接测得反应:C(s)+1/2O2(g)===CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有
(3)运动会中的火炬一般采用丙烷(C3H8)为燃料。丙烷热值较高,污染较小,是一种优良的燃料。试回答下列问题:
①如图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图,图中的括号内应填入

②写出表示丙烷燃烧热的热化学方程式:
(4)高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
| 酸 | HClO4 | H2SO4 | HCl | HNO3 |
| Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
由以上表格中数据判断以下说法不正确的是
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中酸性最强的酸
C.在冰醋酸中硫酸的电离方程式为: H2SO4 = 2H++S
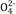
D.水对这四种酸的强弱没有区分能力,但冰醋酸可以区分这四种酸的强弱
(5)常温下,0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数值变大的是
A.c(H+) B.c(H+)/c(CH3COOH) C.c(CH3COO-) D.c(CH3COOH)
您最近一年使用:0次
2017-11-18更新
|
155次组卷
|
3卷引用:贵州省遵义航天高级中学2017-2018学年高二上学期期中考试化学试题



